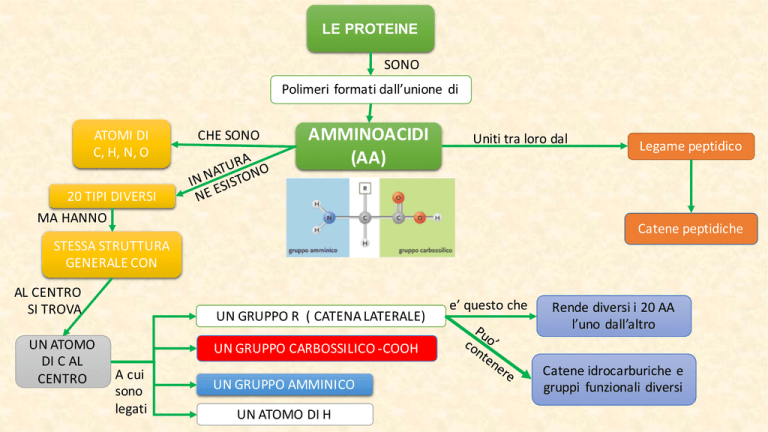
LE PROTEINE
SONO
Polimeri formatidall’unione di
ATOMIDI
C,H,N,O
CHESONO
AMMINOACIDI
(AA)
Unititralorodal
20TIPIDIVERSI
MAHANNO
Catenepeptidiche
STESSASTRUTTURA
GENERALECON
ALCENTRO
SITROVA
UNATOMO
DICAL
CENTRO
Legamepeptidico
UNGRUPPOR (CATENALATERALE)
e’ questoche
Rendediversii20AA
l’uno dall’altro
UNGRUPPOCARBOSSILICO-COOH
Acui
sono
legati
UNGRUPPOAMMINICO
UNATOMODIH
Cateneidrocarburiche e
gruppi funzionali diversi
LASTRUTTURADELLEPROTEINE
UNAPROTEINA
PUO’ESSERE
FORMATA
LACUISTRUTTURAVIENE
DISTINTASECONDO4LIVELLI
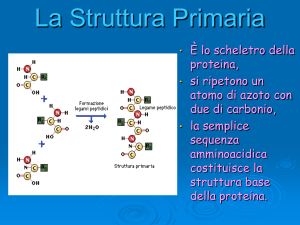
STRUTTURA
PRIMARIA
STRUTTURA
QUATERNARIA
STRUTTURA
SECONDARIA
UNASOLACATENA
PEPETIDICA
PIU’CATENE
PEPETIDICHE
CHESIATTORCIGLIANOSUSE
STESSEOSIRIPIEGANO
ASSUMENDOFORME
PARTICOLARI
E’LASEQUENZADEGLI
AMMINOACIDICHE
FORMANOUNA
SINGOLACATENA
PEPETIDICA
STRUTTURA
TERZIARIA
E’ILMODOINCUIUNACATENA
PEPTIDICASIDISPONENELLO
SPAZIOPERESEMPIO
ATTORCIGLIANDOSIASPIRALE
QUANDOPIU’
CATENESI
RIPIEGANOTRA
LORO
E’ILRISULTATODEL
RIPIEGAMENTODI
UNACATENA
PEPTIDICAINUNA
FORMAPIU’
COMPLESSA
Le catene
polipeptidiche
possono
avvolgersi lungo
il proprio asse
o formare interazioni
tra due tratti di
catena proteica
struttura β
NEGLI AMMINOACIDI IL GRUPPO AMMINICO (BASICO)
E IL GRUPPO CARBOSSILICO (ACIDO) INTERAGISCONO,
FORMANDO UNO IONE DIPOLARE (ZWITTERIONE). IL PH AL QUALE
L’AA E’ SOTTO FORMA DI ZWITTERIONE
H
SI DICE PH ISOELETTRICO
(E’ CARATTERISTICO PER OGNI AMMINOACIDO)
R
C
COO-
PERCIO’ GLI AA SONO SOLUBILI IN ACQUA (PRESENZA DI GRUPPI IONICI )
MENTRE A TEMPERATURA AMBIENTE GLI AA SONO SOLIDI A CAUSA DEI
LEGAMI IONICI TRA GLI IONI DIPOLARI.
NH3+
GLI AMMINOACIDI MOSTRANO QUINDI SIA PROPRIETA’ ACIDE CHE BASICHE E IL PH DELLE LORO
SOLUZIONI DIPENDE DALLA FORZA DEI GRUPPI NH3+ E COO- ,TUTTAVIA ALCUNI AA CONTENGONO PIU’ DI
UN GRUPPO ACIDO O BASICO E QUINDI DA QUESTO DIPENDE IL PH DELLE LORO SOLUZIONI
A SECONDA DELLA NATURA
DEL RADICALE R,
GLI AMMINOACIDI SI
CLASSIFICANO IN:
AMMINOACIDI CON
• R POLARE (IDROFILICO)
• R APOLARE (IDROFOBICO)
• R CATIONICO (BASICO)
• R ANIONICO (ACIDO)
R apolare(IDROFOBICO)
R neutropolare(IDROFILICO)
R CARICOACIDO
R CARICOBASICO
LA PREVALENZA DI AMMINOACIDI BASICI
SU QUELLI NEUTRI ED ACIDI CONFERISCE
ALLA LANA UN CARATTERE BASICO E
QUESTO NE DETERMINA UN’ELEVATA
AFFINITÀ PER I COLORANTI ACIDI
NELLALANAMERINALASEQUENZADEGLIAMMINOACIDIE’:
…
ALA
PRO
ARG
CYS
CYS
SER
VAL
ARG
THR
GLY
PRO
ALA
THR
THR
ILE
CYS
SER
SER
…
CYS
THR
SER
PRO
LEU
CYS
VAL
GLY
CYS
ARG
CYS
PHE
LYS
ASP
SIPOSSONOFORMARELEGAMI
INTRACATENA (TRAATOMIDENTROLA
STESSACATENA):
• LEGAMIAPONTECISTINICI(PONTEDI
SOLFURO–S-S- TRA2UNITA’DICISTEINA
• LEGAMIAIDROGENO(TRAGRUPPI
POLARINONCONSECUTIVIDELLASTESSA
CATENA)
OPPURESIPOSSONOFORMARELEGAMI
INTERCATENA (TRA2CATENE
PEPTIDICHE)
LEGAMIINTERCATENA=FAVORISCONOLAFORMAZIONEDIZONE
CRISTALLINE
LEGAMIINTRACATENA=FAVORISCONOLAFORMAZIONEDIZONE
AMORFE(PONTIADHSTABILIZZANOLASTRUTTURAALFAELICADELLA
CHERATINA)
• LEGAMIAPONTESALINO(DITIPO
IONICOTRARESIDUIANIONICICOO- E
CATIONICINH3+
• LEGAMIAPONTECISTINICI(TRAUNITA’
DICISTEINA,LEGAMICOVALENTI–S-S-)
• LEGAMIAIDROGENO(LEGAMIPIU’
DEBOLI)
LEGAMI INTERCATENA (INTER CHAIN)
• LEGAMIAPONTECISTINICI(PONTEDISOLFURO–S-S- TRA2UNITA’DI
CISTEINADICATENEDIVERSE)
LEGAMI INTRACATENA (INTRA CHAIN)
• LEGAMIAPONTECISTINICI(PONTEDISOLFURO–S-S- TRA2UNITA’DI
CISTEINACONTIGUE)
LA CHERATINA DELLA LANA ( E ANCHE DEI CAPELLI E DELLE
UNGHIE)PRESENTA LA FORMA STRUTTURALE AD ALFA ELICA
I RESIDUI AMMINOACIDICI (-R) SPORGONO ESTERNAMENTE DAL
FILAMENTO SPIRALIZZATO (ELICA)
MA QUANDO E’ SOTTOPOSTA A TENSIONE ASSUME LA FORMA A
FOGLIETTO O BETA.
due o più filamenti beta tendono
ad affiancarsi lateralmente ed a
legarsi tramite ponti a idrogeno,
generando strutture estese,
pieghettate, dette foglietti β