•
Ammine
Composti organici derivati dall'ammoniaca per sostituzione di 1, 2 o
3 idrogeni con gruppi organici.
• Come l'ammoniaca, anche le ammine sono basiche; rappresentano le
più importanti basi organiche presenti in natura.
• Svolgono numerose funzioni biologiche:
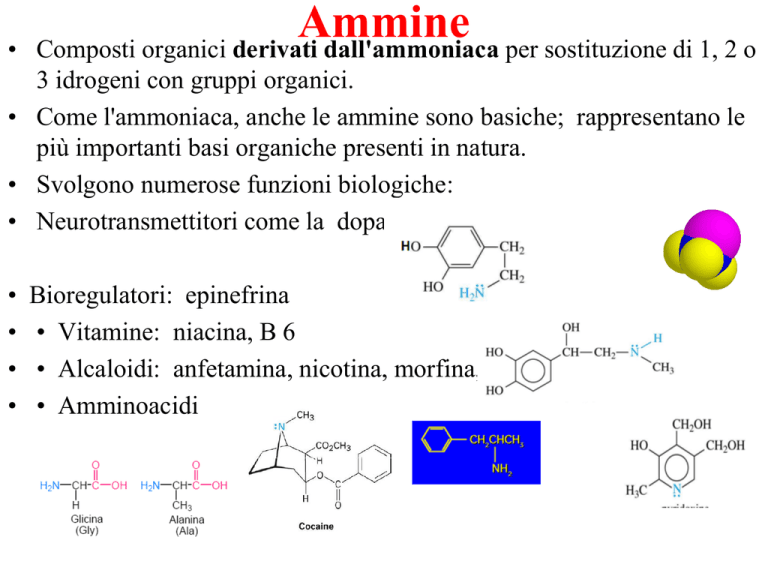
• Neurotransmettitori come la dopamina
•
•
•
•
Bioregulatori: epinefrina
• Vitamine: niacina, B 6
• Alcaloidi: anfetamina, nicotina, morfina, cocaina
• Amminoacidi
Ammine
vengono classificate come:
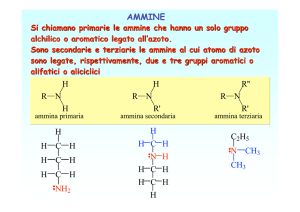
• Ammine primarie
• Ammine secondarie
• Ammine terziarie
• Gli elettroni dell'atomo di N sono ibridati sp3, e la molecola ha forma piramidale.
L'atomo di azoto delle ammine porta un doppietto
elettronico non condiviso; per questo motivo
gli orbitali dell’azoto sono ibridati sp3,
geometria quasi tetraedrica
Nomenclatura 1° parte
• Ammine alifatiche: gruppo alchilico + ammina
• In questo sistema, il nome delle ammine secondarie e terziare è composto da un
prefisso che comprende tutte le catene carboniose, ad eccezione di quella più
lunga
• Ammine legate ad un anello aromatico: derivati dell'anilina o del sistema
aromatico.
:
Nomenclatura 2° parte
Se sono presenti altri gruppi funzionali, l'amminogruppo viene sempre considerato un
sostituente:
Le ammine aromatiche sono considerate dei derivati dell'anilina.
Proprieta' fisiche
• Le ammine sono generalmente liquide eccetto la metil- e dimetil-ammina, che sono
gassose.
• I punti di ebollizione sono molto superiori a quelli dei corrispondenti alcani, ma
inferiori a quelli degli alcoli. I legami idrogeno N-H...N sono piu' deboli di quelli
O-H...O
• Le ammine I, II e III possono formare legami H con l'acqua, e le ammine fino a 5-6
atomi di C sono molto solubili in acqua.
• Le ramificazioni aumentano la solubilità.
• La maggior parte delle ammine puzza di pesce marcio
• Le ammine 3° si comportano similmente agli eteri.
• Il loro comportamento basico fa sì che la loro solubilità aumenta molto in ambiente
acido. Questo le distingue dagli alcoli.
NH2CH2CH2CH2CH2CH2NH2
1,5-pentandiamina o cadaverina
Proprietà fisiche
Sintesi delle Ammine
•
Alchilazione dell’ammoniaca e delle ammine con alogenuri alchilici (reazione di
Hoffman)
IL PROCESSO AVVIENE IN DUE PASSAGGI:
2.Successivamente si libera l’ammina trattando il suo sale con una base forte
R-NH3X + NaOH → RNH2 + H2O + NaX
Si possono alchilare anche:
RNH2 + R’X → RNH + HX
le ammine primarie
Per ottenere le
ammine secondarie
R’
le ammine secondarie, con lo stesso meccanismo producono le terziarie e da queste si possono
ottenere i Sali quaternari.
Riduzione dei composti azotati
• Le ammine aromatiche primarie si ottengono dalla riduzione dei corrispondenti
nitrocomposti, ed è un metodo usato comunemente per sintetizzare aniline.
– NO2 può essere ridotto a –NH2 in diverse
condizioni:
– un idruro e un acido di Lewis (NaBH4 + NiCl2)
– un metallo attivo in soluzione acida (Fe/AcOH o
HCl, Sn/HCl, Zn/AcOH (Clemmensen))
– per idrogenazione catalitica in fase eterogenea o
omogenea
Riduzione delle ammidi
• Un cloruro di un acido reagisce con ammoniaca, un’ammina 1° o
2°per dare un’ammide.
• Il C=O dell’ammide viene ridotto a CH2 con LiAlH4.
Riduzione dei nitrili
• Il cianuro –C≡N è un buon nucleofilo per SN2.
• La riduzione del nitrile con H2/cat o LiAlH4 fornisce il
gruppo –CH2NH2
• (1 C in più rispetto alla catena originaria)
Come si ottengono i nitrili?
N.B. dimetilsolfossido (DMSO) è usato come solvente
Proprietà chimiche
IL COMPORTAMENTO CHIMICO
è dovuto in gran parte al doppietto non condiviso dell’azoto presente anche
nell'ammoniaca: esse sono basi e agenti nucleofili. Sono basi più forti
dell’acqua, per cui prendono un protone da questa, lasciando ioni idrossido.
Le loro soluzioni quindi sono basiche
R-NH2 + H2O R-NH3+ + OHIL DOPPIETTO NON CONDIVISO è responsabile della
solubilità in acqua
basicità
proprietà nucleofile
proprietà ligande (formano complessi con ioni metallici)
Le ammine sono basi di Brönsted
H+
Sono le basi tipiche
della chimica
organica.
H
N
R
H
Le ammine terziarie reagiscono con acidi per dare sali di
ammonio quaternario.
La loro basicità cresce dall'ammoniaca alle ammine
secondarie;
I gruppi alchilici legati all’azoto aumentano la
densità di carica nell’orbitale atomico,
per effetto induttivo positivo.
N
H3C
quelle terziarie
sono spesso meno
basiche delle
secondarie.
H
CH3
Kb = 6 • 10-4
N
CH3
H
CH 3
Kb = 5 • 10-4
N
H
H+
H
H
CH3
Kb = 6.6 • 10-5
N
H 3C
CH 3
H+
H+
H
H
H
N
N
N
CH3
CH 3
H
H
CH3
H3C
CH3
CH 3
CH3
H2O
H
H2O
H
N
H
CH3
N
CH 3
H3C
H
H2O
N
H
H
CH3
CH 3
CH3
La scarsa solvatazione
del catione deprime
la basicità
delle ammine terziarie
Le ammine aromatiche sono basi più deboli
delle ammine alifatiche
NH2
NH2
NH2
NH2
Perché la coppia elettronica non condivisa è delocalizzata per risonanza.
La risonanza stabilizza la forma non protonata dell’anilina
NH2
+ NH3
Kb = 4.2 x 10 -10
+ H2O
+ OH -
meno debole
più debole
(-)
+
NH2
(-)
(-)
NH2
+
NH2
+
NH2
+
Basi deboli perché il doppietto non è disponibile
benzenammina
cicloesanammina
Kb = 4,2 • 10-10
N
H
H
Coppia delocalizzata
sull’anello protonazione
più difficile minor basicità
Kb = 5,5 • 10-4
N
H
H
Coppia non delocalizzata
sull’anello maggior basicità
ammine
Basicità
NH2
OMe
NH2
elettrondonatore
NH2
NO2
elettronattrattore
Ammine aromatiche
localizzazione della carica negativa
NH2
OMe
Metossi anilina
NH2
NH2
anilina
NO2
Nitro anilina
Basicità
ammina
struttura
pKa
dietilammina
Et2NH
11.1
etilammina
EtNH2
10.8
tbutilammina
(Me)3CNH2
10.4
trietilamina
Et3N
9.7
ammoniaca
NH3
9.3
anilina
C6H5NH2
4.6
Per il loro carattere basico, le
ammine reagiscono con gli acidi
minerali come basi di Brönsted,
trasformandosi in sali di
alchilammonio.
H
N
H
HCl
N
H
CH3
H
Cl
-
H
CH3
cloruro
di metil ammonio
H
-
N
H3C
HONO2
H
CH3
N
H3C
ONO2
H
CH3
nitrato
di di-metil ammonio
H
N
H3C
HOOCCH3
CH3
CH3
H3C
-
OOCCH3
N
CH3 acetato
di tri-metil ammonio
CH
3
Le ammine sono basi di Lewis (nucleofili)
NH2
H N
H
C2H5
C2H5
C2H5
H5C2
N
H
H5C2
N
C2H5
Carattere nucleofilo delle ammine
Reazione con alogenoderivati
Alchilazione delle ammine
1
d- I
sale di dialchil ammonio
d+ C
H
H
H
N
H
H
CH3
ammina primaria
H
H
H
C
N
H
CH3
I-
H
CH3
N
H
CH3
HI
ammina secondaria
2
I
H
H
C
H
H
H
C
N
H
sale di trialchil ammonio
CH3
CH3
ammina secondaria
N
H
H
CH3
I-
CH3
CH3
N
CH3
CH3
HI
ammina terziaria
3
I
H
H
C
H
H
H
C
N
H3C
sale di tetraalchil ammonio
CH3
CH3
ammina terziaria
N
H3C
H
ICH3
CH3
La metilazione esauriente del 2-amminoetanolo
(etanolammina) porta alla formazione del sale di
tetrametilammonio corrispondente (colina)
OH
OH
OH
OH
H C H
H C H
H
C
H
H
C
H
H C H
H C H
H
C
H
H
C
H
H N
H N
H3C
N
H
etanolammina
CH3
CH3
H3C
N CH3
CH3 X
colina
(cloruro)
Reazione delle ammine primarie
con acido nitroso, HNO2
(nitrato (III) di idrogeno)
a)
HO N
+
O
H
H
O N
O
N
H
O
N
O
catione nitrosile
b)
H
H
R N
N
H
O
R N N
H
O
R N N
ione diazonio
H 2O
H+
R OH
N2
Reazione delle ammine secondarie
con acido nitroso, HNO2
(nitrato (III) di idrogeno)
R'
R N
H
N O
catione nitrosile
R'
R N N O
H
H+
R'
R N
N O
nitrosammina
Reazione delle ammine terziarie
con acido nitroso, HNO2
(nitrato (III) di idrogeno)
R'
R N
R''
N O
catione nitrosile
R'
R N N O
R''
ione trialchilnitrosammonio
Reazione delle ammine aromatiche
con acido nitroso, HNO2
(nitrato (III) di idrogeno)
Le ammine aromatiche primarie reagiscono con i nitriti
in ambiente acido per dare sali di diazonio,
stabili a bassa temperatura.
NH2
N
N
N
N
NaNO2 (H+)
in acqua a 0°C
catione diazonio
Formazione delle basi di Schiff
O
H
N R'
R C
H
H
H2O
O H
R C N
H H
R'
N R'
R C
H
aldimmina
(base di Schiff)
Le ammine primarie agiscono da nucleofili
nei confronti dei composti carbonilici.
Le ammine secondarie e terziarie
non possono dare questa reazione.
Reazione delle ammine primarie e secondarie
con i derivati degli acidi carbossilici
O
H+
H
R C
N R'
R C
X
H
O
O
X-
N
H
H
R'
R C
N H
R'
ammide
FINE