Durante la via glicolitica che avviene nel citosol il glucosio
viene convertito in piruvato. In condizioni aerobiche
tramite la decarbossilazione ossidativa del piruvato si
forma acetil coenzima A (acetil CoA)
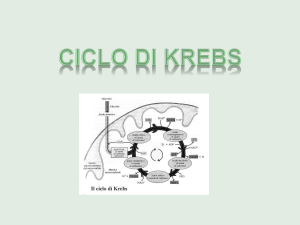
Il ciclo di Krebs è la via finale comune per l’ossidazione
delle molecole di sostanze nutrienti riconducibili a tre
gruppi essenziali rappresentati da aminoacidi, acidi
grassi e carboidrati. Negli eucarioti le reazioni del ciclo
di Krebs hanno luogo nei mitocondri
Glucosio
Glucidi
Glucosio
ATP
Ac. Lattico
Glucosio-6-P
Glucosio-1-P
Gluconeogenesi
Shunt dei pentoso fosfato
Glicolisi
Ribulosio-5-P
Pi
Glicogeno
Ac. Piruvico
AA
Biosintesi degli acidi grassi
Acil-CoA
Acetil-CoA
b-ossidazione
Corpi
chetonici
Acetoacetil-CoA
Acidi grassi
Ac. Ossalacetico
Ac. Fumarico
Trigliceridi
Ciclo
di
Krebs
AA
Ac. a-Chetoglutarico
AA
Acidi grassi
Lipidi
Succinil-CoA
Protidi
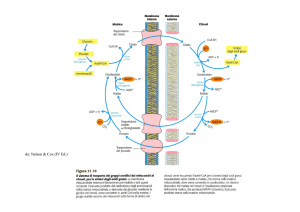
Localization of
Krebs Cycle:
matrix
Glycolysis occurs in
the cytosol of cells.
interPyruvate enters the
membrane
cristae
space
mitochondrion to be
metabolized further.
inner
outer
membrane mitochondrion membrane
Mitochondrial
Compartments:
The matrix contains Pyruvate
Dehydrogenase, enzymes of Krebs Cycle,
and other pathways, e.g., fatty acid
oxidation & amino acid metabolism.
matrix
cristae
Mitochondrial
compartments
intermembrane
space
inner
membrane mitochondrion
outer
membrane
Inner membrane infoldings, called cristae, contain
constituents of the respiratory chain & ATP
Synthase.
The inner membrane is the major permeability
barrier.
It contains various transport catalysts, including a
carrier protein that allows pyruvate to enter the
Il ciclo di Krebs non utilizza direttamente
l’ossigeno per alcuna delle sue reazioni, tuttavia
necessita del metabolismo ossidativo dei
mitocondri per la riossidazione dei nucleotidi
ridotti.
Il ciclo di Krebs ha due importanti funzioni:
produrre energia e fornire precursori per le
biosintesi
I cianuri sono usati in metallurgia e l’esposizione
ad acido cianidrico può avvenire nei laboratori
chimici o nella combustione di materie plastiche
(nitrocellulosa e poliuretani)
L’azione tossica del cianuro si esplica attraverso
l’inibizione dello stato terminale nel sistema di
ossidazione: il piruvato non si ossida ulteriormente
nel ciclo dell’acido citrico, ma piuttosto si riduce a
lattato
Il substrato di partenza per il ciclo di Krebs è l’acetilCoenzima A (acetil-CoA), un prodotto comune
dell’ossidazione dei carboidrati, degli acidi grassi e
degli aminoacidi. L’acetil-CoA viene ossidato per
permettere la riduzione dei coenzimi coinvolti nelle
quattro reazioni di ossidazione del ciclo
In particolare, queste reazioni generano tre molecole
di nicotinamide adenina dinucleotide ridotto (NADH)
ed una molecola di flavin adenina dinucleotide ridotto
(FADH2) che, mediante la catena di trasporto degli
elettroni accoppiata alla fosforilazione ossidativa,
rilasceranno l’energia libera necessaria alla sintesi di
ATP
La formazione di acetil CoA avviene nella matrice
mitocondriale e rappresenta il legame tra la glicolisi
ed il ciclo di Krebs, la reazione irreversibile è
catalizzata dal complesso multienzimatico della
piruvato deidrogenasi
L’enzima piruvato deidrogenasi è un complesso
formato da tre tipi di enzimi: piruvato deidrogenasi
(E1), diidrolipoil transacetilasi (E2), diidrolipoil
deidrogenasi (E3)
I cofattori catalitici necessari per questi enzimi sono
rispettivamente: la tiamina pirofosfato (TPP) coinvolta
nella decarbossilazione ossidativa del piruvato, la
lipoamide coinvolta nel trasferimento del gruppo
acetile al CoA, ed il FAD coinvolto nella
rigenerazione della forma ossidata della lipoamide
Pyruvate
Dehydrogenase is a
large complex, with
multiple copies of
each of 3 enzymes:
E1, E2 & E3.
Pyruvate Dehydrogenase
Subunits
Enzyme
Abbreviated
Prosthetic Group
Pyruvate
Dehydrogenase
E1
Thiamine
pyrophosphate (TPP)
Dihydrolipoyl
Transacetylase
E2
Lipoamide
Dihydrolipoyl
Dehydrogenase
E3
FAD
Dopo la formazione della acetildiidrolipoamide
ad opera dell’enzima E1, il braccio flessibile di
E2 sposta il gruppo acetildiidrolipoamidico al
sito di legame del CoA, dove si forma acetilCoA. La diidrolipoamide ridotta si sposta su
E3 dove viene riossidata a lipoamide. Il
FADH2 è successivamente riossidato a FAD
dal NAD+, producendo NADH e rigenerando
l’enzima attivo
S
CH2
CH2
S
lipoic acid
CH
O
CH2 CH2 CH2 CH2 C
Lipoamid
e includes
a dithiol
that
undergoes
oxidation/
reduction.
lipoamide
lysine
NH
NH (CH2)4 CH
C
O
2e + 2H+
HS
CH2
CH2
HS
O
CH
CH2 CH2 CH2 CH2 C
dihydrolipoamide
NH
NH (CH2)4 CH
C
O
Gli arsenicati trivalenti (es arsenito inorganico)
sono considerati composti in grado di reagire
con i gruppi sulfidrici. In tal modo inibiscono
numerosi enzimi in quanto reagiscono con
ligandi biologici contenenti gruppi –SH
disponibili, come ad esempio la lipoamide
H2O
HS
R'
As
O
S
R'
+
HS
As
S
R
R
Organic arsenicals are potent inhibitors
of lipoamide-containing enzymes such as
Pyruvate Dehydrogenase.
These highly toxic compounds react with
“vicinal” dithiols such as the functional
group of lipoamide.
Il ciclo dell’acido citrico inizia con la
condensazione di una unità a quattro atomi di
carbonio, l’ossalacetato, con una unità a due atomi
di carbonio, il gruppo acetile dell’acetil CoA
L’ossalacetato reagisce con acetil CoA e con
acqua generando citrato e CoA. La reazione è
catalizzata dalla citrato sintasi
Il citrato viene isomerizzato a isocitrato per
permettere all’unità a sei atomi di carbonio di subire
una decarbossilazione ossidativa.
L’isomerizzazione del citrato avviene tramite una
tappa di deidratazione seguita da una di idratazione
che porta ad uno scambio di posizione tra un atomo
di idrogeno ed un gruppo ossidrilico.
L’enzima che catalizza entrambe le tappe è
chiamato aconitasi, in quanto il cis-aconitato è un
intermedio della reazione
L’aconitasi contiene atomi di ferro che sono
complessati con quattro solfuri inorganici e quattro
atomi di zolfo di altrettanti residui di cisteina.
Questo complesso ferro-zolfo si lega al citrato e
partecipa alla deidratazione e reidratazione del
substrato (citrato) legato all’enzima (aconitasi)
Il fluoroacetato, isolato originariamente dalle piante, è
un potente veleno. Esso viene attivato come
fluoroacetil-CoA e si condensa con l’ossalacetato per
formare fluorocitrato.
Il 2-fluorocitrato è un potente inibitore dell’aconitasi e
causa l’inibizione del ciclo di Krebs che può portare
alla morte.
Il fluoroacetato è un esempio di “substrato suicida”,
cioè un composto che non è di per sé tossico, ma che
viene metabolicamente trasformato in un derivato
tossico
A questo punto del ciclo iniziano le quattro reazioni
di ossido-riduzione, la decarbossilazione ossidativa
dell’isocitrato è catalizzata dalla isocitrato
deidrogenasi.
L’intermedio di questa reazione è l’ossalsuccinato,
quando questo composto è legato all’enzima perde
CO2 e forma a-chetoglutarato
La seconda reazione di decarbossilazione
ossidativa è catalizzata dal complesso dell’ achetoglutarato deidrogenasi che porta alla
formazione del succinil CoA
Il legame tioestere tra il succinato ed il CoA è un
legame ad alta energia e la scissione del legame
tioestere del succinil CoA è accoppiata alla
fosforilazione della guanosina difosfato con
formazione di GTP
Il GTP viene utilizzato come donatore di gruppi
fosforici nella sintesi proteica e nei processi di
trasduzione di segnali extracellulari
La fase finale del ciclo prevede la rigenerazione
dell’ossalacetato
Il succinato viene convertito in ossalacetato in
tre tappe: una ossidazione, una idratazione ed
una seconda reazione di ossidazione
Il succinato è ossidato a fumarato dalla
succinato deidrogenasi, questo enzima come
l’aconitasi è una proteina ferro-zolfo
La succinato deidrogenasi è parte integrale della
membrana interna dei mitocondri ed è
direttamente legata alla catena di trasporto degli
elettroni
Il FADH2 prodotto dall’ossidazione del succinato
non si dissocia dall’enzima come accade invece al
NADH prodotto nelle altre reazioni di ossidazione
L’idratazione del fumarato, catalizzata dalla
fumarasi, porta alla formazione del malato che
viene successivamente ossidato ad ossalacetato
tramite la malato deidrogenasi
Il ciclo dell’acido citrico è la via principale di
degradazione per la generazione di ATP e nello
stesso tempo è in grado di produrre intermedi
per i processi di biosintesi.
Per esempio, la maggioranza degli atomi di
carbonio della porfirina deriva dal succinil-CoA
e molti degli aminoacidi derivano dall’achetoglutarato e dall’ossalacetato
La velocità del ciclo è finemente regolata dalla necessità
di ATP della cellula. La disponibilità di NAD+ e di FAD
segnala che la carica energetica è bassa. La sintesi del
citrato dall’ossalacetato e dall’acetil CoA è un importante
punto di controllo del ciclo
L’ATP è un inibitore allosterico della citrato sintasi.
L’effetto dell’ATP è quello di aumentare la KM
dell’enzima per l’acetil CoA. Quando i livelli di ATP
aumentano, la frazione di enzima saturato con acetil
CoA diminuisce e si forma meno citrato