RESPIRAZIONE CELLULARE
ATP
VIE
GLICOLITICHE
PDH
CH3COCOOH
CATENA
RESPIRATORIA
NAD+/FAD
CH3COSCoA
CICLO
DI
KREBS
CO2 + NADH/FADH2
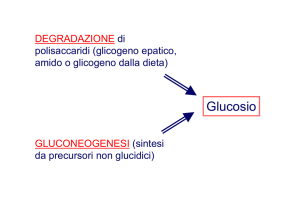
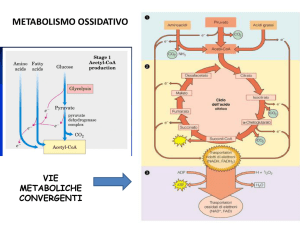
Destino del piruvato…….
Il piruvato entra nel
mitocondrio grazie ad
una proteina
trasportatrice,per
essere decarbossilato
ad Acetil CoA ed entrare
nel ciclo di krebs
Destino aerobico del Piruvato
L’acido piruvico o il lattato vengono completamente
ossidati a CO2 attraverso il ciclo dell’acido citrico (TCA
cycle), con conseguente rilascio di energia sotto forma
di ATP e di trasportatori di elettroni ridotti,
principalmente NADH
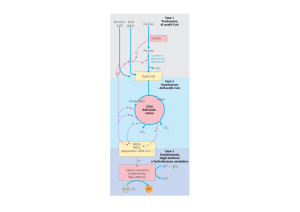
È utile pensare all’ossidazione metabolica dei
substrati come a un processo a 3 stadi:
• il carbonio è incorporato nell’acetil-CoA
• il carbonio viene quindi ossidato a CO2,
trasportatori ridotti di elettroni e una piccola
quantità di ATP
• i trasportatori ridotti di elettroni sono riossidati
fornendo energia per la sintesi di ulteriore ATP
(fosforilazione ossidativa)
L’attività del ciclo TCA è favorita da bassi rapporti
NADH/NAD+
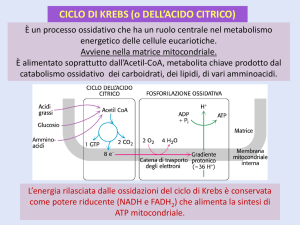
Il ciclo degli acidi tricarbossilici e’ la via finale comune per l’ossidazione delle
molecole combustibili
(glucosio, amminoacidi, acidi grassi).
Il ciclo dell’acido citrico include una serie di ossidoriduzioni che portano all’ossidazione di un gruppo acetile
a due molecole di CO2.
PIRUVATO
La funzione del ciclo di Krebs è quella di
immagazzinare elettroni ad alta energia
provenienti da combustibile organico.
CO2
Acetil CoA
Acetil CoA+ 3 NAD+ + FAD + GDP + Pi +2H2O
2CO2+ GTP + 3NADH +3H+ + CoA + FADH2
GTP
Ciclo di
Krebs
8 e-
CO2
Il Ciclo di Krebs avviene nella matrice mitocondriale
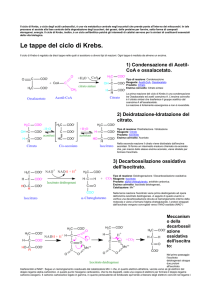
1° STEP: Formazione del citrato
Condensazione di una unità C4 (ossalacetato) con una unità C2
(gruppo acetile dell’acetil CoA)
enzima: citrato sintasi
L’equilibrio di questa reazione è tutto spostato verso la formazione dell’acido
citrico dalla elevata energia che si libera dal legame tioestereo dell’acetil-CoA.
Quando la carica energetica cellulare aumenta, il citrato tende ad accumularsi.
L'eccesso di citrato viene usato per trasportare all'esterno del mitocondrio
l'acetil-CoA.
CITRATO SINTASI
MECCANISMO D’AZIONE
Il meccanismo prevede un attacco nucleofilo
dell’enolato del tioestere al gruppo carbonilico
dell’ossalacetato con formazione di citrato
CITRATO SINTASI MECCANISMO D’AZIONE
Nel sito catalitico (due per enzima) è presente un residuo di
aspartato che, insieme ad un residuo di istidina, contribuisce a
mantenere in sede la molecola di acetil-CoA attraverso interazioni
ioniche.
Tali residui contribuiscono ad
attivare la molecola ad un
intermedio enolico,
rendendola affine per un
centro carbonioso
dell'ossalacetato
Idrolisi
leg.tioestere
La sua struttura
quaternaria consta di
due subunità, ad ognuna
delle quali si possono
legare i due substrati.
Il sito attivo dell'enzima attiva l'acetil-CoA per renderlo affine ad un centro
carbonioso dell'ossalacetato. In seguito al legame tra le due molecole, il
gruppo tioestere (CoA) viene idrolizzato, formando così la molecola di citrato.
La reazione è altamente esoergonica (ΔG'°=-30 kJ/mole), motivo per cui
questo step è irreversibile. Il citrato prodotto dall'enzima, inoltre, è in grado di
inibire competitivamente l'attività dell'enzima. Pur essendo la reazione molto
favorita (perché esoergonica), dunque, la citrato sintasi può essere
saldamente regolata. Questo aspetto ha una notevole importanza biologica,
dal momento che permette una completa regolazione dell'intero ciclo di
Krebs, rendendo l'enzima una sorta di pacemaker dell'intero ciclo.
La citrato sintetasi è sede di regolazione allosterica.
NADH
Succinil CoA
-
EFFETTORI
allosterici negativi
CITRATO
Il citrato può alimentare le successive tappe del ciclo di Krebs oppure uscire dal
mitocondrio nel citoplasma, dove in una reazione inversa a quella della
condensazione produce l’acetil-CoA necessario per la sintesi degli acidi grassi.
Il citrato può funzionare anche come:
TRASPORTATORE DELL’ACETILE attraverso la membrana mitocondriale;
EFFETTORE NEGATIVO della fosfofruttochinasi, inibendo la glicolisi;
EFFETTORE POSITIVO della Acetil-CoA carbossilasi stimolando la biosintesi degli
acidi grassi.
2° STEP: Isomerizzazione del citrato in isocitrato
Enzima: aconitasi
L'enzima catalizza anche la reazione inversa, ma nel ciclo di
Krebs tale reazione è unidirezionale a causa della legge di
azione di massa: le concentrazioni (in condizioni standard) di
citrato (91%), dell'intermedio cis-aconitato (3%) e di isocitrato
(6%), infatti, spingono la reazione decisamente verso la
produzione di isocitrato.
ACONITASI - Meccanismo di azione
E’ un'eliminazione di H20
favorita dalla formazione di
un acido α,β insaturo in
equilibrio con l’idratazione
ad acido isocitrico
3° STEP:Decarbossilazione ossidativa dell’isocitrato
Ossidazione
decarbossilazione
enzima: isocitrato deidrogenasi
Il processo consta di due fasi:la prima coinvolge l'ossidazione dell'isocitrato (un
alcool secondario) in ossalsuccinato (un chetone), seguita dalla decarbossilazione
del gruppo carbonile b nel chetone, formando a-chetoglutarato.
ISOCITRATO DEIDROGENASI
Un'altra isoforma dell'enzima catalizza la stessa reazione, non
nel ciclo di Krebs ma nel citosol e nei mitocondri, ed utilizza
come cofattore il NADP+ al posto del NAD
La struttura dell’enzima non è stata ancora ben definita. Attualmente si ipotizza che la
proteina sia composta da 3 subunità, sia allostericamente regolata, e che richieda come
sustrato ione Mg2+ o Mn2+. L'omologo più simile che abbia una struttura conosciuta è l'
E. coli NADP-dipendente Isocitrato deidrogenasi (IDH), che ha solamente 2 subunità e un
13% di identità e 29% di somiglianza basata sulle sequenze di amminoacidi, facendone un
lontano parente del IDH umano e non attendibile per una comparazione certa.
.
ISOCITRATO
DEIDROGENASI
(meccanismo di azione)
Lo step dell'IDH, a motivo del suo grande dispendio di energia liberata, è una
delle reazioni irreversibili nel ciclo di Krebs e per questo deve essere
accuratamente regolata per evitare un'inutile dispersione di isocitrato (e un
conseguente accumulo di α-chetoglutarato).
REGOLAZIONE ALLOSTERICA
isocitrato, NAD+, Mg2+ / Ca2+, ADP +
NADH e a-chetoglutarato, ATP
-
NADH e ATP
Forma attiva
NAD+ e ADP
Forma inattiva
4° STEP:Decarbossilazione ossidativa
dell’a-chetoglutarato
Enzima: a-chetoglutarato deidrogenasi
La decarbossilazione ossidativa dell’ a-chetoglutarato in succinil- CoA è identica alla
decarbossilazione del piruvato in Acetil-CoA come meccanismo.
Il complesso enzimatico a-chetoglutarato deidrogenasi è associato analogamente agli
stessi coenzimi: TPP, acido lipoico,FAD, NAD+ e CoA.
A differenza della piruvato DH non è regolata dal processo “fosforilazionedefosforilazione”.
La reazione è irreversibile. Formazione di una seconda molecola di CO2
Tale reazione (decarbossilazione ossidativa a succinil –CoA)
mostra la liberazione di una molecola di CO2, espressione della
completa degradazione ossidativa dell’acetile immesso nel ciclo.
L’a- chetoglutarato, non rappresenta solo un intermedio del ciclo
di Krebs ma è anche metabolita importante di confluenza del
METABOLISMO GLUCIDICO E DEGLI AMINOACIDI.
Può essere infatti trasformato in glutammato, così come il
glutammato può essere convertito in a- chetoglutarato dalle
transaminasi.
5° STEP:Trasformazione del Succinil-CoA in Succinato
fosforilazione a livello di substrato
Enzima: succinil-CoA sintetasi o succinato tiochinasi
L’energia del legame tioestereo che si viene a rompere è
trasferita nel legame pirofosforico del neoformato GTP.
Questa è l’unica reazione metabolica ove il GTP è preferito
all’ATP quale accettore primario di un gruppo fosforico ricco di
energia.
6° STEP:Ossidazione del succinato
succinato
deidrogenasi
La succinato deidrogenasi (o succinato-coenzima Q riduttasi) è un enzima
complesso che si trova nella matrice della membrana mitocondriale interna.
È un enzima chiave del ciclo di Krebs ed è l'unico di questo ciclo ad essere
legato ad una membrana, cio’ consente il trasferimento diretto degli
elettroni alla catena respiratoria, sita nella membrana.
SUCCINATO DEIDROGENASI
La succinato deidrogenasi è un eterotetramero diviso in 3 domini:
SdhA, il dominio catalitico;
SdhB, la subunità per il trasferimento di elettroni;
SdhCD, che contiene eme di tipo b, la cui funzione non è ancora chiara.
Il dominio SdhA contiene il cofattore FAD, legato covalentemente ad un residuo conservato di
istidina, che è il sito in cui dove il succinato viene ossidato in fumarato. Questo causa la
riduzione del FAD in FADH2.
La subunità per il trasferimento di elettroni (SdhB) contiene un cluster [2Fe-4S], uno [4Fe-4S]
ed uno [3Fe-4S], che favoriscono il passaggio di elettroni dall'SdhA al dominio di membrana.
Questi elettroni vengono indirizzati, per la riduzione di una molecola di ubiquinone su un sito
quinone-legante collocato nel dimero SdhCD.
La riduzione del quinone è un processo a due elettroni e richiede la formazione di un
intermedio, il radicale ubisemiquinone.
La risultante molecola di ubiquinolo viene rilasciata, libera di diffondersi attraverso la
membrana cellulare e di interagire con i successivi enzimi della respirazione cellulare
7°STEP: idratazione del fumarato
Il deficit di fumarasi, detto anche aciduria fumarica, è una malattia genetica rarissima,
autosomica recessiva dovuta a mutazioni inattivanti sul gene della fumarasi.
La malattia è estremamente rara: ne sono stati rilevati solo 33 casi nel mondo di cui
addirittura 20 negli ultimi anni in due comunità della Chiesa di Gesù Cristo dei Santi degli
Ultimi Giorni (nelle periferie di Colorado City e Hildale) il cui fondatore comune, Joseph
Smith Jesop, o sua moglie, erano portatori sani del gene mutato. A causa del carattere chiuso
di tali comunità e delle pratiche di poligamia e matrimoni tra consanguinei, si è verificata
un'anormale moltiplicazione della sequenza genica difettata e quindi un aumento innaturale
della frequenza dell'omozigosi, ovvero della malattia.
Malattie legate alla succinato deidrogenasi
Le malattie legate alla funzionalità della succinato
deidrogenasi includono il paraganglioma ereditario,
disordini ossessivo-compulsivi, emissioni di flatulenze
aromatiche e nanismo.
La rimozione di questo enzima dal genoma degli embrioni
si è dimostrata letale.
8°STEP:Ossidazione del malato
Ciclo di
krebs
RESA NETTA IN ATP DAL METABOLISMO AEROBIO DEL GLUCOSIO
6
6
18
4
24 ATP
Il ciclo di Krebs è sia un
processo catabolico che anabolico
Alcune vie biosintetiche
utilizzano intermedi del ciclo
Gli intermedi sottratti
devono essere rimpiazzati
REGOLAZIONE DEL CICLO DI KREBS
Le tre reazioni chiave del ciclo sono quelle fortemente esoergoniche
ENZIMA
DG°'
DG
(kJ/mol) (kJ/mol)
CITRATO SINTASI
- 31,5
negativo
ACONITASI
circa 5
circa 0
ISOCITRATO DEIDROGENASI
- 21
negativo
a-CHETOGLUTARATO
DEIDROGENASI
- 33
negativo
SUCCINIL - CoA SINTETASI
- 2,1
circa 0
SUCCINATO DEIDROGENASI
+6
circa 0
FUMARASI
-3,4
circa 0
+ 29,7
circa 0
MALATO DEIDROGENASI
Questo schema del
ciclo dell’acido citrico
indica i punti di
inibizione
(indicati
con il circolo con il
segno-)
e
gli
intermedi della via
che agiscono da
inibitori (linee rosse).
Ca++ e ADP sono
invece attivatori
La citrato sintasi è inibita da citrato, NADH e succinil-CoA
L'isocitrato deidrogenasi è inibita da NADH e ATP
a-chetoglutarato deidrogenasi è inibita da NADH e succinilCoA
Calcio ed ADP attivano l'isocitrato deidrogenasi
Calcio
attiva
deidrogenasi
sia
la
PDH
che
l'a-chetoglutarato
REGOLAZIONE DEL CICLO DI KREBS
Citrato sintetasi
- Citrato, succinil CoA, ATP,NADH
INIBIZIONE
Isocitrato deidrogenasi
- ATP, NADH
- ADP, NAD+ Ca++
INIBIZIONE
ATTIVAZIONE
a- chetoglutarato
- NADH, Succinil CoA
- Ca++
INIBIZIONE
ATTIVAZIONE
REAZIONI ANAPLEROTICHE : Reazioni che
apportano metaboliti essenziali al ciclo.
1. Alcuni aminoacidi------> alfa-Chetoglutarato.
2. Acidi grassi a catena dispari ------> SuccinilCoA
3. Isoleucina,Metionina,Valina ------> SuccinilCoA
4. Tirosina, Fenilalanina, Aspartato ------>
Fumarato
5. Alcuni aminoacidi ------> Ossaloacetato
6. Piruvato ------> Ossaloacetato
in celeste
a.a. corpi chetonici
in giallo
a.a glucosio
in rosa
a.a. glucosio e corpi chetonici
arginina, glutammina,
istidina, prolina
glicina, alanina,
serina,
cisteina,triptofano
isoleucina
glutammato
piruvato
propionil~CoA
isocitrato
triptofano
leucina
acetil-CoA
isoleucina
citrato
acetoacetil-CoA
ossalacetato
leucina
lisina
fenilalanina
tirosina
malato
aspartato, asparagina
a-chetoglutato
biotina
B12
succinil~CoA
succinato
fumarato
fenilalaninatir
osina
valina
metionina
treonina