Tumori Stromali Gastrointestinali
GIST: comprendere il referto del patologo
Copyright © 2010 by GIST Support International.
Traduzione italiana e adattamento a cura di A.I.G. Associazione Italiana GIST, su consenso di GSI.
Co-autori dell’opuscolo sono due esperti anatomo-patologi:
il Dott. Jason L.Homich MD, PhD dell’ Harvard Medical School Brigham and Women’s Hospital,
Boston, USA, ed il Dott. Alex Lazar MD, PhD del MD Anderson Cancer Center, Houston,USA
A cura di Julia Royster Doswell, PhD Coordinatore scientifico di GSI Gist Support International
www.gistsupport.org
Come usare questo opuscolo
Dopo l’intervento chirurgico puoi discutere del tuo GIST col chirurgo e con
l’oncologo, tenendo presente le informazioni contenute in questo opuscolo.
Chiedi una copia della cartella clinica che riporta i dati dell’intervento ed il referto
del patologo. Inoltre chiedi al tuo medico di spiegarti le caratteristiche del tuo tumore,
la sua prognosi e le opzioni di trattamento.
Domande da fare al medico
1.
2.
3.
4.
5.
Dove era localizzato il mio tumore?
Quanto era grande?
Sono state rimosse alcune parti del mio apparato digerente insieme al tumore?
C’era solo un unico tumore primario o c’erano anche metastasi?
I margini della chirurgia erano “puliti” (R0 o margini negativi, senza cellule
tumorali)?
6. Qual era l’indice mitotico (indicazione della capacità di crescita della cellula
tumorale)?
7. Qual è il rischio di recidiva o di metastasi per il mio tumore? Mi indichi in
quali gruppi di rischio, contenuti in questo opuscolo, ricade il mio tumore.
8. Dovrei considerare di sottopormi a terapia farmacologica dopo l’intervento?
9. Qual'è lo stato mutazionale del tumore? Qual'è la mia mutazione?
10.Qual è il piano più adeguato per il follow-up ed il monitoraggio del
trattamento?
11.Devo cambiare dieta per avere una buona alimentazione, considerando le
modificazioni provocate dall’intervento chirurgico al mio apparato
gastrointestinale?
Perché il referto del patologo è così importante per me?
Il referto del patologo fornisce la diagnosi del tumore che ti è stato rimosso
chirurgicamente o sul quale è stata eseguita la biopsia: tumore stromale
gastrointestinale (GIST). Le caratteristiche specifiche del tumore descritte nel referto
aiutano a decidere i trattamenti più appropriati nel tuo caso. Il tuo oncologo userà il
referto del patologo per programmare il trattamento. E’ opportuno che tu discuta il
referto con l’oncologo, per comprendere meglio la tua malattia e le scelte
terapeutiche.
Diagnosi di GIST
Chi è il patologo (o anatomo-patologo)?
L'anatomo-patologo è un medico che fa diagnosi di malattie esaminando i tessuti, le
cellule e i fluidi corporei. Nel caso dei GIST, il patologo esamina i tessuti prelevati
mediante biopsia o asportati nel corso dell’intervento chirurgico. Anche se il chirurgo
ha il sospetto che si tratti di GIST, in base alle immagini radiologiche preoperatorie e
all’aspetto del tumore osservato durante l’intervento, solo il patologo può stabilire se
il tumore è veramente un GIST. Dopo aver esaminato e analizzato i tessuti tumorali in
laboratorio, il patologo ne descrive le caratteristiche, in base alle quali si può
prevedere quante probabilità ci siano che il GIST si ripresenti, o metastatizzi al fegato
o nella cavità addominale, o più raramente in altre parti del corpo.
Raramente i pazienti incontrano i patologi, ma questi medici sono fondamentali per il
trattamento, perché essi:
analizzano le biopsie prima dell’intervento per fare una diagnosi.
diagnosticano il GIST distinguendolo da altri tipi di tumore per stabilire
l’approccio terapeutico.
valutano l’adeguatezza dei margini dopo l’operazione.
determinano la categoria di rischio (probabilità di recidiva) per i tumori
primari.
confermano eventuali metastasi già presenti al momento della diagnosi.
forniscono i dati per decidere se dovrà essere utilizzata la terapia farmacologica
con imatinib, dopo resezione chirurgica completa del tumore primario.
Che cos’è un GIST?
Il tumore stromale gastrointestinale (GIST) è un tumore raro che di solito colpisce
l’apparato digerente o occasionalmente le strutture vicine, all’interno dell’addome.
Il GIST è un tipo di sarcoma. I sarcomi sono tumori che si sviluppano nei tessuti che
connettono, fanno da supporto o circondano altre strutture e organi del corpo. Le
cellule del sarcoma rappresentano la trasformazione neoplastica delle cellule normali
contenute dentro il tessuto connettivo o il tessuto di supporto come il tessuto osseo, la
cartilagine, i tendini, i nervi, il grasso, i muscoli, o i vasi sanguigni. (A differenza dei
sarcomi, la maggior parte delle neoplasie addominali sono carcinomi, che derivano
dal rivestimento di organi, e le loro cellule si avvicinano maggiormente a tessuto
epiteliale o ghiandolare.) I GIST per lo più si sviluppano nella parete dello stomaco o
del piccolo intestino: le cellule GIST hanno caratteristiche simili alla normali cellule
interstiziali di Cajal che sono coinvolte nel mantenimento della fisiologica funzione
intestinale (peristalsi).
Meno dell’1% dei GIST inizialmente si presenta esternamente agli organi, come
mostrato nella Figura 1.
Figura 1. Localizzazione del GIST negli organi dell’apparato gastrointestinale.
Molto raramente un GIST si sviluppa dalle membrane presenti all’interno
dell’addome (come l’omento e il mesentere) piuttosto che essere direttamente
attaccato all’apparato digerente. Il GIST metastatizza (cioè si diffonde) più
frequentemente al fegato o alle membrane addominali (peritoneo, omento, e
mesentere).
Di solito un GIST viene diagnosticato in base alla osservazione delle caratteristiche
delle cellule tumorali, unitamente agli esami di laboratorio per confermare la
presenza della proteina KIT (chiamata anche CD117) nelle cellule tumorali. La
proteina KIT viene rilevata da esami immuno-istochimici (una particolare
metodologia di laboratorio per rilevare le proteine nelle cellule). Inoltre, anche
l'assenza di altre proteine, che sono raramente espresse da GIST, può essere uno
strumento diagnostico utile.
Anche se pochi altri tumori addominali possono risultare positivi a KIT, il patologo
può utilizzare i risultati di un insieme di indagini di laboratorio per distinguere tra un
GIST e altre possibili diagnosi.
Infine, alcuni GIST risultanto negativi per la proteina KIT (circa il 5%): in questo
caso, possono essere identificati da un esperto patologo mediante test aggiuntivi.
.
Che cosa è la proteina KIT (CD117)?
La proteina KIT (o CD117 ) è un recettore posto sulla superficie della cellula per un
fattore di crescita chiamato ‘stem cell factor’(fattore delle cellule staminali)
Normalmente, KIT innesca la divisione cellulare, la differenziazione cellulare, o altre
funzioni cellulari solo quando KIT è stimolato dal fattore delle cellule staminali.
Nell’apparato gastrointestinale, il recettore KIT è presente sulle cellule chiamate
cellule interstiziali di Cajal, o ICC. Queste cellule particolari controllano la peristalsi
intestinale, cioè quei movimenti dell’apparato gastrointestinale che spingono il cibo
man mano che avviene la digestione. Poiché le cellule GIST mostrano lo stesso tipo
di differenziazione delle ICC (o possono essere derivate dalle cellule staminali che
producono le ICC), le cellule tumorali risultano positive a KIT in quasi tutti i GIST.
Le ICC si trovano tra gli strati della parete muscolare del tratto gastrointestinale,
come mostrato nella Figura 2. Questa rappresenterebbe la parete di ogni organo
digerente, tranne l’esofago, che manca del più esterno rivestimento sieroso. I tumori
più comuni (carcinomi) partono dall'interno del rivestimento (la mucosa) del tratto
gastrointestinale e spesso inizialmente crescono all’interno degli organi dell’apparato
digerente.
In un primo momento il GIST si sviluppa all’interno della parete (localizzazione
intramurale), ma man mano che cresce, di solito si estende verso l'esterno nella cavità
addominale. Occasionalmente un GIST può crescere all’interno della cavità del tratto
digerente (chiamato il suo lumen).
Spesso i GIST ulcerano il rivestimento a livello del loro punto di origine e causano
sanguinamento nel tratto gastrointestinale. Questa perdita di sangue e la conseguente
anemia possono essere i sintomi che portano il GIST alla attenzione del paziente e del
medico.
Figura 2. Sezione che mostra gli strati del tratto gastrointestinale. La ICC sono le cellule a forma di
stella, in blu, tra gli strati muscolari longitudinali e circolari.
I campioni di tessuto per l’esame istologico
Le mutazioni di KIT sono causa dell’insorgenza dei GIST?
Si, in circa l’80% dei GIST, la proteina KIT, che è attivata in maniera anormale
a causa di una mutazione nel gene KIT, provoca la divisione incontrollata delle
cellule e il tumore cresce. KIT è una proteina transmembrana: localizzata a cavallo
della membrana cellulare con una parte che si estende al di fuori della cellula (il
dominio extracellulare) e una parte che si estende verso l'interno della cellula (il
dominio intracellulare o citoplasmatico). Il fattore di crescita chiamato ‘ stem cell
factor’ (SCF, noto anche come ligando di KIT) lega due recettori
contemporaneamente e provoca l'attivazione dei recettori KIT appaiati. Quando il
fattore di crescita blocca la posizione delle due porzioni extracellulari del recettore,
essi cambiano l'orientamento delle porzioni interne alla membrana cellulare che si
avvicinano l’una all’altra. Questo permette ad ogni membro della coppia di attivare
l'altro in una concatenazione d’eventi nella cellula, come illustrato nel grafico a
sinistra della Figura 3. (Il processo di attivazione è chiamato "fosforilazione", perché
chimicamente ciò comporta il trasferimento di un gruppo fosfato).
Figura 3. Due recettori KIT normalmente formano una coppia quando sono stimolati dal ligando
‘stem cell factor’ (SCF) per avviare l’invio di segnali a valle (sequenza a sinistra). Le mutazioni
causano una anomala attivazione costitutiva del recettore KIT senza stimolazione del ligando SCF
(sequenza a destra).
Quando il KIT è attivato, inizia a mandare una serie di segnali al nucleo della cellula,
innescando la riproduzione cellulare mediante la divisione della cellula (chiamata
mitosi). Nelle normali ICC, KIT innesca la divisione cellulare solo quando una
cellula deve essere sostituita perché è vecchia o per lesioni. Al contrario, nella
maggior parte dei GIST, una mutazione nel gene KIT fa si che il recettore KIT invii
in maniera anormale continui segnali per la crescita cellulare continua, come
mostrato a destra nella figura 3.
La crescita incontrollata causa la formazione del GIST. Circa l’80% dei GIST sono
causati da un gene KIT mutato e dalla proteina KIT malformata che ne deriva, la
quale innesca una divisione cellulare anormale e la crescita tumorale.
Altre anomalie delle cellule GIST, che si verificano in seguito nello sviluppo dei
tumori, hanno un ruolo nel determinare quanto un tumore possa divenire aggressivo,
ma la attivazione di KIT anomalo è la causa primaria nella maggior parte dei GIST.
Farmaci quali imatinib e sunitinib spengono l’invio anormale di segnali, legandosi
alla porzione intracellulare del recettore KIT per evitare l'attivazione.
Tutti i GIST sono generati dalle mutazioni nel gene KIT?
No, ci sono altri due tipi di GIST:
GIST con mutazione di PDGFRA: Circa il 5% -10% dei GIST hanno geni KIT
normali, ma sono causati da una mutazione attivante nel gene per un recettore del
fattore di crescita diverso chiamato PDGFRA (recettore alfa del fattore di crescita
derivato dalle piastrine)
Normalmente, queste coppie di recettore PDGFRA si uniscono e mandano il segnale
al nucleo della cellula proprio allo stesso modo indicato in precedenza per KIT, salvo
che il fattore di crescita che li stimola è il fattore di crescita derivato dalle piastrine
(PDGF). Se il gene PDGFRA è mutato, la proteina PDGFRA può dare segnali per la
crescita cellulare continua, senza essere stimolata da PDGF, provocando la crescita
del GIST.
GIST Wild-Type: I tumori che non hanno mutazioni attivanti nei geni KIT o
PDGFRA sono chiamati GIST Wild-Type. Il meccanismo che fa scattare la loro
crescita non è stato ancora identificato. Questi GIST wild-type sono circa il 10% 15% dei GIST, compresa la maggior parte dei GIST diagnosticati in pazienti al di
sotto dei 30 anni. Man mano che la ricerca va avanti, questo gruppo sarà
probabilmente suddiviso in più sottogruppi con anomalie genetiche che non sono
state ancora identificate.
Un piccolo numero di questi casi sono già identificati per avere mutazioni
nell’oncogene BRAF.
Analisi che esegue l'anatomopatologo per diagnosticare un GIST
Tutti i GIST risultano positivi per la proteina KIT?
Circa il 95% dei GIST sono positivi per la presenza della proteina KIT all’analisi
immunoistochimica (una tecnica speciale di laboratorio per rilevare le proteine nelle
cellule). Quasi tutti i GIST causati dal gene KIT mutato e quasi tutti i GIST WildType risultano positivi per KIT. Alcuni GIST causati da un gene PDGFRA mutato
risultano negativi o debolmente negativi per la proteina KIT quando il patologo
colora le cellule. Al momento non è facile analizzare direttamente la colorazione
PDGFRA, perché i reagenti disponibili in commercio non sono ancora
sufficientemente attendibili per uso diffuso. Pochi laboratori di patologia specializzati
possono eseguire le analisi immunoistochimiche di PDGFRA. In alternativa, l’analisi
mutazionale del gene PDGFRA può essere utile per la diagnosi di GIST KIT-negativi.
L'esame delle mutazioni (detto anche test mutazionale o genotipizzazione) non è
sempre parte di un referto patologico (o di un esame istologico), ma può essere
effettuato in tempi diversi.
Se il patologo sospetta che un tumore sia un GIST, ma i risultati del test sono KIT
negativi o poco chiari, allora test alternativi possono aiutare ad identificare il tipo di
tumore. Ad esempio, marcatori più nuovi delle proteine come DOG1 (acronimo che
significa “ scoperta su GIST 1”) possono essere utili per la diagnosi di GIST che
mancano dell’espressione della proteina KIT.
E’ sempre affidabile l’esame di KIT?
La validità dell’analisi immunoistochimica per l’espressione di KIT dipende dalla
metodologia usata dall'anatomo-patologo e dalla sua esperienza, per evitare “falsi
positivi”. I materiali per le analisi disponibili in commercio sono ora più affidabili di
quanto lo fossero nel 2000- 2002, quando i falsi positivi ricorrevano più
frequentemente. Se c’è un dubbio, un campione di tumore può essere inviato per una
seconda opinione ad un patologo
con maggiore competenza sui sarcomi.
L’analisi mutazionale è necessaria per la diagnosi e la prognosi del
GIST?
No, l’analisi mutazionale (chiamata anche genotipizzazione) non è strettamente
necessaria per avere la diagnosi dei GIST KIT- positivi, e non fa parte di un classico
referto istologico di GIST. Le mutazioni nei GIST non hanno valore prognostico, ma
hanno certamente un valore predittivo, determinano e influenzano le scelte sul
trattamento farmacologico sia nella terapia del Gist inoperabile o metastatico, sia
nell'uso adiuvante. Si vedano anche le domande 8-10 più avanti in questo opuscolo.
La genotipizzazione (o analisi mutazionale) è fatta solo in un numero limitato di
laboratori; di conseguenza i campioni devono essere spediti ad altri laboratori per far
eseguire l’analisi mutazionale, a meno che non si sia in cura presso uno dei centri
specializzati capaci di eseguire questa analisi.
Indipendentemente dal fatto che la genotipizzazione sia fatta a livello locale o
da un laboratorio esterno, il risultato sarà segnalato separatamente, sia come
addendum al referto o come un referto del tutto separato.
Alcune volte la diagnosi di GIST è fatta mediante i campioni di tessuto ottenuti con la
biopsia prima dell’intervento chirurgico. Una biopsia è eseguita solo quando la
conoscenza della diagnosi modificherà il trattamento successivo. Per esempio, se un
tumore di piccole dimensioni può essere di un tipo che non avrebbe richiesto la
rimozione chirurgica, allora i risultati della biopsia potrebbero consentire di evitare
un intervento chirurgico non necessario. Per i tumori di grandi dimensioni, se il
trattamento preoperatorio con Imatinib può ridurre il tumore e ridurre la portata dell’
intervento chirurgico, o se la riduzione della dimensione del tumore potrebbe far sì
che sia resecato un tumore che al momento appare inoperabile, allora la biopsia è
sicuramente necessaria per diagnosticare il GIST prima che sia somministrato
Imatinib. Al contrario, se l’esito della biopsia prima dell’intervento non comportasse
il cambiamento dei piani del chirurgo per rimuovere il tumore, allora la diagnosi può
essere rinviata a dopo l’operazione. Ad esempio, questo potrebbe accadere quando un
tumore è grande abbastanza per richiedere la rimozione indipendentemente dal fatto
di sapere di che tipo si tratti, e il trattamento preoperatorio con Imatinib non è
necessario per migliorare la resecabilità. Tutti i tessuti rimossi durante l’operazione
sono detti ‘pezzo operatorio’ L'intero pezzo operatorio viene inviato all’anatomo
patologo che seleziona le aree da cui ottenere i campioni per l’osservazione al
microscopio.
Come sono preparati i campioni per l’analisi che effettuerà il
patologo?
Quando un campione bioptico o un pezzo operatorio arriva al laboratorio di
patologia, il patologo effettua una sequenza di passaggi. Nel caso di una
biopsia, l'intero campione è usato per l'analisi. Nel caso di un campione da resezione
chirurgica il campionamento avviene in modo che parti rappresentative del tumore
possano essere analizzate. Le porzioni di tessuto vengono tagliate sottili, poi fissate in
formalina, che rende il tessuto più stabile. I campioni vengono trattati con il calore, la
pressione e con solventi per rimuovere i lipidi e per includerli in paraffina. Poi i
campioni, incorporati in grandi blocchi di cera, saranno tagliati a fettine molto sottili
di tessuto e poste su vetrini. Questi vetrini sono poi deparaffinati così che i tessuti
possono essere colorati con coloranti acquosi ed altri reagenti. Le colorazioni iniziali
sono con Ematossilina ed Eosina che colorano di blu i nuclei della cellula (che
contiene il DNA) e di rosa il citoplasma e molte altre strutture, com’è mostrato in
questo campione.
.
Le colorazioni EE permettono la visualizzazione della forma delle cellule e
l'architettura del tessuto, che aiutano il patologo a fare una diagnosi. Queste
colorazioni consentono anche al patologo di determinare la conta mitotica, che
indica quanto velocemente il tumore stia crescendo.
Nel caso di sospetto GIST, il patologo esegue l’analisi immunoistochimica per
cercare l'espressione di KIT ed altri marcatori di proteine per confermare la diagnosi.
Se sono necessarie altre analisi, altri preparati microscopici possono essere preparati
per tale scopo. Dopo la diagnosi finale, i vetrini e i blocchetti di paraffina vengono
accuratamente conservati per future esigenze del paziente o per la ricerca.
Quali sono i tempi necessari perché il referto del patologo sia
disponibile?
Il trattamento dei campioni può richiedere una settimana o piu'. Il patologo quindi
invia una relazione al medico curante del paziente, di solito un chirurgo e/o un
oncologo medico. Potrebbe essere necessario discutere il caso con altri colleghi per
dare un’interpretazione completa.
A volte può essere necessario inviare i materiali ad un laboratorio esterno per ulteriori
analisi o per un secondo parere da parte di un patologo esperto, e questo prolungherà
il tempo necessario per avere una diagnosi definitiva. L’analisi mutazionale del gene
KIT o PDGFRA spesso richiede due o più settimane dopo la diagnosi iniziale.
Anche se il livello di dettaglio dipende dal fatto che il campione sia un piccolo
prelievo bioptico o un intero tumore asportato chirurgicamente, il patologo
generalmente segue lo stesso protocollo di base:
Descrivere il tipo di campione e il suo aspetto alla vista, ad occhio nudo
(Chiamata descrizione macroscopica o descrizione “de visu”).
Descrivere le caratteristiche del tessuto visto al microscopio (Chiamata
descrizione microscopica)
Eseguire i test immunoistochimici che rilevano la presenza o l’assenza di
determinate proteine in grado di identificare il tipo di cellule che compongono
il tumore.
Descrizione macroscopica
Nella sezione della descrizione macroscopica del referto, il patologo
registrerà le caratteristiche visibili, quali:
L’estensione del campione, compresi gli eventuali organi rimossi con il tumore.
L’origine del tumore (il punto lungo il tratto gastro-intestinale dove il tumore
ha avuto origine).
La dimensione del tumore misurata in centimetri.
L’invasione o l’aderenza ad altri organi (se presente).
Aree di necrosi (morte del tessuto), o degenerazione cistica.
I chirurghi cercano di rimuovere un margine di tessuto “sano” intorno al punto di
origine dei GIST, per ridurre al minimo le possibilità che rimangano cellule che
potrebbero crescere più tardi, causando recidiva locale. Inoltre, il chirurgo può
rimuovere le sezioni di strutture adiacenti al GIST se il tumore era aderente
ad esse; in questo caso un margine di tessuto normale andrà ricercato anche sulla
parte resecata della struttura adiacente al GIST. Le distanze dei margini sono misurate
nel campione osservato macroscopicamente e poi tutti i margini sono esaminati al
microscopio con particolare attenzione ai margini più vicini al tumore. Di solito le
valutazioni macro e microscopiche sono simili, ma a volte l’esame microscopico
rivela qualcosa che non è stato visto ad occhio nudo, e in questo caso, il margine
microscopico è la valutazione che è tenuta presente nella relazione finale.
I margini sono descritti come segue:
resezione R0 indica la completa rimozione di tutto il tumore con margini
microscopici negativi che non mostrano alcuna evidenza di cellule tumorali (margini
“puliti" ).
resezione R1 indica che i margini delle parti asportate mostrano la presenza di cellule
tumorali, se visti al microscopio (margini microscopicamente positivi)
resezione R2 indica che il tumore non è stato asportato completamente e non è stato
possibile rimuovere porzioni di tumore visibile ad occhio nudo (margini
macroscopicamente positivi).
Descrizione microscopica: Morfologia e Istologia
Tabella 1: Diagnosi di tumori addominali differenziali con i GIST e analisi
immunoistochimiche correlate
La morfologia si riferisce alle caratteristiche delle singole cellule, e l'istologia
rimanda alla descrizione della struttura microscopica dei tessuti. Per quanto riguarda
la struttura del tessuto si potrebbe pensare a qualcosa di simile alle venature del
legno. Il patologo farà una relazione sull'organizzazione generale delle cellule
tumorali così come osservate sui vetrini preparati, come pure sulle caratteristiche di
singole cellule. Per queste osservazioni, il patologo di solito utilizza vetrini EE
(vetrini colorati con ematossilina e eosina). L’ematossilina colora di blu i nuclei delle
cellule, e l’eosina colora di rosa le altre parti della cellula. L’uso di EE è lo standard
per vedere meglio le cellule.
Tipi di cellule nei GIST: Il patologo descriverà la forma delle cellule GIST come
cellule fusate, epitelioidi, o miste. Complessivamente, circa il 70% dei GIST è
composto da cellule fusate (cellule lunghe e affusolate per forma, a volte chiamate
fusiformi), mentre il 20% è composto di cellule epitelioidi (rotondeggianti o
poligonali), e il 10% contiene un insieme di entrambi i tipi. La distribuzione della
forma delle cellule varia tra i GIST a seconda della localizzazione nei differenti
organi dell’apparato digerente. Quasi tutti i GIST intestinali sono a cellule fusate, ma
il 40% dei GIST gastrici (che originano dallo stomaco) presentano cellule epitelioidi
o miste. I GIST epitelioidi hanno maggiori probabilità di avere mutazione PDGFRA o
wild type che non i GIST a cellule fusate. Tipi di cellule GIST fusate ed epitelioidi
sono mostrati nella Figura 4.
Caratteristiche delle cellule: Il patologo può notare diverse altre caratteristiche
che non sono tipiche delle cellule normali. In generale, nella determinazione del
grado di differenziazione istologica dei sarcomi (grading) quanto più le cellule
tumorali appaiano simili alle cellule normali, tanto più favorevole può essere l’esito.
Tuttavia, nei GIST questo rapporto non resta chiaramente valido.
Atipia nucleare: aspetto anomalo del nucleo di una cellula.
Pleiomorfismo: variazione estrema nella forma della cellula e nelle dimensioni
(compresi i nuclei).
Cellule GIST fusate Cellule GIST epitelioidi
Figura 4. Campioni di GIST colorati con EE, con ingrandimento a 100X
Caratteristiche della struttura del tessuto: Il referto può menzionare modelli
presenti nella struttura del tessuto (vortici, fascicoli, palizzate, fogli, nidi, ecc), ma
questo è poco significativo in termini di prognosi.
Penetrazione della membrana sierosa: Se il tumore è molto piccolo ed è
ancora contenuto all'interno della parete del tratto GI, si chiama "intramurale." Di
solito un tumore di dimensioni più grandi crescerà verso l'esterno, attraverso la parete
dell’organo digerente dove ha avuto origine, penetrando la membrana sierosa che
copre la parete muscolare. La penetrazione della membrana sierosa può essere
associata con un maggiore rischio di metastasi dentro la cavità addominale, ma questa
non è una delle caratteristiche fondamentali per la prognosi.
Vascolarizzazione del tumore: Il patologo può notare quanto il tumore sia
irrorato dai vasi sanguigni. I tumori non possono crescere molto senza lo sviluppo di
nuovi vasi per l’apporto di sangue.
Conta mitotica o tasso mitotico.
La Figura 5 illustra le fasi del ciclo di divisione cellulare. La mitosi è il passo finale,
quando la cellula si divide in due. Mitosi significa divisione cellulare, il processo
per il quale le cellule proliferano o si riproducono. I tumori crescono perché le cellule
del tumore si dividono con frequenza. Quanto più spesso ogni cellula si divide, tanto
più velocemente il tumore cresce. La conta mitotica è una delle parti più importanti
del referto di patologia, perchè questo indicatore di proliferazione aiuta a predire la
probabilità che la chirurgia sia curativa contro la probabilità che il GIST possa
ripresentarsi. Il ciclo cellulare consiste di due fasi di crescita, G1 e G2 che separano
le fasi sintetica (Replicazione del DNA) e mitotica (divisione cellulare). Dopo la
mitosi, le cellule possono entrare nella fase di risposo G0 per un periodo variabile.
Sotto stimolazione di un recettore costitutivamente attivo, KIT o PDGFRA, il tempo
che le cellule GIST trascorrono nella fase G0 è ridotto notevolmente.
Prognosi di GIST:Rischio di recidiva o di comportamento aggressivo
Tabella 2 Rischio di aggressività nei GIST
Riprodotta da Fletcher et al, 2002, Human Pathology 33 (5): 459-465. Usata col
permesso di Elsevier
Figura 5 Il ciclo cellulare
La conta mitotica è una delle parti più importanti del referto del patologo
perché indica quanto velocemente il tuo GIST stava crescendo. Indici mitotici più alti
indicano una maggiore probabilità che il tumore recidivi in futuro, come è descritto
nel paragrafo relativo alla prognosi.
Il patologo può vedere quante cellule sono in mitosi, esaminando i vetrini del tumore
al microscopio. Per determinare l’indice mitotico, il patologo letteralmente conta, in
una specifica sezione del tumore, il numero di cellule che possono esser viste in fase
di mitosi (chiamate figure mitotiche). Nella Figura 6 è possibile vedere le figure
mitotiche che il patologo conta.
Figura 6 Cellule GIST a ingrandimento 400X con figure mitotiche cerchiate, che indicano ciò che
il patologo cerca per contare il tasso mitotico
Diverse parti del tumore possono crescere più attivamente di altre, per cui il patologo
dovrebbe valutare attentamente le diverse sezioni ed eseguire il conteggio sulla
sezione con il più alto tasso mitotico. Una volta che è stata individuata la sezione
dove più attiva è la crescita, il patologo esaminerà al microscopio 50 campi
consecutivamente ad elevato ingrandimento (50 HPF) per contare le mitosi.
Un campo è una misura standard di settore, e 50 HPF tradizionali equivalgono a 5
mm2 di tessuto. Se il patologo utilizza un microscopio con campi due volte più grandi
(detto Wide Field Optics), allora sono necessari solo 25 campi per contenere la stessa
area di tessuto. La conta sarà riportata come un rapporto ad es. 3/50 HPF (3 mitosi
Tabella 3. Classificazione di rischio dei GIST primari in base ad indice mitotico, dimensione e
localizzazione del tumore.
Adattato da Miettinen e Lasota, 2006,Seminars in Diagnostic Pathology 23(2): 70-83. Usata col
permesso di Elsevier.
per 50 HPF) o 15/50 HPF (15 mitosi per 50 HPF). Valori inferiori a 5/50 HPF sono
più favorevoli e valori oltre 20/50 HPF sono molto elevati.
Alcuni patologi usano anche un indicatore alternativo della divisione delle cellule
tumorali, chiamato Ki-67 o MIB-1 . Questa è una colorazione immunoistochimica
che identifica le cellule in ogni fase di non quiescenza del ciclo cellulare (tutte tranne
G0). Il risultato è dato come la percentuale di cellule che sono entrate nel ciclo
cellulare. Questo metodo e le conte mitotiche sono simili nel valutare la
proliferazione delle cellule, ma i valori ottenuti con i due metodi non si convertono
facilmente l’uno nell’altro e non sono stati condotti in pazienti con GIST studi
approfonditi volti a convalidare il valore prognostico dei livelli specifici della
reattività nucleare MIB-1.
Esami immunoistochimici
Per i test immunoistochimici si usano anticorpi per rilevare se sono presenti nelle
cellule proteine selezionate. Tutte le cellule hanno molte sub strutture composte da
proteine, ma cellule di differenti tipi (come le cellule muscolari rispetto alle cellule
nervose e alle cellule ossee) usano diverse proteine specifiche per le loro particolari
funzioni cellulari. Si possono preparare anticorpi che si legano alla proteina di
interesse in un campione di cellule tumorali. In questo contesto, la proteina che è
analizzata costituisce l’antigene. Il legame dell’ anticorpo all’antigene forma un
nuovo bersaglio molecolare che può essere colorato per mostrarne la presenza nelle
cellule. Passaggi multipli sono solitamente richiesti nella esecuzione delle analisi
immunoistochimiche, ma alla fine il patologo saprà se le cellule del tumore
esprimono le proteine per le quali erano state analizzate.
Risultati positivi per la immunoistochimica di KIT sono illustrate nella figura 7 con la
colorazione marrone.
Cellule GIST fusate KIT- Positive Cellule GIST epitelioidi KIT-positive
Figura 7 Campioni GIST visti ad ingrandimento 200X con colorazione marrone indicanti risultati
positivi per analisi immunoistochimica di KIT
Sebbene la colorazione della proteina KIT (CD117) è di solito diagnostica per GIST,
il patologo esegue spesso altre analisi per escludere altre possibili diagnosi. L'aspetto
istologico del tumore, insieme alla sua localizzazione, suggerisce al patologo alcuni
tipi di tumore in alternativa, ed egli seleziona un gruppo di test per fare la diagnosi
corretta. Un gruppo di analisi tipiche potrebbe includere le seguenti indagini
immunoistochimiche. Esse non hanno alcun significato prognostico per i GIST, ma
sono fatte per aiutare nella diagnosi differenziale.
CD34 è positivo in circa l’80% dei GIST gastrici ma solo nel 50% dei GIST
intestinali.
SMA o actina del muscolo liscio è positiva in circa il 30% dei GIST
S-100 è positiva in circa il 5% dei GIST
Desmina è positiva in circa il 2% dei GIST, più comunemente nei GIST che
sono negativi per KIT
Pan-citocheratina è positiva in<1% dei GIST
Le principali diagnosi differenziali per i tumori addominali sono elencate nella tabella
1, insieme con i test immunoistochimici che le suggeriscono
Forma cellulare
Tipo di tumore
Esempio
Caratteristiche
immunoistochimiche
Tumori dei muscoli
lisci
Leiomioma
Leiomiosarcoma
Actina del muscolo liscio +
desmina +
Cellule fusate
Schwannoma
Tumori neurali
Tumore maligno
della guaina del
nervo periferico
Polipo fibroide
infiammatorio
Proteina S-100 +
CD34 +
Tumori fibrosi
Tumore fibroso
solitario
Fibromatosi
desmoide
Actina del muscolo liscio +
Beta- catenina (nucleare) +
Carcinoma
Carcinoma a cellule
fusate
Pan-citokeratina +
Melanoma
Melanoma
Melan – A +
Cellule epitelioidi
HMB45 +
Proteina S-100 +
Tumore
perivasculare
PEComa tumore a
cellule epitelioidi
perivasculari
Astina del muscolo liscio +
HMB45 +
Carcinoma
Carcinoma a cellule
chiare
Pan-citocheratina +
Esami per GIST KIT-negativi. Circa il 5% dei GIST non risultano positivi per
KIT (CD117). Questo gruppo include alcuni (ma non tutti) i GIST con mutazioni nel
gene PDGFRA, cosi come alcuni GIST con mutazioni nel gene KIT, e alcuni GIST
con nessuna mutazione (GIST Wild Type). Le analisi immunoistochimiche che
talvolta possono aiutare ad identificare i tumori KIT- negativi come i GIST includono
le seguenti analisi:
• DOG1 – un marker che può risultare positivo in circa il 40% dei GIST KITnegativi.
• PDGFRA – il recettore del fattore di crescita positivo nei GIST con mutazioni
nel gene per PDGFRA, ma i test immunoistochimici disponibili non sono
ampiamente usati per problemi di attendibilità.
Diagnosi
Una volta che il patologo ha descritto tutte le analisi richieste per il caso, farà la
diagnosi di GIST e spesso fornirà una breve spiegazione per questa conclusione.
Alcuni dipartimenti di patologia usano il termine “sarcoma stromale
gastrointestinale” (invece di tumore stromale gastrointestinale).
Sono stati usati schemi differenti per valutare il rischio di recidiva, detto anche
potenzialità maligna, per i tumori stromali gastrointestinali (GIST). Il tuo
patologo può servirsi di una o più di queste classificazioni. Gli schemi
dell’NIH e del NCCN si applicano ai tumori primari che non hanno
avuto ancora metastasi, invece lo schema di AJCC si applica sia ai GIST
primari che metastatici. Si deve notare che poiché queste classificazioni
sono state sviluppate usando i dati per i GIST negli adulti, essi non
possono essere usati in modo appropriato per i GIST pediatrici, molto rari.
Schema del consenso di rischio dell’NIH per GIST.
Sviluppato ad una conferenza di consenso di esperti e pubblicata nel 2002, questo
schema divide i GIST in gruppi di rischio solamente in base alla dimensione del
tumore e alla conta mitotica. Venivano così definiti quattro gruppi di rischio come
mostrato nella Tabella 2. Questa tavola di rischio si basava sull’esperienza e
sull’opinione di esperti, poiché erano disponibili solo dati limitati.
Gruppo di rischio
Dimensione (la
dimensione più grande)
Conta mitotica
Rischio molto basso
< 2 cm
<5/ 50 HPF
Rischio basso
2 -5 cm
<5 / 50 HPF
Rischio intermedio
< 5 cm
6 -10 / 50 HPF
5-10 cm
<5 / 50 HPF
>5 cm
>5 / 50 HPF
Rischio alto
Ogni tasso mitotico
> 10 cm
Tabella 4. Definizioni di T, N, M, e Tasso Mitotico per i GIST in tutte le
localizzazioni originarie. Usata col permesso dell’American Joint Committee on
Cancer (Ajcc), Chicago, Illinois. La fonte originaria per questo materiale è l’AJCC
Cancer Staging Manual, Seventh Edition (2010 pubblicata da Sprinter Science e
Business Media LLC, www.springer.com
Classificazione di rischio dell’NCCN per i GIST
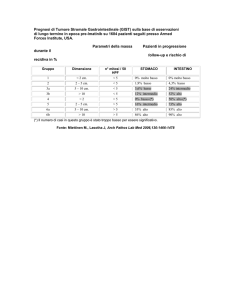
Una migliore classificazione di rischio per i GIST, elaborata dai patologi Miettinen e
Lasota basata su dati attuali, è stata adottata dal National Comprehensive Cancer
Network Task Force sui GIST. Questo approccio, come indicato nella Tabella 3,
valuta il rischio di recidiva in base alla dimensione, alla conta mitotita e alla
localizzazione del tumore originario. I GIST gastrici sembra che recidivino di meno
dei tumori della stessa dimensione e dello stesso tasso mitotico che originano in altre
sedi dell’apparato gastrointestinale.
Parametri
del tumore
Rischio di
progressione
di malattia ª
Indice
mitotico
dimensione
Stomaco
Duodeno
Digiuno o
Ileo
Retto
< 2 cm
nessuno
nessuno
Nessuno
Nessuno
> 2 < 5cm
Molto basso
(1.9%)
Basso
(8.3%)
Basso
(4-3%)
Basso
(8.5%)
Basso
(3.6%)
Dati
insufficienti
Moderato
(24%)
Dati
insufficienti
Moderato
(12%)
Alto
(34%)
Alto
(52%)
Alto
(57%)
< 5 per 50
HPF
>5 < 10 cm
>10 cm
Dati per GIST in base alla Alto
Tabella 5- Stadio anatomico/ Gruppo prognostico
< 2 cm
Nessuno b
insufficienti
Alto b
(54%)
localizzazione in origine.
Usata col permesso dell’American Joint Committee on Cancer /AJCC) Chicago IllinoisLa fonte originaria per questo materiale è l’AJCC Cancer Staging Manual, Seventh Edition (2010)
pubblicata da Sprinter Science and Business Media LLC, www.springer.com
> 5 per
50HPF
ª definita
come
sviluppo di
metastasi
b denota un
piccolo
numero di
casi-
> 2 < 5 cm
Moderato
(16%)
Alto
(50%)
Alto
(73%)
Alto
(52%)
> 5 < 10 cm
Alto
(55%)
Dati
insufficienti
Alto
(85%)
Dati
insufficienti
> 10 cm
Alto
(86%)
Alto
(86%)
Alto
(90&)
Alto
(71%)
Dati basati
su un
follow-up a
lungo
termine di
1055 GIST
gastrici, 629
del piccolo
intestino,
144 del
duodeno, e
111 del
retto.
Stadiazione del GIST secondo l’AJCC (American Joint Committee on
Cancer)
L’AJCC rappresenta lo sforzo congiunto di diverse organizzazioni professionali per
definire le classificazioni di diversi tipi di cancro allo scopo di avere una descrizione
del tumore e processi decisionali di trattamento standardizzati. L’AJCC dà questa
definizione di stadiazione del cancro: ”la stadiazione descrive l’estensione o la
severità della malattia di un individuo in base all’estensione del tumore primario ed
al grado di diffusione delle metastasi”.
Il manuale di stadiazione del cancro dell’JACC, 7a edizione ha introdotto i criteri di
stadiazione per i GIST per essere usati a partire dal gennaio 2010. In passato non ci
sono mai state stadiazioni dell’AJCC per il GIST, ma i referti del patologo sui tumori
e le biopsie dal 2010 in avanti possono servirsi di questo schema. Per una diagnosi
precedente al 2010, va riconsiderata la collocazione del tumore in base a questo
nuovo schema, nel quale, di fatto, ma non c’è nessuna nuova informazione – esso
impiega infatti i criteri Miettinen e Lasota /NCCN convertita nella classificazione
AJCC conosciuta come “TNM” (tumori, linfonodi e metastasi)
•
La categoria “T” indica la dimensione del tumore,
•
La categoria “N” indica la compromissione dei linfonodi che di solito è zero
perché la diffusione linfonodale è molto rara nei GIST (eccetto nei GIST
Pediatrici).
•
La categoria “M” indica se il GIST ha già dato metastasi.
Si veda la Tabella 4 che riporta le sigle di T, N, M, secondo l’AJCC e la conta
mitotica per GIST.
La conta mitotica è associata con l’informazione TNM per indicare lo stadio. Lo
schema finale è rappresentato nella Tabella 5. La stadiazione è differente per i
GIST gastrici e dell’omento rispetto agli altri GIST, indicando un più alto rischio
Referto del patologo per GIST
di recidiva per i GIST non gastrici.
I GIST di Stadio 1 sono tumori a basso rischio, che è poco probabile che
recidivino dopo la chirurgia; i GIST di Stadio 4 rappresentano malattia metastatica
che probabilmente trarrà beneficio dal trattamento con farmaci a bersaglio
molecolare quali Imatinib e Sunitinib. Gli stadi intermedi 2 e 3 corrispondono ad
un rischio moderato e ad un rischio alto di recidiva per i GIST. Raccomandazioni
di trattamento per questi stadi di tumore sono in evoluzione grazie alla ricerca
clinica; il trattamento può anche includere farmaci a bersaglio molecolare. La
genotipizzazione di KIT e PDGFRA può essere di aiuto nel decidere l’appropriato
approccio terapeutico e scegliere la migliore terapia farmacologica.
T del tumore primario
TX: Il tumore primario non può essere valutato
T0: nessuna evidenza di tumore primario
T1: tumore di 2 cm o meno
T2: tumore di più di 2 cm ma non più di 5
T 3: Tumore di più di 5 cm ma non più di 10 cm
T 4: tumori di più di 10 cm in dimensioni più grandi
Linfonodi regionali (N)
NX: non possono essere valutati linfonodi regionali
N0: nessuna metastasi nei linfonodi regionali
N1: metastasi nei linfonodi regionali
Metastasi distanti N
M0: nessuna metastasi distante
M1: metastasi distanti
Tasso mitotico
Tasso mitotico basso: 5 mitosi o meno per 50 HPF
Tasso mitotico alto: più di 5 mitosi per HPF
Tumore gastrico : biopsia
____________________________
TUMORE STROMALE GASTROINTESTINALE, a cellule fusate
Mitosi numero 3 per 50HPF
Nessuna necrosi identificata
La immunoistochimica mostra il seguente profilo di colorazione nelle cellule
tumorali:
Positivo – KIT, CD34
Negativo – desmina, proteina S-100
Questi risultati supportano la diagnosi sopra riportata.
Gruppo dei Gist
gastrici*
T
N
M
Tasso Mitotico
Stadio IA
T1 o T2
N0
M0
Basso
Stadio IB
T3
N0
M0
Basso
Stadio II
T1
T2
T4
N0
N0
N0
M0
M0
M0
Alto
Alto
Basso
Stadio IIIA
T3
N0
M0
Alto
Stadio IIIB
T4
N0
M0
Alto
Stadio IV
Qualsiasi T
qualsiasi T
N1
Qualsiasi N
M0
M1
Qualsiasi tasso
Qualsiasi tasso
Gruppo dei
GIST del
Piccolo
intestino **
T
N
M
Tasso mitotico
Stadio I
T1 o T2
N0
M0
Basso
Stadio II
T3
N0
M0
Basso
Stadio IIIA
T1
T4
N0
N0
M0
M0
Alto
Basso
Stadio IIIB
T2
T3
T4
N0
N0
N0
M0
M0
M0
Alto
Alto
Alto
Qualsiasi T
N1
M0
M1
Qualsiasi tasso
Qualsiasi tasso
Resezione dal piccolo
Qualsiasi Tintestino:
Qualsiasi N
SARCOMA STROMALE GASTROINTESTINALE, tipo di
cellule epitelioidi miste e fusate (dimensione massima 9 cm.),
ALTO RISCHIO (in base alle linee guida NCCN 2010)
Mitosi numero 8 per 50 HPF.
Nessuna necrosi individuata.
Il tumore coinvolge l'intero spessore della parete intestinale e
penetra la sierosa.
I margini di resezione prossimale e distale nel piccolo intestino
sono negativi per il tumore.
L’analisi immunoistochimica eseguita su sezioni di paraffina
rivela il seguente profilo di colorazione nelle cellule tumorali:
Positivo –KIT, DOG1
Negativo – SMA, desmina, proteina S – 100
Stadio IV
* Nota: può
essere usata
anche per
l’omento
**Nota: può
essere usata
anche per
esofago, colon
retto, mesentere,
e peritoneo
Campioni bioptici e referto
Una biopsia contiene solo una piccola quantità di tessuto. Talvolta il campione è
troppo piccolo perché il patologo possa descrivere la struttura del tessuto (come le
cellule sono organizzate), ma le singole cellule possono essere osservate.
A volte con l’agobiopsia si prelevano solo poche cellule tumorali utili per la diagnosi
assieme a sangue e liquido necrotico (cellule morte e residui).
Il patologo non tenterà di indicare la prognosi su un tale piccolo campione, ma lo
stesso sarà ben descritto e, se possibile, sarà fatta la diagnosi. Purtroppo, a volte la
biopsia fallisce nel prelevare cellule del tumore, ma preleva solo tessuti vicini al
tumore. In questo caso, la biopsia deve essere ripetuta.
Il patologo selezionerà le indagini più appropriate da utilizzare su un campione
bioptico di quantità limitata al fine di fare diagnosi, in quanto il tessuto prelevato può
non essere sufficiente per effettuare tutte le analisi desiderate. Questo elenco può
includere analisi immunoistochimica per KIT (CD117), CD34, actina del muscolo
liscio, proteina S-100, desmina, e pan-citocheratina.
Ecco un esempio di referto su un campione di biopsia.
Domande frequenti dei pazienti
Fegato, parziale epatectomia.
SARCOMA STROMALE GASTROINTESTINALE METASTATICO, tipo di cellule fusate
(dimensione massima 4.5 cm) con ialinizzazione estesa (>95%), compatibile con effetto di
trattamento.
Numero di mitosi meno dell’1 per 50HPFI margini della resezione chirurgica sono negativi per tumore.
Campioni da resezione chirurgica e referti sul GIST
La relazione del patologo fatta sul pezzo operatorio conterrà molte più informazioni,
perché il patologo ha tessuto tumorale in quantità adeguata per poter svolgere tutte le
indagini richieste dal caso.
Dopo aver descritto l’intero pezzo operatorio (tutto quello che è stato rimosso), il
patologo analizza le aree del tumore che mostrano aver subito una più rapida crescita.
Oltre al referto del patologo, si dovrebbe leggere la relazione dell’intervento fatta dal
chirurgo, per avere la descrizione della localizzazione del tumore e come esso è stato
rimosso (se è stato tolto via dagli organi adiacenti, rimosso con parti aderenti di
organi adiacenti “in blocco”ecc.).
Segue un esempio di referto di un tumore rimosso chirurgicamente.
Referti sui GIST trattati
Se il referto descrive un GIST primario o metastasi di GIST rimossi dopo trattamento
farmacologico, la relazione si differenzierà in molti modi da quella di pretrattamento.
La conta mitotica può essere elencata, ma non è paragonabile alla conta mitotica di
un tumore non trattato, in quanto il farmaco riduce di solito la proliferazione
cellulare.
La classificazione di rischio non è possibile (ed è irrilevante per i tumori metastatici
poiché il tumore si è già diffuso).
La Percentuale di cellule vitali è uno dei fatti più informativi su un tumore trattato
- la percentuale rimasta di cellule vive del tumore, in contrasto con le cellule
necrotiche (morte), e le zone dove le cellule tumorali sono state distrutte e rimane
solo formazione di tessuto cicatriziale (spesso descritto come "ialinizzazione").
Quanto minore è la percentuale di cellule tumorali vitali osservate, tanto migliore è
stata la risposta al trattamento anche se ci possono essere ancora cellule tumorali
vitali nel tumore o in altre parti del corpo.
A volte un tumore trattato con successo diventerà ipocellulare, presenterà meno
cellule, vale a dire che i nuclei delle cellule tumorali sono più lontani l’uno dall’altro
con più stroma intermedio e/o tessuto cicatriziale, anche se le cellule del tumore sono
ancora vitali. Anche dopo la rimozione di tutta la malattia metastatica visibile, il
trattamento di solito è continuato.
Alcuni tumori trattati, che sono cresciuti per effetto della resistenza alle terapie
farmacologiche mirate, come Imatinib, possono mostrare cambiamenti insoliti che il
patologo può rilevare.
Perdita di espressione della proteina KIT significa che le cellule tumorali non
possono più a lungo esprimere la proteina KIT se il tumore ha sviluppato un altro
percorso di sopravvivenza e di crescita. Per esempio, alcuni GIST trattati hanno
mostrato un "cambiamento di chinasi" per AXL, che rappresenta un fattore di crescita
sostituto. Se il tumore smette di risultare positivo per la proteina KIT, il patologo può
essere incerto se questo tumore è GIST o se si tratta di un nuovo tipo di malattia.
Variazione morfologia indica un cambiamento d’aspetto delle cellule, quale la
differenziazione verso un tipo diverso di cellule (come ‘rabdomiosarcomatosi’, che è
tipico del muscolo scheletrico) o de-differenziazione delle cellule verso forme più
primitive. Tali cambiamenti rendono più difficoltoso essere sicuri che il tumore sia
GIST. Fortunatamente, questi cambiamenti sono molto rari.
Ecco un esempio di referto su un tumore trattato con farmaci prima della resezione.
1. Alcuni dei miei campioni sono stati inviati ad un altro laboratorio per le
analisi: questo significa che il mio patologo non ha familiarità con i GIST?
Molti laboratori di routine inviano i campioni quando c’è bisogno di analisi non
eseguite regolarmente sul posto. Questo può includere analisi immunoistochimiche e
analisi mutazionale.
2. Il referto del mio patologo riporta la conta mitotica per 10 HPF e non per 50
HPF o non fornisce alcun conteggio ma dice “mitosi scarse”: è affidabile tutto
ciò? Potrebbero essere ricontate le mitosi, se necessario?
E' importante ottenere un conteggio effettivo di mitosi per 50 HPF, perché un
campione troppo piccolo può dare risultati non rappresentativi. Il chirurgo o
l’oncologo possono richiedere al patologo di fornire una più completa analisi se
l'informazione implica un cambiamento del modo in cui il caso sarà gestito. Questo è
generalmente il caso di un campione di grandi dimensioni (cioè, il campione della
resezione chirurgica).
In un campione bioptico di piccole dimensioni (ago biopsia con ago a scatto o biopsia
endoscopica della mucosa), non vi è di solito tessuto sufficiente per una conta
mitotica in 50 HPF, ma in alcuni casi la conta mitotica in un minor numero di campi
può contribuire a guidare la successiva gestione clinica del paziente.
3. Se il referto del patologo che ha esaminato il mio GIST sembra mancare di
alcune informazioni, rispetto alle descrizioni contenute in questo opuscolo, devo
chiedere che il mio campione venga inviato ad un patologo esperto di sarcomi?
Dovresti sentirti a tuo agio nel porre domande al tuo oncologo sul referto del
patologo. Il medico può discutere la diagnosi con il patologo, il quale dovrebbe essere
in grado di fornire ulteriori dettagli se necessario per la valutazione del rischio. In rari
casi con modelli istologici insoliti o risultati insoliti di immunoistochimica (per
esempio, i GIST KIT-negativi), il tuo patologo può decidere di inviare i vetrini ad un
patologo con particolare esperienza nella diagnosi GIST per confermare la diagnosi.
4. Nel referto del patologo il mio tumore è definito “benigno” – che cosa significa
ciò? Era tumore? Ho bisogno di follow–up? Oppure significa che il patologo non
ha molta familiarità con i GIST?
Se di un GIST si dice che è “benigno”, ciò significa che al momento della resezione
non ha metastatizzato e la possibilità di future metastasi si suppone che sia molto,
molto piccola. Un patologo esperto di GIST preferisce non usare la parola “benigno”,
in quanto vi è una possibilità di recidiva per tutti i GIST di dimensione di 2 cm o più
grandi, e la rimozione chirurgica è raccomandata per tutti questi GIST. Solo i GIST
inferiori a 2 cm possono essere chiamati “benigni” da qualcuno, poiché il rischio di
aggressività si avvicina a 0%. Alcuni di questi tumori di piccole dimensioni possono
essere destinati ad acquisire le caratteristiche che consentono loro di crescere, ma la
maggior parte dei "Micro-Gist" (piccolissimi tumori) inferiori a 2 cm non diventano
più grandi e sono comunemente trovati negli stomaci operati per altre ragioni o in
caso di autopsia.
5. Perché il referto del mio patologo non indica ‘‘grado’’ o ‘’stadio’’ del mio
GIST
La stadiazione “TNM” di AJCC non era ancora disponibile per i GIST anteriormente
al 2010; perciò i referti antecedenti non includono uno stadio. Gli schemi di
stadiazione per altri sarcomi non si applicano ai GIST. I referti antecedenti al 2010,
relativi ai tumori primari, dovrebbero essere confrontati con i criteri di rischio di
recidiva disponibili al momento in cui è stato scritto il referto. I criteri di consenso
NIH si sono resi disponibili nel 2002, e i criteri Miettinen e Lasota sono entrati in uso
nel 2007. Tuttavia, se i referti più vecchi comprendono le informazioni richieste, è
possibile assegnare uno stadio utilizzando lo schema più recente della stadiazione
dell’ AJCC del 2010. Poiché la stadiazione dell’AJCC e le linee guida dell’ NCCN
sono essenzialmente equivalenti, l’uno o l’altro schema sono appropriati.
6. Perché il referto del patologo sul mio GIST non include informazioni sui
linfonodi?
I Gist molto raramente metastatizzano (si diffondono) ai linfonodi (diversamente da
molti altri tipi di tumore), con l’eccezione di GIST molto rari nei bambini. Se il
chirurgo avesse notato alcun linfonodi che sembravano ingranditi, questi sarebbero
stati rimossi. Il patologo descriverà tutti i linfonodi inclusi nel pezzo operatorio.
7. Ho bisogno di una seconda opinione per quanto riguarda la mia diagnosi di
GIST o di rischio di recidiva dal momento che il GIST è una malattia rara e
molti patologi vedono raramente casi di GIST?
La maggior parte dei patologi dovrebbe essere informata sui GIST e in grado di
applicare i criteri discussi sopra. In caso di dubbio, è bene richiedere un secondo
parere da parte di un anatomo-patologo esperto in sarcomi. A volte questo è richiesto
dal patologo che per primo ha esaminato il caso.
8. Perché il referto del mio patologo non include l’analisi mutazionale dei geni
KIT e PDGFRA?
Alcuni centri oncologici eseguono automaticamente l’analisi mutazionale, ma la
maggior parte dei centri di cura non la fa. Questa è un'analisi che deve essere
richiesta espressamente. Anche se viene fatto il test delle mutazioni, esso può essere
riportato separatamente nella relazione del patologo.
9. Ho bisogno dell’analisi mutazionale sul mio GIST?
L’analisi mutazionale dovrebbe essere presa in considerazione prima di iniziare il
trattamento farmacologico soprattutto in situazioni quali queste:
• Per i tumori non gastrici a rischio intermedio e alto, perché questi potrebbero
avere la mutazione di KIT nell’esone 9, per il quale è più appropriata una dose
più alta di farmaco (800 mg al giorno di Imatinib anzicchè 400).
• Per i tumori con espressione di KIT negativo o altri tumori sospettati di avere
Terminologia nei referti di patologia
mutazione PDGFRA, per i quali potrebbe essere più appropriato un farmaco
diverso da Imatinib.
• Per i giovani pazienti i cui tumori è probabile che siano wild-type (mancanti di
mutazione nei geni KIT e PDGFRA) perchè anch'essi potrebbero richiedere
farmaci diversi da Imatinib.
• Per decidere sull'uso adiuvante della terapia, a scopo precauzionale.
10. Se ho bisogno che sia fatta l’analisi mutazionale, come fare ad ottenerla?
Il chirurgo o l’oncologo può richiederla. Il tuo patologo può eseguire l'analisi in loco,
utilizzando i campioni di tessuto prelevati con la biopsia o con l'intervento chirurgico,
oppure inviare i campioni a un laboratorio di riferimento .
11. Ci sono test aggiuntivi che possono predire con maggiore esattezza il rischio
di recidiva per il GIST (sia recidiva locale che metastasi a distanza?)
I patologi e i loro colleghi non hanno ancora raggiunto un consenso su ulteriori test
che potrebbero aiutare a prevedere quante probabilità ci siano che un GIST primario
chirurgicamente resecato si ripresenti, ma questo è al centro dell'attenzione. I pazienti
ad alto rischio di recidiva possono scegliere di prendere Imatinib a scopo preventivo
(si chiama “terapia adiuvante”).
12. Per quanto tempo il campione del mio tumore sarà conservato in caso io
abbia bisogno inseguito di altre analisi?
I tessuti fissati in formalina ed inclusi in paraffina (FFPE) sono conservati per almeno
10 anni dalla maggior parte delle istituzioni; molti conservano questo materiale a
tempo indeterminato. Tutte le analisi in corso per i GIST possono essere eseguite
utilizzando tessuti FFPE; è probabile che ogni nuovo test venga adattato anche a
questo tipo di conservazione del tessuto in quanto è il tipo più comune di campione
disponibile.
I campioni congelati possono essere conservati ed essere utilizzati per molte analisi,
ma offrono pochi vantaggi a questo punto, dato che tutti i test sono stati ottimizzati
per l'uso di FFPE.
13. Se io in seguito vado in un centro oncologico diverso, sarà ripetuto l’esame
patologico?
Se si va in una clinica specializzata in sarcomi, i campioni di solito saranno almeno
esaminati da un patologo esperto in GIST. Alcune analisi potrebbero essere ripetute
se i vetrini non sono forniti dal centro di cura di provenienza, oppure se il patologo
esperto si sente più sicuro con i risultati ottenuti dal suo laboratorio.
14. Posso avere campioni in più di tumore del mio GIST da conservare per uso
futuro?
Questa è una buona idea, perché ogni anno ci sono sempre nuove conoscenze sui
GIST. Se ci saranno nuovi trattamenti in futuro, potrebbe essere necessario un test
sul campione del tumore per sapere se il trattamento si applica al tuo tipo di
GIST. È possibile organizzarsi in modo da salvare campioni in più, chiedendolo al
chirurgo prima dell’intervento. Il chirurgo dovrà contattare il dipartimento di
patologia per prendere accordi. Comunque nella maggior parte dei casi, le sezioni di
tumore FFPE, prese per gli esami patologici di routine, saranno sufficienti per test
supplementari (per gli Usa, ndr).
15 Posso dare i miei campioni di GIST come contributo ad una banca dei tessuti,
o biobanca o ai ricercatori che studiano i GIST?
Si, e questo è un grande aiuto alla ricerca sui GIST! Tu puoi dare i campioni
all’ospedale dove è stato fatto l’intervento (se in quell’ospedale si stanno conducendo
ricerche sui GIST) così come ad altre banche dei tumori o a ricercatori. È necessario
fare questa richiesta in anticipo per garantire che il tessuto in più venga salvato al
momento dell’intervento chirurgico (per gli Usa, ndr).
Atipia: forma e/o dimensione anomala delle cellule; può essere focale (in punti
particolari) o diffusa (in tutto il campione).
Necrosi coagulativa: una zona di tessuto che è morto a causa della mancanza di
sangue. Sotto il microscopio le cellule appaiono "fantasmi", perché non si colorano
come fanno le cellule viventi, ma la loro struttura cellulare è conservataDegenerazione cistica: aree apparentemente simili a cisti di tessuto degenerato o
necrotico (morto) all'interno del tumore. Mentre il grado di necrosi è importante in
altri sarcomi per il ‘grading’(determinazione del grado di differenziazione istologica
di un tumore), questo non sembra essere il caso dei GIST.
Citologia: esame delle cellule fatto al microscopio. Studio delle cellule, di solito
eseguito su un’area del tessuto patologico che mostra le caratteristiche delle singole
cellule (piuttosto che le proprietà dell'architettura dei tessuti) per la diagnosi.
Citoplasma : parte di una cellula delimitata dalla membrana cellulare e dal bordo
del nucleo della cellula (il nucleo è escluso).
De-differenziazione: un processo anomalo per cui le cellule tumorali perdono la loro
caratteristica forma e struttura specializzata e diventano più primitive e meno
Letture aggiuntive
facilmente riconosciute come aventi una specifica tipologia di differenziazione.
Differenziazione : Il normale processo per cui una cellula meno specializzata diviene
un tipo di cellula più specializzata che è differente per struttura e funzionalità,
riconoscibile per un fenotipo più maturo. Il patologo può formulare un’ ipotesi
diagnostica del tipo di tumore dalla differenziazione delle cellule tumorali e in base a
quanto più assomigliano alle normali cellule di alcuni tipi di tessuto.
Displasia: eccesso di crescita di cellule di aspetto anomalo, di solito una condizione
precancerosa in cui le cellule mostrano una extra proliferazione che causa un
accumulo di tessuto anomalo, che può indicare l'inizio di un tumore.
Citoplasma eosinofilo: citoplasma della cellula che si colora di rosa, eosina
Fascicoli: l'aspetto di fasci di cellule all'interno della struttura del tessuto tumorale.
Fusiformi: cellule a forma di fuso, più ampio al centro e che si assottigliano verso le
due estremità.
Colorazione tipo ‘apparato del Golgi’ : colorazione puntiforme perinucleare in
immunoistochimica di KIT; questa caratteristica non ha alcun significato conosciuto.
Emorragia: sanguinamento in un organo, in una cavità del corpo o nel tumore.
Cellularità alta, densità cellulare: fitte cellule all'interno del tumore, a volte
indicanti una proliferazione cellulare più veloce.
Ialinizzazione: una forma di fibrosi (cicatrizzazione), caratterizzata da abbondante
collagene e poche cellule.
Iperplasia: crescita eccessiva di cellule di aspetto normale in un tessuto.
Infiltrazione o invasione: la crescita di cellule tumorali nel tessuto delle strutture
anatomiche adiacenti. I GIST di solito crescono in modo non-invasivo, allargando i
confini tra tumore e tessuto normale. Confini invasivi o infiltranti possono indicare
un tumore più aggressivo.
Necrosi colliquativa: una zona di tessuto che è morto e la struttura cellulare non è
più presente, perché le cellule morte sono state digerite, lasciando un aspetto simile a
liquido.
Necrosi: Vedi necrosi coagulativa e necrosi colliquativa
Atipia nucleare: nuclei di cellule anormali; può suggerire malignità nel contesto
corretto.
Palizzata nucleare: l'allineamento dei nuclei delle cellule in modo da assumere
l’aspetto di zone colorate di rosa e di blu. Non vi è alcun significato noto di questo
modello.
Vacuolizzazione perinucleare: la presenza di solito di uno o due grandi vacuoli
(grandi vescicole intracitoplasmatiche) in prossimità del nucleo della cellula che
possono intaccare il nucleo. Il significato di questo è incerto
Pleomorfo: marcata variazione nelle dimensioni e nella forma delle cellule .
Penetrazione Sierosa: I GIST normalmente crescono verso l'esterno dalla loro
origine nella parete dell’apparato GI eventualmente penetrando il rivestimento
esterno (membrana sierosa) e crescendo nella cavità addominale (peritoneo).
Fibre Skeinoid: strutture filamentose viste spesso nel tessuto dei GIST che originano
dal piccolo intestino. Il loro significato è incerto.
Ulcerazione: descrive i danni al rivestimento interno del tratto GI (la mucosa) nel
punto dove un GIST interrompe il rivestimento interno dell'intestino attraverso il
quale sangue o materiale necrotico dal GIST possono entrare nell’apparato GI.
Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for
diagnosis, treatment and followfollow-up.
P. G. Casali & J.-Y. Blay, on behalf of the ESMO/CONTICANET/EUROBONET
Consensus Panel of Experts. Annals of Oncology 21 (Supplement 5): v98–v102,
2010. Free access at this link:
http://annonc.oxfordjournals.org/content/21/suppl_5/v98.full.pdf+html
NCCN Task Force Report: Update on the Management of Patients with
Gastrointestinal Stromal Tumors.
G.D. Demetri et al. Journal of the National Comprehensive Cancer Network Volume
8 Supplement 2 (April 2010). Free access at this link:
http://www.jnccn.org/content/8/Suppl_2/S-1.full.pdf+html
Soft Tissue Sarcoma (NCCN Clinical Practice Guidelines in Oncology series).
series)
G.D. Demetri et al for the NCCN Soft Tissue Sarcoma Panel.
This document, updated at least annually, includes flow charts for GIST
diagnosis
and treatment. To access this document complete a free registration at this
link:
http://www.nccn.org/professionals/physician_gls/f_guidelines.asp
Autori dell’Opuscolo
Il dott. Jason Hornick è professore associato di Patologia alla Harvard Medical School, Direttore Associato
di Surgical Pathology e Direttore di Immunoistochimica al Brigham and Women’s Hospital di Boston USA.
Ha numerose pubblicazioni sulla patologia dei tumori dei tessuti molli, sulla patologia gastrointestinale e
sulla immunoistochimica diagnostica inclusi molti studi e articoli sui GIST e c-kit. Le sue ricerche
riguardano la definizione dei criteri diagnostici per i tumori dei tessuti molli, l’identificazione delle
caratteristiche associate a malignità ed aggressività e il trasferimento nella pratica clinica delle scoperte
scientifiche. Il suo obiettivo è quello di fornire nuove conoscenze di patologia per migliorare la
classificazione dei tumori e identificare nuovi potenziali bersagli per terapie innovative.
Il dott. Alexander Lazar è un patologo ultra specializzato e che si dedica totalmente alla diagnosi ed alla
genotipizzazione molecolare dei sarcomi e dei melanomi. E’ Professore Associato al Sarcoma Research
Center del M.D. Anderson Cancer Center di Houston, USA, dove lavora insieme ai Dott. Dina Lev e
Raphael Pollock sui cambiamenti genetici nella patogenesi dei sarcomi. E’ autore e co-autore di numerose
pubblicazioni sui vari aspetti della patologia dei sarcomi e della ricerca translazionale. E’ membro
dell’American Joint Cancer Committee (AJCC) della Task Force dei sarcomi dei tessuti molli e della
commissione relativa alle sottocommissioni per i sarcomi dei tessuti molli e referente GIST per il CAP
(Collegio dei Patologi Americani)
Questo opuscolo spiega la diagnosi di GIST e dice ai pazienti e alle loro famiglie
quello che c'è da sapere per discutere il piano terapeutico con i loro medici
Il presente opuscolo è stato curato dal GSI, GIST Support International che è una
organizzazione non profit di volontari, creata da una comunità di pazienti e amici di pazienti
basata su internet. La loro missione è quella di fornire educazione e supporto in tutto il
mondo alle persone che vivono col GIST.
Il sito del GSI è www.gistsupport.org ed offre
• informazioni mediche aggiornate sul GIST e sul trattamento
• risposte degli esperti alle domande dei pazienti
• condivisione di storie e discussioni tra le persone affette da GIST
• guida dei pazienti alle ultime terapie efficaci ed agli studi clinici
• suggerimenti per trovare assistenza finanziaria.
La e-mail listserv per pazienti, familiari e chi è interessato al GIST
• Offre un ambiente sicuro dove le persone possono porre domande
• Fa condividere consigli e supporto emotivo
• Permette la formazione di una comunità on line di amici che combattono insieme il
GIST
La e-mail listserv per GIST pediatrici e wild type
• Permette di soddisfare le speciali necessità dei giovani rari pazienti GIST
• Offre una comunità ai pazienti ed ai giovani pazienti.
Il GIST support Wiki al link http://gistsupport.medshelf.org/Main_Page
• Fornisce una lista di strategie pratiche per convivere col GIST
• Indica alcuni modi per alleviare i sintomi e gli effetti collaterali delle terapie
• Raccoglie suggerimenti su una serie di argomenti che riguardano i pazienti GIST
www.gistsupport.org