•Simmetria nelle molecole
•Chiralità
•Distinzione tra gruppi enantiotopici e diastereotopici
•Sintesi stereoselettive
•Metodi per la determinazione dell’eccesso enantiomerico
•Catalisi stereoselettiva
•Esperienza 4
Elementi ed operazioni di simmetria
Elementi
Operazioni
- asse di rotazione Cn (n = 1, 2, 3, ... ∞ )
- rotazione attorno all' asse di 360°/n
- piano di riflessione σ
- riflessione nel piano
- centro di inversione i
- inversione delle coordinate (da x,y,z a -x,-y,-z)
- asse di roto-riflessione Sn (n = 4, 6, ...)
- rotazione attorno all' asse di 360°/n seguita da
una riflessione in un piano perpendicolare all'
asse (per n = 1, S1 = σ; per n = 2, S2 = i)
Gli elementi di rotazione semplice Cn e le corrispondenti operazioni sono detti del primo ordine
Gli elementi di riflessione Sn e le corrispondenti operazioni sono detti del secondo ordine
Anche gli elementi σ e i e le relative operazioni sono detti del secondo ordine
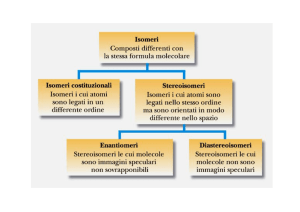
Una molecola è chirale quando possiede solamente
elementi di simmetria del primo ordine
Esempi di molecole che posseggono assi di rotazione semplici
H
O
H
Cl
Cl
H
C2
Cl
Cl Cl
Cl
Cl
C3
C4
Me
H
H
H
H
OH
H
H
H
H
C6
Cl
C1
C∞
solo una rotazione di 360°
(l' operazione "identita'")
genera la stessa molecola
Esempi di molecole che posseggono piani di riflessione
H
O
H
O
1σ
H
H
O
H
H
2σ
7σ
4σ
Me
H
OH
C1
Me
H
Me
C
C2
molecole che non contengono nessun σ
H
1+∞ σ
Esempi di molecole che posseggono un i o un Sn
HOOC
OH
H
HO
H
COOH
i = S2
HOOC
HO
H
OH
H
COOH
H
HO
HOOC
COOH
OH
H
HOOC
HO
H
rotazione di 180°
riflessione
Me
Me
Me
Me
S4
OH
H
COOH
Relazioni tra coppie di isomeri (K. Mislow, Bull. Soc. Chim. Belg. 1977, 86, 595)
HO
Si consideri
H
COOH ed una qualsiasi molecola a
H3C
formula C4H8O4
HO H
La molecola di riferimento ed il suo isomero sono correlate da un' operazione di simmetria ?
sì
E' un' operazione
del primo ordine ?
sì
(un Cn)
sì
H
OH
omomeri
no
(un Sn)
OH
HOOC
HOOC
H
Hanno lo stesso tipo di legami,
la stessa costituzione?
no
H OH
CH3
no
H OH
H
HO
H
COOH
CH3
enantiomeri
equivalenti per simmetria
HO
H3C
HO H
diastereoisomeri
COOH
HOH2C
H H
isomeri costituzionali
non equivalenti per simmetria
Relazioni tra atomi o gruppi di atomi di una molecola
Gli atomi o i gruppi di atomi sono correlati da un' operazione di simmetria ?
sì
E' un' operazione
del primo ordine ?
sì
no
Hanno lo stesso tipo di legami,
la stessa costituzione?
sì
no
no
(un Cn) (un Sn)
enantiotopici
omotopici
equivalenti per simmetria
Hb
Mey
Hc
Ha'
costituzionalmente
eterotopici
non equivalenti per simmetria
Hd
Ha
diastereotopici
Mex
Mex and Mey = omotopici (scambiati da C2)
Ha and Hc = omotopici (scambiati da C2)
Ha and Hb = enantiotopici (scambiati da σ)
Hb and Hc = enantiotopici (scambiati da i)
Ha and Ha' = diastereotopici
Ha and Hd = costituzionalmente eterotopici
X
X, X
omotopici [R = R]
R
Si comportano in modo identico
R
X
X
enantiotopici [ R = R']
R
Si comportano in modo identico
solo in assenza di reagenti chirali
R'
X
X
diastereotopici
R
[ R = R* ; R* Chirale ]
R*
X
Si comportano in modo diverso
Danno segnali diversi all’NMR
Conseguenze della generazione di unita' stereogeniche
Considerazioni di simmetria e di topicita' relativa permettono di prevedere il numero di segnali di uno spettro
NMR protonico, nonchè il tipo ed il numero degli stereoisomeri che si possono formare in una reazione
che genera unita' stereogeniche. In particolare, sostituzione di atomi (o gruppi di atomi, o su facce):
COOR
COOR
omotopici
H
H
COOR
H
Me
COOR
COOR
enantiotopici
diastereotopici
H
H
H
Me
Ph
Ph
COOR
+
Ph
Me
H
COORR
H
Me
Ph
genera enantiomeri
Ph
*
*
*
COORR
H
H
COOR
non genera stereoisomeri
COORR
+
Me
H
Ph
genera diastereoisomeri
Atomi, gruppi di atomi, e facce diastereotopici
Gli atomi e i gruppi diastereotopici sono indicati in grassetto;
le molecole asteriscate posseggono anche facce diastereotopiche.
H
H
H
H
H
H
H
ClFHC
H
H
Me
F
F
F
H
H Me H
H
H
O
*
*
H H
H H
H
H
H
H
HO H
Cl
HO H
Me
H
R
O
*
HO
*
H
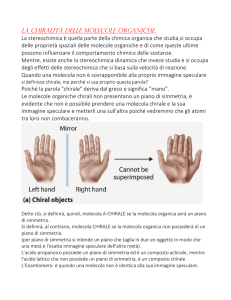
La chiralita' e' una proprieta' "pervasiva" della molecola
Tutti i punti di una molecola chirale sono chirali e sono definiti chirotopici
(K. Mislow and J. Siegel, JACS 1984, 106, 3319)
La chirotopicita' e' la proprieta' di un punto di una molecola che giace in un intorno chirale,
cioe' che non giace su un elemento di simmetria del secondo ordine. Poiche' una molecola
chirale non contiene elementi del secondo ordine, tutti i suoi punti sono chirotopici.
A l' interno di una molecola la
O
carvone
"the less active enatiomer should be
regarded as a medicinal pollutant.."
cumino
"all new drugs should be marketed
as single enantiomers unless it can
be shown that the racemate has
added benefits"
*
menta
HO
HO
HO
saccarosio
O
HOCH2
D: metabolizzato
OH
O
O
HO
• About 1/3 of medicinal drugs are
chiral; in 9 out of 10 of the top
selling drugs, the active ingredient
is chiral
L: Non-metabolizzato
CH2OH
OH
(+) Repellente per zanzare
PTX (+)-251D
OH
N
(-) 10 volte meno efficace
R (+) erbicida
Cl
H3C
(R)-(+)-Dichloroprop
O
Cl
H
CO2H
S (-) non attivo
Palitossina: il composto naturale, non-peptidico, più tossico
Sintesi realizzata da Kishi nel 1994
Possiede 64 centri stereogenici
Sono possibili 264 stereoisomeri
Impossibile senza sintesi stereoselettiva
OH
O
O
OH
O
OH
OH
HO
H2N
OH
HO
OH
OH
O
OH
OH
OH
OH
OH
OH
O
O
HN
N
H
OH
HO
HO
OH
O
OH
OH
O
OH
HO
OH
HO
OH
O
O
OH
O
HO
OH
OH
H OH
HO
H
O
OH
OH
OH
OH
HO
OH
OH
OH
OH
Metodi per ottenere composti chirali
1) Sintesi da composti enantiomericamente puri
2) Tecniche di risoluzione chirale
3) Metodi che prevedono ausiliari chirali
4) Catalisi asimmetrica
a) enzimatica
b) chimica/ biomimetica
-catalisi con metalli
-organocatalisi
•
•
☺ Applicabilità generalmente
ampia all’interno di classi di
reazioni
Catalizzatori
organometallici
possono essere tossici
•
•
•
•
•
☺ Non rimane
contaminazione da parte di
metalli
☺ Biodegradabili
Catalizzatori
organici
•
Applicabilità ristretta a
poche classi di reazioni
•
☺ Generalmente altamente
chemo, regio, distereo- ed
enantioselettivi
☺ Richiedono condizioni
blande
☺ L’elevata selettività rende
possibili reazioni one-pot
☺ Non sono tossici
Enzimi
•
•
Scarsa applicabilità a
sostanze diverse
Scarsa stabilità in vitro
Determinazione del decorso stereochimico di una reazione stereoselettiva
Una volta effettuata una reazione stereoselettiva e' necessario determinare :
- con quale eccesso si e' ottenuto uno stereoisomero rispetto all' altro;
- quale e' la configurazione relativa e/o assoluta dello stereosiomero maggioritario.
L' eccesso enantiomerico (ee) e' espresso dall' equazione:
R - S
ee% =
Da cui % R
=
R
R + S
Se ee = 93% allora % R
x 100 =
100 - ee%
2
+ ee%
= 96.5
In altre parole c'e' il 93% di R
e il 7% di racemo.
Se ee = 100% il prodotto viene definito enantiomericamente puro.
R + S
x 100 ( se R > S)
Metodi di I classe: polarimetria
-Semplice:
Sperimentalmente si sfrutta un paragone di potere ottico rotatorio con un
valore noto e presunto essere quello di un campione puro. Teoricamente si
basa sull' esistenza di una relazione lineare tra il potere ottico rotatorio e la
composizione enantiomerica secondo l' equazione:
α
ee% =
α
x 100
max
-Poco preciso:
Si devono assumere: l' esistenza della relazione lineare;
la riproducibilita' delle condizioni sperimentali della misura di [α];
la bontà della determinazione (sperimentale) di [α]max
Anche se si opera correttamente l'incertezza e' circa del 3%,
valore troppo elevato per molte applicazioni.
Metodi di I classe: NMR e cromatografia
NMR: Essendo equivalenti per simmetria, due enantiomeri danno spettri NMR identici.
Tuttavia, in presenza di un agente enantiopuro che interagisca in modo non covalente con
gli enantiomeri, questi possono dare segnali differenti, che, se integrabili separatamente,
consentono la determinazione dell' ee.
Tra gli agenti enantiopuri i piu' efficienti sono i reagenti di shift chirali, complessi di
lantanidi che coordinano i siti basici del substrato da analizzare creando complessi a
geometria diversa e quindi intorni magneticamente non equivalenti.
In pratica, protoni enantiotopici ed indistinguibili diventano diastereo-topici e
differenziabili.
Nelle migliori condizioni il metodo ha un' incertezza del 2% ed e' molto generale.
Cromatografia: Sfrutta l' eluizione di una miscela di enantiomeri su una fase
stazionaria enantiomericamente arricchita e le interazioni diastereoisomeriche che
si creano tra la fase stazionaria e gli enantiomeri. Le interazioni sono non covalenti
(legame a H, π/π, elettrostatiche) e si traducono in tempi di ritenzione diversi per i
due enantiomeri, i cui picchi vengono integrati separatamente. Le interazioni
devono essere almeno tre (modello di Pirkle), una delle quali deve essere piu' o
meno forte a seconda della configurazione dell' enantiomero.
Un' interazione piu' forte produce un tempo di ritenzione maggiore. Il metodo e'
molto sensibile, e, se applicato correttamente, ha un' incertezza < 1% ed e' molto
generale.
CH3
OH
O
MeO
naproxen
Conditions:
Chiralpak AD-H
Hexane/IPA/TFA, 80:20:0.1
Flow: 1.0 mL/min
Fasi stazionarie chirali
1)
A base di polisaccaridi (amilosio e cellulosa) ancorati a particelle di silica
[compatibili con alcoli come eluenti]
2)
Fasi di tipo Pirkle o Brush sfruttano interazioni diverse (π-π, legami ad H,
interazioni steriche) generate in seguito all’interazione con piccole molecole
legate alla silica [adatte solo a molecole aromatiche]
3)
A base di ciclodestrine [adatte a molecole con gruppi idrofobici o aromatici che
possono essere introddotti nella cavità delle ciclodestrine]
4)
A base di glicopeptidi macrociclici legati alla silica, contengono molti centri
chirali e cavità capaci di ospitare gli analiti.
5)
A base di proteine [adatte a soluzioni acquose, in presenza di analiti ionizzabili]
Metodi di II classe
Prevedono la trasformazione di una miscela di enantiomeri in diastereoisomeri.
Qualunque metodo analitico sufficientemente sensibile (NMR, cromatografia) può
differenziare due diastereosiomeri e permette di risalire all' ee dal rapporto
dastereoisomerico. Va notato che la trasformazione degli enantiomeri in diastereoisomeri
ed il fatto stesso che questi ultimi abbiano proprieta' chimico-fisiche diverse possono
essere fonti di notevoli errori.
Per convertire correttamente una miscela di enantiomeri in una di diastereosiomeri si
deve:
- usare un agente derivatizzante enantiopuro
- avere reazioni quantitative o che procedono in assenza di risoluzione cinetica
- non incorrere in racemizzazioni
L' analisi deve evitare
- arricchimenti accidentali in uno dei due diastereoisomeri (per esempio per differenza di
solubilità)
- risposte non lineari rispetto alla concentrazione (per esempio per differenza di
assorbimento UV)
ESP. 5
Determinazione dell’eccesso enantiomerico di una
miscela di R /S 1-feniletilammina
CH3
CH3
NH2
NH2
R
S
analisi polarimetrica in etanolo.
Dato di letteratura: (S)-(–)-1-feniletilammina: [a]D = –30,
Conc = 0.1 g/mL in EtOH.
ESP. 5
Determinazione dell’eccesso enantiomerico di una
miscela di R /S 1-feniletilammina
CH3
CH3
NH2
NH2
S
R
Method A. Synthesis of the acetamide
analisi HPLC chirale.
Ac2O, Et3N
NH2
1
H
N
CH2Cl2
rt
2
O
ESP. 5
Determinazione dell’eccesso enantiomerico di una
miscela di R /S 1-feniletilammina
CH3
CH3
NH2
NH2
S
R
CH3
analisi 1H-NMR con
shift reagent chirale.
H3C
CF3
O
H3C
Eu
O
3
Sintesi stereoselettiva
Preparazione di farmaci enantiomericamente puri, in modo meno
costoso rispetto all’estrazione da fonti naturali
CHEMOSELETTIVITA’: reazione preferenziale di un gruppo funzionale
rispetto ad un altro
REGIOSELETTIVITA’: formazione preferenziale di uno o più isomeri
strutturali per reazione di un gruppo funzionale
STEREOSELETTIVITA’: formazione preferenziale di uno o più prodotti
che differiscono solo per la configurazione
Sintesi stereoselettiva
Reazione di due enantiomeri con una molecola chirale
Es. Esterificazione di un acido chirale con un alcol chirale
TS1
TS2
G
NB: caso simile se invece di
una coppia di enantiomeri si
ha un doppio legame
prochirale
E1, E2
+ R*
P2
diastereoisomeri
P1
Coord. reazione
Sintesi stereoselettiva
Reazione di due enantiomeri con una molecola achirale
Es. Esterificazione di un acido chirale con un alcol achirale
TS1 , TS2
G
E1, E2
+R
NB: caso simile se invece di
una coppia di enantiomeri si
ha un doppio legame
prochirale
NB2: in casi particolari si
possono formare
diastereoisomeri
P1, P2
enantiomeri
Coord. reazione
Catalisi stereoselettiva: utilizzo di un catalizzatore chirale
Il catalizzatore permette cammini alternativi, a basse energie
Se il catalizzatore è chirale, può permettere di
differenziare le energie dei cammini di reazione dei due
enantiomeri
E1 + R
Cat *
E1
R
‡
P1
Cat *
enantiomeri
E2 + R
Cat *
E2
R
‡
P2
Cat *
Stati di transizione diastereoisomerici
Utilizzo di un catalizzatore chirale
Reazione non catalizzata
TS1 , TS2
E1
R
‡
Cat *
G
E1
R
‡
Cat *
E1, E2
+R
P1, P2
enantiomeri
Coord. reazione
Utilizzo di un catalizzatore chirale
E1
G
R
‡
Cat *
ΔΔG‡
ΔG1‡
E1
ΔG2‡
R
‡
Cat *
E1, E2
+R
Il catalizzatore
agisce sulla cinetica
del processo, non
sulla termodinamica
P1, P2
enantiomeri
Coord. reazione
Reazioni controllate cineticamente (non termodinamicamente)
La differenza di velocità di E1 ed E2 sarà legata al ΔΔG‡
E1 + R
E2 + R
Cat *
v1 = d[P1]/dt = k1·[E1]n·[R]m·[Cat *]p
Cat *
v2 = d[P2]/dt = k2·[E2]n·[R]m·[Cat *]p
A inizio reazione ( [E1] = [E2] ):
v1 / v2 = k1 / k2 = exp(-ΔG1‡/RT) / exp(-ΔG2‡/RT) = exp(-ΔΔG‡/RT)
ΔΔG‡ = RT*ln(k2/k1)
ΔΔG‡ = RT*ln(k2/k1)
Dato un certo sistema, ΔΔG‡ è fissato
Come varia k2/k1 in funzione della T ?
500
450
Valori fissati
di ΔΔG‡
0.5 Kcal/mol
k2/k1 400
350
1 kcal/mol
1.5 Kcal/mol
300
250
200
2 kcal/mol
4 kcal/mol
150
100
50
0
0
50
100
150
200
250
300
T (K)
350
400
NOTA BENE (1)
500
450
k2/k1
0.5 Kcal/mol
400
350
1 kcal/mol
1.5 Kcal/mol
300
250
200
2 kcal/mol
4 kcal/mol
150
100
50
0
0
50
100
150
200
250
300
350
400
T (K)
Anche se il valore di k2/k1 aumenta al diminuire di T, i valori assoluti di k2
e k1 diminuiscono entrambi, cioè le reazioni diventano molto più lente!!
ln (k) = -ΔG/RT
NOTA BENE (2)
Fissato un sistema, compresa la T, si avrà un rapporto k2/k1 costante
Se però la velocità di reazione dipende dalla conc. del reagente, il
rapporto tra le velocità non rimarrà costante
durante il corso della reazione
es:
Miscela di E1 e E2 che reagiscono con B, con k1 > k2
E1 + B → P1
v1 = d[P1]/dt = k1*[E1]*[B]
E2 + B → P2
v2 = d[P2]/dt = k2*[E2]*[B]
k1*[E1]
v1/v2 = k1*[E1]*[B]/k2*[E2]*[B] =
k2*[E2]
Il rapporto tra le velocità sarà
massimo all’inizio, per poi
diminuire, dovuto al
‘consumo’ di [E1]