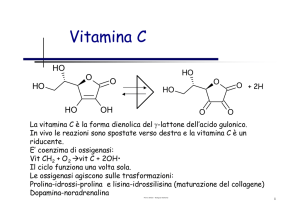
Transferasi che hanno come coenzima
PIRIDOSSAL FOSFATO o PALP
(derivato dalla VITAMINA B6 )
§
§
Altre transferasi hanno come CoE:
Vitamina B6
H2 C
HO
CH2
O
4
5
3
6
2
N
OH
CH3
1
Prof. G. Gilardi - Biological Chemistry
1
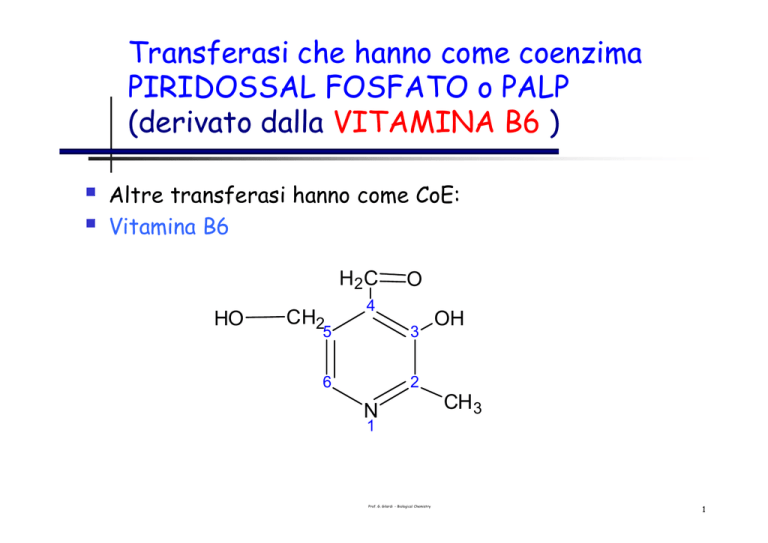
Transferasi che hanno come coenzima
PIRIDOSSAL FOSFATO o PALP
(derivato dalla VITAMINA B6 )
Struttura:
PIRIDINA (le cellule vegetali e procariote possono
sintetizzarla con cicli legati al metabolismo del
triptofano).
H2 C
HO
CH2
Forme in cui si può trovare:
PIRIDOXOLO E PIRIDOXAMINA, sono facilmente
convertite in piridoxale, il principio attivo vero e proprio. piridoxolo
Il passaggio da vit a CoE avviene mediante una marcatura
cinasica con P sull’idrossimetile.
PAL + ATP à PALP + ADP
La molecola così marcata è riconosciuta dagli E che la usano
come CoE.
HO
OH
N
CH3
H2 C
NH2
CH2
OH
N
H 2C
HO
CH2
O
OH
N
H2 C
OH
CH3
O
O
P
OH
CH2
OH
CH3
O
OH
N
Prof. G. Gilardi - Biological Chemistry
piridoxamina
CH3
2
Unione all’apoproteina e catalisi
Per l’Enzima l’unione avviene come per derivati della vit B1 e B3
(gruppo metilico ed attacco elettrofilo sul carbocatione che si è
formato sull’E).
H2 C
OH
O P
O
CH2
O
O Me
OH
N
CH2 -enzima
Questi E avranno funzionalità diversa in base ad un discriminante
sulla catalisi. Questo è un metallo di transizione (Me) presente
su differenti E che può indirizzare la catalisi in senso
TRANSFERASICO
LIASICO
ISOMERASICO
Il CoE arrivato nel sito attivo può reagire in modo diverso e dare
poi catalisi differenti.
Prof. G. Gilardi - Biological Chemistry
3
Transaminasi PALP
§
§
§
Le transferasi con piridossalfosfato come gruppo prostetico sono le
TRANSAMINASI che hanno il sito attivo per cui riconoscono gli α aa liberi.
Una volta accettati gli α aa liberi si ha attacco nucleofilo dell’NH2 sul
carbonile (reazione per la formazione del legame di Base di Schiff).
Eliminazione di OH- (virtualmente di H2O).
Eliminazione virtuale di acqua
HOOC
H2 C
OH
O
P
O
CH2
HOOC
CH
H2N
O
OH
R
O P
OH
OH
N
CH2-enzima
Base di Schiff
O
O
P
OH
CH2
O Me
N
CH2-enzima
Prof. G. Gilardi - Biological Chemistry
CH2
O
HOOC
O Me
N
CH
R
CH2-enzima
CH
N
HC
OH
NH
HC
OH
O Me
R
H+
4
Meccanismo di catalisi: cl. 2
§
§
A questo punto esplica la sua funzione il Me che con la sua simmetria dei legami
si coordina con l’N e promuove una transizione del doppio legame tra l’N ed il Cα
con dissociazione di 1 H+ . La struttura eterociclica passa dalla forma
aromatoide alla forma chinoide.
La simmetria dei legami centrata sul Me è organizzata spazialmente in modo da
far interagire il Me con il C sostituente in 4. Questo fa sì che si realizzi un vero
legame dativo con ritorno alla forma aromatoide e la presenza del carbanione
sul C sostituente in 4.
HOOC
O
O
P
OH
N
HC
OH
CH2
CH
O
O
P
OH
CH2
CH2-enzima
HOOC
O
O
P
OH
N
HC
OH
CH2
O Me
N
N
HC
OH
R
O Me
N
HOOC
O Me
N
H
C + H+
R
CH2-enzima
C
R
CH2-enzima
Prof. G. Gilardi - Biological Chemistry
5
Catalisi PALP: cl. 2
§
§
I gruppi dissociabili dell’Enzima danno la protonazione del carbanione
e quindi la stabilizzazione della struttura in questa seconda forma
con l’effetto di aumentare molto la δ+ sul Cα e prepararlo a subire
l’attacco nucleofilo di OH-.
L’intermedio che si stacca si stabilizza formando un doppio legame
C=O e dissociando un protone. (α-chetoacido).
HOOC
H
CH
OH
O
O
P
OH
CH2
N
O Me
N
C
HOOC
δ+
H
CH
OH
R
OH-
CH2-enzima
O
O
P
OH
CH2
NH2
O Me
N
C
O
R
CH2-enzima
§Ciò che era entrato nel sito attivo come α-aa ne esce come α-CHETOACIDO.
§Piridoxale → piridoxamina (l’NH2 dell’aa substrato al CoE)
§PRIMA META’ DELLA REAZIONE TRANSFERASICA
Prof. G. Gilardi - Biological Chemistry
6
a
1
metà della reazione
transferasica
§ PALP + aa1
H2 C
OH
O
P
O
CH2
O
HOOC
O Me
OH
+
N
PALP-NH2 + α−cheto a1
H2N
CH
R
H
CH NH2
OH
O
O
P
OH
CH2
CH2 -enzima
O Me
+
C
O
R
N
Prof. G. Gilardi - Biological Chemistry
HOOC
CH 2-enzima
7
2a metà della reazione
§
Quando esce il primo prodotto di reazione: il sito attivo si modifica, diventa capace di
riconoscere e legarsi ad un α-chetoacido.
Le reazioni si compiono simmetricamente a prima
Attacco nucleofilo dell’NH2 del CoE sull’α carbonile dell’ α-chetoacido.
Si forma il legame di base di Schiff e si realizza la coordinazione dell’N
Passaggio alla forma chinoide con trasposizione del doppio legame.
Alla fine del ciclo di trasformazione il carbanione si è formato sul Cα e qui avviene la
neutralizzazione e l’attacco idrolasico riguarda questa volta il C sostituente in 4.
§
§
§
§
§
OH
O
O
P
OH
CH2
C
O Me
OHO
O
P
OH
O
R
O
P
OH
CH2
CH 2
O Me
R
H+
R
O Me
CH2-enzima
N
H
HOOC
C
HC N
C
HC N
OH
O
CH 2-enzima
N
OH
HOOC
HOOC
H
CH NH2
H 2C
POH 2C
O
HOOC
O Me
+
H2N
CH
R
N
CH 2-enzima
N
Prof. G. Gilardi - Biological Chemistry
CH2 -enzima
8
Transaminasi
§
§
§
§
§
§
§
§
§
§
Ciò che era entrato come α-chetoacido esce come α-aa.
Questo processo non avviene con qualsiasi α-chetoacido ma solo con 3:
PA: acido piruvico
alanina (A)
PALP-NH2 +
OAA:acid o ossalacetico à PALP +
acido aspartico (D)
acido α−chetoglutarico
acido glutammico (E)
Le reazioni degli E transaminasici PALP dipendenti avvengono in 2 tempi.
MECCANISMO PING-PONG: la prima NH2 dall’aa al CoE, la seconda NH2 dal CoE su
uno dei tre accettori (α-chetoacido).
2 accettori sono provvisori solo 1 (E) è definitivo
esistono 2 transaminasi specifiche
GLUTAMMICO PIRUVICO TRANSAMINASI (GPT)
GLUTAMMICO OSSALACETICO TRANSAMINASI (GOT)
che ritrasferiscono NH2 (reazione a 2 tempi con PALP-NH2) sull’accettore definitivo
mentre si liberano PA e OAA.
Prof. G. Gilardi - Biological Chemistry
9
LESIONI DA CARENZA DI vitB6.
§
§
§
§
§
Interazioni che si hanno a livello del metabolismo degli aa.
Viene bloccato il metabolismo delle libere trasformazioni degli aa e
così la rigenerazione di aa non essenziali con effetti sulla biosintesi
proteica.
Il tessuto più colpito è quello emopoietico (midollo osseo).
Anemia con comparsa di forme immature o citologicamente
imperfette (megaloblasti, microciti).
Danni generali su tutti gli organi per la carenza generale di aa.
Prof. G. Gilardi - Biological Chemistry
10
Transferasi con coenzima
derivato dalla vit. B8
§
§
§
§
§
§
H2N
Coenzimi derivati della vit B8 (Pterina)
Nelle cellule vegetali e nei procarioti la pterina può ancora essere trasformata.
Il Me-E dà interazioni dativa con l’OH del sostituente in 6 più prossimo alla
sostituzione.
Quando l’interazione diventa covalente si ha sottrazione dell’OH.
Sul C resta un catione, si ha riaggiustamento con trasposizione di H dal C adiacente.
Struttura chetonica
2
N
3
H
N
N
1
8
4
O
N
5
Me-enzima
7
6
H2N
OH
C
H
OH
C CH3
H
2
N
3
H
N
N
1
8
4
N
O
H2N
7
6
5
Prof. G. Gilardi - Biological Chemistry
+
C
H
OH
C CH3
H
2
N
3
H
N
N
1
8
4
O
N
5
7
6
O
CH2 C
CH3
11
Formazione dell’acido pteroico
§
§
§
H2N
2
N
3
Un secondo Me-E attacca il C=O (ha nel sito attivo anche un SH)
Il C carbonilico diventa C carbossilico poiché aumenta il numero di ossidazione.
Le interazioni, prima dative e poi covalenti, causano la formazione di un
radicale metilenico che dà sostituzione radicalica sul cosubstrato ospitato nel
sito attivo, l’acido p-aminobenzoico (PABA).
H
N
N
1
8
4
O
N
Me-enzima-SH
7
6
5
H2N
O
CH2 C
2
N
CH3
3
N
1
8
4
O
H2N
2
N
3
N
5
7
O
6
C
CH2•
+
CH3
COOH
H2N
H
N
N
1
8
4
N
O
Me-enzima-SH
H
N
5
PABA
7
6
CH2
9
NH
O
COOH
10
+
Me-enzima-S- C
CH3
Sottrazione dell’acetile
Acido pteroico
Prof. G. Gilardi - Biological Chemistry
12
Destino dell’acetile
§
§
§
§
§
§
Nel sito attivo è rimasto un acetile.
Impiego del CoA: questo E è in grado di legarsi probabilmente con il CoA
che non trasporta (ha una bassa K di dissociazione: CoE libero) il CoA si
associa reversibilmente all’E. il Me opera di nuovo la destabilizzazione a
livello del C carbossilico.
Il Me opera ancora la destabilizzazione dei legami a livello dell’O del
carbonio carbossilico.
Interazione legame C-S e l’acetile cationico viene trasferito sul CoA e si ha
l’acetilCoA.
Mentre il CoE libero aveva una costante di dissociazione bassa per l’enzima,
ora questo fattore aumenta (di ~106 v) e l’acetilCoA dissocia e può legarsi
ad altre apoproteine dove l’acile possa essere modificato.
Durante la produzione della vit abbiamo acetilCoA come sottoprodotto.
Prof. G. Gilardi - Biological Chemistry
13
Formazione dell’acido folico
§
§
§
H2N
2
N
3
L’acido pteroico è la molecola di base e può essere trasferita su una catena
poliglutammica con residui glutammici da 3 a 12.
Tramite coniugazione con metallo proteine il carbonio carbossilico, dopo la
sottrazione dell’ossidrile diventa struttura cationica e può ricevere
attacco nucleofilo dall’N terminale della catena poliglutammica.
In questo modo si sintetizza F (acido folico), un’altra delle vit B8.
H
N
N
1
8
4
N
6
CH2
5
O
H2N
7
COOH
NH
10
9
Me-enzima
2
N
3
N
1
8
C
7
H2N
O
4
O
C
O
H
N
N
5
6
CH2
9
NH
C
+
10
COOH
O
NH
CH
CH2
CH 2
CH2
CH 2
H 2C
CH
NH
HOOC
CH2
H 2C
COOH
1-10
COOH
Prof. G. Gilardi - Biological Chemistry
14
Acidi folici
§
§
§
§
Differenze a seconda del numero di residui glutammici.
Base per i CoE transferasici.
Per le cellule che lo producono la forma F è di riserva per la vit B8 (per
quelli che ne sono eterotrofi è mezzo di assunzione).
La vit è conosciuta con la sigla F (acido folico), tanti acidi folici diversi per il
numero di residui glutammici.
H2N
2
H
N
1
N
8
3
7
6
4
N
5
O
C
O
C
O
N
COOH
O
CH 2
9
NH
C
10
NH
CH
CH 2
CH 2
CH 2
CH 2
H 2C
COOH
Prof. G. Gilardi - Biological Chemistry
NH
NH
CH
CH 2
H2C
COOH
HOOC
1-10
15
Formazione del coenzima
§
§
Il passaggio attraverso CoE avviene tramite diversi sistemi
enzimatici:
1) CARBOSSIPEPTIDASI: riconoscono il C terminale della
catena poliglutammica e agiscono scindendo i legami peptidici
della catena poliglutammica accorciandola. L’effetto dell’E si
arresta quando non ci sono più legami e si arriva al
PTEROILMONOGLUTAMMATO, acido folico ad 1 solo residuo.
H2N
2
H
N
1
N
8
7
COOH
O
N
3
6
4
N
5
O
CH 2
9
C
NH
10
NH
CH2
CH2
H2C
COOH
Prof. G. Gilardi - Biological Chemistry
16
Formazione del coenzima: FH4
§
§
§
§
§
§
H2N
2
H
N
1
Secondo tipo di E che agiscono su questo pteroilmonoglutammato sono:
2) OSSIDOREDUTTASI: (catene con CoE piridinici e flavinici).
Le prime riduzioni riguardano:le posizioni 5 ed 8 e si ottiene un DERIVATO
DIIDROFOLICO.
Le seconde riduzioni riguardano le posizioni 6 e 7 e si ottiene un DERIVATO
TETRAIDROFOLICO.
F → FH2 → FH4
Le 2 riduzioni riguardano entrambe il nucleo piperazinico.
H
N
8
H2N
7
O
N
3
6
4
O
N
H
5
CH2
9
NH
10
C
NH
COOH
2
CH2
N
3
CH2
H
N
H
N
H
1
8
7 H
6
4
O
H2C
N
H
H
CH 2
9
5
COOH
O
NH
10
C
NH
CH 2
CH 2
H 2C
COOH
COOH
FH4
FH2
Prof. G. Gilardi - Biological Chemistry
17
Struttura del coenzima FH4
§
§
H2N
Le 2 strutture cicliche (eterociclo e nucleo aromatico) si trovano su
piani paralleli affacciati ed in mezzo ci sono i metalli cofattori; la
molecola infatti non è lineare ma ripiegata attorno al metilene in 9.
METALLI COFATTORI: Mg, Mn bivalente.
2
N
3
H
N
H
N
1
8
H
O
7 H
6
4
O
N
H
H
CH2
9
C
O
NH
C
10
NH
NH
Lys-Enzima
CH2
CH2
5
H2 C
COOH
Prof. G. Gilardi - Biological Chemistry
18
Unione con l’apoproteina
§
§
§
L’unione con l’aproteina si ha tramite il residuo glutammico che si
lega covalentemente con un residuo NH2 (ε terminale di lisina).
In conseguenza del ripiegamento tendono ad essere prossimi nello
spazio gli N in 5 e 10.
Il trasporto di e- dall’eterociclo all’omociclo è mediato da Me
cofattori che ne modifica le costanti di dissociazione.
H2 N
2
N
3
H
N
H
N
1
8
H
O
7 H
C
O
6
4
O
N
H
H
CH2
9
C
NH
10
NH
NH
Lys-Enzima
CH2
CH2
5
H2 C
COOH
Prof. G. Gilardi - Biological Chemistry
19
Gruppi trasferiti
§
§
§
§
§
§
§
§
§
§
Gli N5 e N 10 sono in grado di trasferire unità monocarboniose.
N5 : trasferimento esclusivo dei gruppi
Metilici
-CH3
Formoimminici -CH=NH
Se capitano sull’N10 (N10 ha K di dissociazione diverso da N 5) il CoE
non può più dissociare i gruppi (avvelenamento) ed il CoE resta
bloccato.
I gruppi formilici ( -CHO) possono essere trasferiti da N 5 a N 10
indifferentemente.
I gruppi:
Metilenico –CH2Metinico
-CH=
sono trasferiti con 2 legami su 1 N 5 e 1 N 10 il metilenico e 2 o su N5
o N10 e l’altro sulle altre posizioni per il gruppo metinico.
Prof. G. Gilardi - Biological Chemistry
20
Avvelenamento del coenzima
§
§
Un altro motivo di avvelenamento del CoE è la sostituzione di
1 dei gruppi in 2-4 che sono essenziali per il passaggio nelle
diverse forme (lattamica, semilattamica o lattimica) proprio
per la distribuzione in figura.
Se il sostituente in 2 o 4 si perde si ha perdita dell’attività
del CoE.
H2N
2
N
3
H
N
1
H
N
8
H
O
7 H
6
4
O
N
H
H
CH 2
9
C
O
C
NH
10
NH
NH
Lys-Enzima
CH 2
CH 2
5
H2C
COOH
Prof. G. Gilardi - Biological Chemistry
21
Esempio di catalisi
§
§
§
Esempio:
un aspetto del metabolismo della serina
→ legata alla liasi che ha come CoE la proteina B6 (piridossalfosfato)
attraverso il Me di transizione può essere soggetta all’interruzione del
legame Cα-Cβ.
→ può essere scisso il legame Cα-Cβ, S→G (serina→glicina) e sul Cβ viene
sottratto l’OH.
La struttura CH2OH viene sempre trasferito come gruppo metilenico da
sostituenti in N 5 o N10 .
5, 10 metilentetraidrofolato→ questo intermedio può essere sottoposto a
una trasformazione riduttiva o ossidativa prima del trasferimento.
§
§
§
O
HO
H2N
O
OH
H N
2
NH
2
OH
2
N
3
H
N
H
N
1
8
H
7 H
6
4
O
N
5
H
CH2
9
N
C
10
CH2
serina
glicina
COOH
O
5, 10 metilentetraidrofolato
Prof. G. Gilardi - Biological Chemistry
NH
CH 2
CH 2
H 2C
COOH
22
Trasformazione riduttiva
§
§
§
§
§
§
La distruzione riduttiva può riguardare solo il legame N 10-metilene. (se
riguarda per errore l’altro legame si ha avvelenamento del CoE). Si tratta di
unità monocarboniose quindi l’E ha CoE piridinici.
Alcune usano [ NADP o NAD]. L’effetto finale è la scissione reduttasica del
legame metilene- N10 .
Il metilene diventa metile ed è fissato sulla posizione giusta cioè N5 .
La K di dissociazione consente un facile trasferimento di questo metile su un
accettore.
Per esempio la glicina può venir metilata esaurientemente sull’atomo di N e
abbiamo quei derivati sul tipo delle betaine.
La serina ha ricevuto una unità monocarboniosa, trasferimento nel
metilderivato, facilità di trasferimento su altre strutture.
H2N
2
N
3
H
N
H
N
1
8
COOH
O
6
4
O
NAD+ à NADH + H+
H
7 H
N
5
H
CH2
9
NH
10
CH3
Prof. G. Gilardi - Biological Chemistry
C
NH
CH 2
CH 2
H 2C
COOH
23
Trasformazione ossidativa
§
§
§
§
§
§
H2N
Si può avere anche:
METABOLISMO OSSIDATIVO
In questo caso non importa quale dei 2 legami è soggetto a deidrogenazione (N5 o
N10).
L’enzima che opera l’ossidazione avrà un CoE flavinico ed uno dei 2 legami interessati
viene deidrogenato.
Es. N5 :si crea il doppio legame ed il gruppo metilenico diventa il gruppo metinico.
La struttura col metino è sensibile all’attacco nucleofilo di OH sul C impegnato nel
doppio legame→ si ha la scissione del legame con l’N e la trasformazione dell’unità
monocarboniosa in gruppo formilico (che in questo caso sarà in N 10).
2
N
3
H
N
H
N
1
8
H
7 H
COOH
O
4
O
+ 6
N H
5
OH-
CH2
9
CH
N
10
C
NH
CH 2
CH 2
H 2C
COOH
Prof. G. Gilardi - Biological Chemistry
H 2N
2
H
N
H
N
1
8
H
7 H
COOH
O
N
3
6
4
O
N
H
5
H
CH2
9
HC
O
N
10
C
NH
CH 2
CH 2
H2C
COOH
24
Funzioni metaboliche
§
§
§
Il CHO può poi essere trasferito su accettori.
Per esempio biosintesi basi puriniche→ i formili sono spesso
attaccate.
I CHO derivano dalla serina (che dona un’unità monocarboniosa) e
dai CoE tetraidrofolici che permettono il trasferimento.
Prof. G. Gilardi - Biological Chemistry
25
Carenza da acidi folici
§
§
§
§
§
§
La carenza dà una lesione Sul non trasferimento delle unità
monocarboniose ( biosintesi ac. nucleici→CH3) e basi puriniche (CHO) per la crescita della struttura molecolare.
Le metilazioni sono poi importanti nella sintesi di fosfolipidi
(amminoalcole colamina → colemia)
Lesione biochimica
→ membrane
→ ac.nucleici
La manifestazione macroscopica più evidente è nel midollo
osseo:alterazione delle linee ematopoietiche bianca o rossa.
(maturazione alterata delle cellule: anemie eritrocitiche e
megaloblastiche).
Prof. G. Gilardi - Biological Chemistry
26
Transferasi con CoE vit B12
§
§
§
§
§
§
§
Sempre come CoE di trasferasi per unità monocarboniose ci sono le
strutture delle CORRINE (tetrapirroli ciclici con struttura
modificata derivante dalla vitamina B12).
Durante la biosintesi il C in δ → sostituente metilico legato al primo
pirrolo.
La struttura è complessivamente più satura, l’atomo coordinatore è
il Cobalto ed i metili sono in (1, 3, 5, 5, 7) più α e γ.
Gli altri sostituenti sono:
-H C
C
NH
- acetammide (1, 3, 8)
O
CH C
-H C
NH
- propionammide (2, 4, 6, 7)
O
Co: 1 legame covalente e 3 legami dativi.
2
2
2
Prof. G. Gilardi - Biological Chemistry
2
2
27
Struttura del coenzima
§
§
§
§
§
§
§
§
§
A livello della struttura 4 avremo la propionammide in posizione 7
che serve da aggancio per la seconda parte della molecola.
La seconda parte della molecola contiene:
- propanolo in 2
- nucleotide (riboso fosforilato in 3’ che non è una purina ma un
imidazolo sostituito da un benzene).
Propionammide in 7
Dimetilbenzoimidazolo
Riboso fosforilato in 3’
L’unione tra le 3 parti si ha con un legame C-N che coinvolge l’N della
struttura della propionammide (ammidico) ed il C1 del 2-propanolo.
L’altro legame è un legame fosfodiestereo con l’OH del 2 propanolo
ed il fosforile in 3’.
Prof. G. Gilardi - Biological Chemistry
28
Coordinazione con il metallo
(Cobalto)
§
§
L’N del nucleo imidazolico può dare un legame dativo
con il Cobalto.
Il Cobalto può dare un legame dativo o un legame
covalente dalla parte sopra il piano dell’anello
corrinico con l’O dell’H2O
Prof. G. Gilardi - Biological Chemistry
29
Struttura cobalamide
coenzima
O
H 2N
O
H2 N
CH3
H 3C
O
H 2N
NH2
N
H 3C
O
N H2O N
H3 C
Co
N
+
N
CH3
O
NH2H C
3
H 3C
NH
O
O
P
O
-
HO
H
CH3
CH3
NH2
O
O
N
CH3
O HO N
CH3
H
H
O
H
Prof. G. Gilardi - Biological Chemistry
30