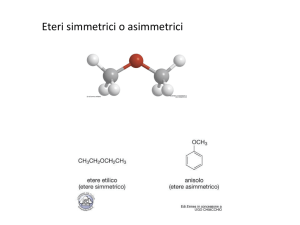
La chimica di eteri, epossidi
e solfuri
L’alogenuro può essere metilico oppure primario
Analisi retrosintetica degli eteri
Disidratazione di alcoli
Ma si potrebbe formare l’alchene????
Le condizioni sperimentali determinano la formazione del prodotto alchene/etere
La formazione dell’etere è favorita da elevate T (è una reazione entropicamente
sfavorita) ed eccesso dell’altro alcol
La formazione dell’alchene è favorita dall’allontanamento dell’ H2O dall’ambiente di
reazione
Addizione di alcoli ad alcheni
Ossidazione degli Alcheni con
Perossiacidi: gli epossidi
In realtà……meccanismo concertato
Prove: reazione con stereospecificità sin
Non si formano carbocationi
Apertura dell’anello in condizioni basiche: pura SN2
Implicazioni stereochimiche
Il Nuc può essere un Grignard
Sempre inversione di configurazione!!!!!!!!!
Apertura dell’anello in condizioni acide
Regiochimica invertita
Se non c’è un carbonio terziario la regioselettività è
meno evidente
Si osserva comunque inversione di configurazione. Non
è una pura SN1
Quando un nucleofilo attacca un epossido non
protonato, avviene una reazione SN2 pura: il
nucleofilo attacca il carbonio meno sostituito
Gli epossidi in sintesi organica
OH
OH
+ enant.
OH
-
OH
+ enant.
HCN
+ enant.
R
OH
RMgCl
O
-
OH
R C C
+ enant.
C
CN
C-R
HX
OH
+ enant.
Stereospecificità: approccio anti. X
Regiospecificità: in ambiente basico l’attacco avviene sempre sul
carbonio meno sostituito (SN2). in ambiente acido ( meccanismo
intermedio SN1/ SN2, attacco sul carbonio più sostituito con
inversione di configurazione
Gli epossidi in sintesi organica
I composti dell’osmio sono molto costosi e tossici.
OsO4 si usa in quantità catalitiche in presenza di
un’ossidante stechimetrico
Stereospecificità sin
I dioli trans si possono ottenere per apertura di epossidi
I dioli si possono ottenere anche per ossidazioni di
doppi legami con KMnO4
Scissione ossidativa di dioli