”I Farmaci Antiinfiammatori non Steroidei
FANS"
I farmaci antiinfiammatori non steroidei comprendono:
± farmaci con proprietà antipiretiche
± farmaci con proprietà analgesiche
± farmaci con proprietà uricosuriche (utili nel trattamento della gotta)
Disturbi di natura infiammatoria trattati con i FANS
• Disturbi reumatici
Forme di artrite ad
eziologia ignota
• Artrite reumatoide
• Spondilite anchilosante
Disfunzioni del tessuto
connettivo
• Lupus eritematoso
sistemico
•Malattia degenerativa
delle giunture
(osteoartrite)
•Forme associate con
anormalità biochimiche o
endocrine (gotta)
Queste malattie rappresentano un insieme di meccanismi di difesa
dell’organismo
Cos’è l’infiammazione ?
E’ una risposta normale ed essenziale dell’organismo a stimoli
nocivi che lo mettono in pericolo.
Può essere di tipo locale o generalizzata
Cos’è l’infiammazione ?
infiammazione
Neutrofili
basofili
mastociti
piastrine
macrofagi
linfociti
Migrazione leucociti
chemiotassi
fagocitosi
Danno tissutale
iniziale
Istamina
serotonina
leucochine
enzimi lisosomiali
prostaglandine
Permeabilità
vascolare
Vasodilatazione
Patogenesi delle malattie
antigene
anticorpo
+
+
Sistema del
complemento
fagocitosi
Rilascio di mediatori
chimici
Sistema del
complemento
Componente delle
difese dell’ospite
che collabora
all’eliminazione dal
sangue e dai tessuti
di vari
microorganismi e
antigeni
Sistema del
complemento
Limitazione attività o inibizione
Interleukina-1
(citochina proinfiammatoria)
Prostaglandine
(PGE2)
Leucotrieni (LTB4)
trombossani
dei prodotti che si formano
Stimolo
Fosfolipidi
Fosfolipasi A2
Acido Arachidonico
Lipoossigenasi
LTA4 12-HETE
LTB4
Cicloossigenasi
Cox-1 e Cox-2
15-HETE
LTC4, LTD4,LTE4
PGH2
PGD2 PGE2 PGF2α PGI2 TXA2
CO 2H
acido arachidonico
dominio cicloossigenasico
CO 2H
H
prostaglandin endoperossido
sintasi
O
(COX)
CH3
O
H
OO H
CO 2H
PGG2
dominio idroperossidasico
CO 2H
CO 2H
trombossano A
sintasi
O
CH3
O
CH 3
O
H
TXA2
prostaglandin F
sintasi
CH3
HO
OH
PGF2
O
H
CH3
HO
OH
OH
PGH2
PGI2
prostaglandin E
sintasi
CO 2H
OH
prostaglandin I
sintasi
H
O
OH
H
prostaglandin D
sintasi
CO 2H
O
CH3
HO
OH
PGE2
CO 2H
OH
CH3
O
OH
PGD2
Nomenclatura prostaglandine
O
O
O
O
HO
O
HO
HO
HO
HO
O
PGA
PGB
PGC
PGD
PGE
9
◊ Struttura generale delle
Prostaglandine
CO2H
O
PGE2
7
6
14
11
12
13
CH3
PGFα
PGFα
5
3
4
16
OH
2
CO2H
18
15
CO2H
OH
HO
OH
8
PGE
10
CH3
HO
HO
HO
17
20
19
CO2H
OH
CH3
O
OH
OH
PGF2α
PGD2
Ruolo delle prostaglandine
PGD2
PGE2
vasodilatazione, inibizione dell’aggregazione piastrinica,
rilassamento muscolatura gastrointestinale e uterina, rilascio
di ormoni ipotalamici
Vasodilatazione, determina contrazione e rilassamento
della muscolatura liscia gastrointestinale e bronchiale
Inibizione del rilascio di secrezione acida a livello gastrico,
aumento del rilascio di muco a livello gastrico
PGI2
PGF2α
potente vasodilatatore e presenta un sinergismo d’azione
con altri vasodilatatori come l’istamina e la bradichinina;
provoca broncocostrizione e e contrazioni del miometrio.
Stimolo
costicosteroidi
Fosfolipidi
FANS
Fosfolipasi A2
Acido Arachidonico
Lipoossigenasi
LTA4 12-HETE
LTB4
Cicloossigenasi
Cox-1 e Cox-2
15-HETE
LTC4, LTD4,LTE4
PGH2
PGD2 PGE2 PGF2α PGI2 TXA2
Acido Arachidonico
Cox-1
FANS Cox-2
SELETTIVI
Cox-2
costitutiva
inducibile o costitutiva
FANS classici
Omeostasi fisiologica
•Stomaco e intestino
•rene
•piastrine
Infiammazione
COX-1
COX-2
Sito attivo della COX-1 proveniente dai
Sito attivo della COX-2 proveniente dai
raggiX del complesso con il flurbiprofene
raggiX del complesso con SC-558
Tyr385
Tyr385
Phe518
Phe518
Ser530
Ile 523
Ser530
Val 523
His 513
Arg120
His 90
Arg 513
Arg120
His 90
I farmaci antiinfiammatori non steroidei comprendono:
± farmaci con proprietà antipiretiche
± farmaci con proprietà analgesiche
± farmaci con proprietà uricosuriche (utili nel
trattamento della gotta)
Analgesici antipiretici: aniline e p-amminofenoli
Agenti con azione antipiretica e analgesica, ma NON
antiinfiammatoria
Meccanismo d’azione:
Azione antipiretica dovuta all’attività sul centro termoregolatorio
ipotalamico ma anche ad una azione periferica
Cellule
attivate
stimolo
-
Antipiretici
Pirogeni leucocitici
endogeni
-
Analgesici antipiretici: aniline e p-amminofenoli
NHCOCH3
acetanilide
NHCOCH3
NHCOCH3
OC2H5
OH
fenacetina
paracetamolo
Meccanismo d’azione del paracetamolo:
Effetti antipiretici dovuti all’inibizione dei pirogeni endogeni sui
centri termoregolatori ipotalamici
Usi:
Utilizzato come antipiretico e analgesico, in pazienti con
ipersensibilità all’aspirina
Stabile in soluzione (uso pediatrico)
Analgesici antipiretici: aniline e p-amminofenoli
NHCOCH3
acetanilide
NHCOCH3
NHCOCH3
OC2H5
OH
fenacetina
paracetamolo
Fenacetina:
Ritirata dal commercio a causa della sua nefrotossicità
Analgesici antipiretici: aniline e p-amminofenoli
NHCOCH3
acetanilide
NHCOCH3
NHCOCH3
OC2H5
OH
fenacetina
paracetamolo
Relazioni struttura-attività
Amminofenoli risultano meno tossici delle corrispondenti
aniline (acetanilide)
Eterificazione del gruppo fenolico con gruppi metilici o
propilici dà derivati con effetti collaterali più gravi rispetto al
derivato etilico
Sostituenti sull’atomo di azoto che ne riducono la basicità
riducono anche l’attività (eccezione acetile)
Analgesici antipiretici: aniline e p-amminofenoli
metabolismo
Solfato
NHCOCH3
acetanilide
Glucuronide
NHCOCH3
NHCOCH3
NH2
OH
OC2H5
OC2H5
paracetamolo
fenacetina
NH2
HO NCOCH3
Metemoglobinemia
anemia emolitica
HO NCOCH3
OH
OC2H5
Epatotossico
Epatotossico
Metemoglobinemia
anemia emolitica
Analgesici antipiretici: aniline e p-amminofenoli
metabolismo
HO NCOCH3
Epatotossico
OH
NCOCH3
NHCOCH3
S
OH
N-acetilcisteina
Proteine epatiche
O
N-acetilimmidochinone
COOH
NHCOCH3
glutatione
NHCOCH3
OH
proteine
epatiche
NHCOCH3
Escrezione renale come
coniugato con acido
mercapturico o cisteina
glutatione
OH
Necrosi epatica
blocco renale
Analgesici antipiretici: aniline e p-amminofenoli
Sintesi del paracetamolo
NO2
NHCOCH3
NH2
Fe/H+
Ac2O
AcOH anidro
OH
OH
OH
paracetamolo
Agenti antiinfiammatori: i salicilati
COOH
COOH
OCOCH3
OH
Ac. Salicilico
CONH2
Ac. Acetilsalicilico
(Aspirina)
COO- X+
OH
salicilammide
F
OH
COOH
F
salicilati di colina,
lisina, metalli alcalini e
alcalino-terrosi
OH
Diflunisal
(Dolobid)
Hanno proprietà antipiretica, analgesica ed antiinfiammatoria
Agenti antiinfiammatori: i salicilati
Altre patologie trattate con i salicilati
GOTTA
ATTACCHI CARDIACI
E ICTUS
Stimolano escrezione di
acido urico
Inibiscono l’aggregazione
piastrinica
(aspirina)
Effetti collaterali
Disturbi al sistema gastrointestinale: ¾ dispepsia
¾ emorragia gastroduodenale
¾ ulcera gastrica
Agenti antiinfiammatori: i salicilati
Meccanismi d’azione dei salicilati:
Inibizione biosintesi istamina
Antagonismo con l’azione
di varie chinine
Inibizione mucopolisaccaridi
Inibizione della cicloossigenasi
Inibizione biosintesi
prostaglandine
Agenti antiinfiammatori: i salicilati
Meccanismo d’azione dell’aspirina:
COOH
H
+
O
Me
N
HO
O
O
Ser530 COX-1
Ser516 COX-2
Aspirina
COOH
OH
H
N
O
Me
O
O
Inibizione irreversibile della cicloossigenasi
Agenti antiinfiammatori: i salicilati
Relazioni struttura-attività:
COOH
COOH
Ac. Salicilico
OH
OCOCH3
OH
Porzione attiva è
costituita dall’anione
salicilato
CONH2
Ac. Acetilsalicilico
(Aspirina)
COO- X+
salicilammide
F
OH
Effetti collaterali aspirina
sono associati alla funzione
carbossilica acida
COOH
F
salicilati di colina,
lisina, metalli alcalini e
alcalino-terrosi
OH
Diflunisal
(Dolobid)
Agenti antiinfiammatori: i salicilati
Relazioni struttura-attività:
COOH
COOH
Ac. Salicilico
OH
OCOCH3
OH
Porzione attiva è
costituita dall’anione
salicilato
CONH2
Ac. Acetilsalicilico
(Aspirina)
salicilammide
F
COO- X+
OH
Effetti collaterali aspirina
sono associati alla funzione
carbossilica acida
COOH
F
salicilati di colina,
lisina, metalli alcalini e
alcalino-terrosi
OH
Diflunisal
(Dolobid)
azione analgesica
Riduzione acidità
azione antiinfiammatoria
Agenti antiinfiammatori: i salicilati
Relazioni struttura-attività:
COOH
COOH
OH
OCOCH3
OH
Ac. Salicilico
CONH2
Ac. Acetilsalicilico
(Aspirina)
COO- X+
salicilammide
F
OH
COOH
F
salicilati di colina,
lisina, metalli alcalini e
alcalino-terrosi
La sostituzione di uno degli
ossidrili (carbossilico o fenolico)
OH
Diflunisal
(Dolobid)
Influenza l’attività e
la tossicità
Agenti antiinfiammatori: i salicilati
Relazioni struttura-attività:
COOH
COOH
OH
OCOCH3
OH
Ac. Salicilico
CONH2
Ac. Acetilsalicilico
(Aspirina)
COO- X+
salicilammide
F
OH
COOH
F
salicilati di colina,
lisina, metalli alcalini e
alcalino-terrosi
Ossidrile fenolico in meta
o para
OH
Diflunisal
(Dolobid)
Perdita attività
Agenti antiinfiammatori: i salicilati
Relazioni struttura-attività:
COOH
COOH
OH
X
Ac. Salicilico
CONH2
X
X
Ac. Acetilsalicilico
(Aspirina)
COO- X+
salicilammide
F
X
OH
X
salicilati di colina,
lisina, metalli alcalini e
alcalino-terrosi
Inserimento di alogeni
OH
OCOCH3
F
COOH
OH
Diflunisal
(Dolobid)
Potenza e tossicità
Agenti antiinfiammatori: i salicilati
Relazioni struttura-attività:
COOH
COOH
OH
OCOCH3
OH
Ac. Salicilico
CONH2
Ac. Acetilsalicilico
(Aspirina)
COO- X+
salicilammide
F
OH
COOH
F
salicilati di colina,
lisina, metalli alcalini e
alcalino-terrosi
Sostituzione con anello
aromatico in posizione 5
OH
Diflunisal
(Dolobid)
Attività antiinfiammatoria
Agenti antiinfiammatori: i salicilati
Sintesi dell’acido salicilico e acetilsalicilico
-
+
O Na
OH
CO2 4-7atm
OH
-
+
COO Na
COOH
H+
130°C
Ac2O
AcOH anidro
H2SO4 (cat.)
OAc
COOH
Acido acetilsalicilico
Agenti antiinfiammatori: i salicilati
Assorbimento dei derivati dell’acido salicilico
velocità di assorbimento e biodisponibilità
² pH gastrico
² contenuto dello stomaco
² tempo di svuotamento gastrico
² presenza di sostanze tamponanti antiacidi
Agenti antiinfiammatori: i salicilati
Metabolismo dei derivati dell’acido salicilico
O
Glu
OH
CO2H
O
CO 2
UDP-glucuronil
transferasi
O
OH
CH3
CO 2
Glu
UDP-glucuronil
transferasi
Glicina N-acil
transferasi
OH
CO2H
Gly
OH
-
COOH
+
COO M
Aspirina
Sali dell'acido
salicilico
OH
CO2R
OH
OH
CO2H
HO
OH
CO2H
CO2H
HO
Esteri dell'acido
salicilico
OH
Ac. gentisico
OH
Agenti antiinfiammatori: i salicilati
Effetti collaterali dei derivati dell’acido salicilico
disturbi gastrointestinali
² nausea vomito
² disturbi epigastrici
² dosi elevate di aspirina
² aggravamento dei
sintomi dell’ulcera
² ulcerazioni gastriche,
emorragie gastrointestinali
Agenti antiinfiammatori: i salicilati
Preparazioni disponibili
COOH
OCOCH3
No soluzioni acquose (instabili)
Compresse, supposte, capsule
Ac. Acetilsalicilico
(Aspirina)
CONH2
Soluzioni stabili a pH 9
OH
< irritazione gastrica rispetto all’aspirina
salicilammide
Agenti antiinfiammatori: i salicilati
Preparazioni disponibili
COO- X+
Soluzioni acquose stabili
OH
salicilati di colina,
lisina, metalli alcalini e
alcalino-terrosi
Usati per ridurre incidenza dei
disturbi g.i.
Agenti antiinfiammatori: i salicilati
F
COOH
F
OH
•Analgesico nel trattamento osteoartrite
•
potenza rispetto all’aspirina
Diflunisal
(Dolobid)
Meccanismo d’azione del diflunisal:
Inibizione biosintesi prostaglandine
Inibizione di tipo competitivo e reversibile
Agenti antiinfiammatori: 3,5-pirazolidindioni
CH3
O
N
N
CH3
CH3(CH2)3
O
O
N
N
CH3(CH2)3
O
O
N
N
OH
antipirina
fenilbutazone
ossifenbutazone
Attività analgesica, antipiretica e antiinfiammatoria
simili all’aspirina
Agranulocitosi
Agenti antiinfiammatori: 3,5-pirazolidindioni
CH3
O
N
N
CH3(CH2)3
CH3
O
O
N
N
CH3(CH2)3
O
O
N
N
OH
antipirina
fenilbutazone
Antiinfiammatorio, analgesico e
uricosurico
ritenzione di Na+
portare ad edemi
che può
ossifenbutazone
Agenti antiinfiammatori: 3,5-pirazolidindioni
CH3
O
N
N
CH3(CH2)3
CH3
O
O
N
N
CH3(CH2)3
O
O
N
N
OH
antipirina
fenilbutazone
Antiinfiammatorio, analgesico e
uricosurico
ritenzione di Na+
portare ad edemi
che può
minore irritazione gastrointestinale
ossifenbutazone
Agenti antiinfiammatori: 3,5-pirazolidindioni
CH3
O
N
N
CH3
CH3(CH2)3
O
O
N
CH3(CH2)3
N
O
O
N
N
OH
antipirina
fenilbutazone
ossifenbutazone
Attività farmacologiche e biochimiche
• Hanno la capacità di disaccoppiare la fosforilazione ossidativa
• Stabilizzano le membrane lisosomiali
• Inibiscono la sintesi di mucopolisaccaridi
• Inibiscono la biosintesi di prostaglandine
Agenti antiinfiammatori: 3,5-pirazolidindioni
Sintesi del fenilbutazone
O
COOEt
COOEt
+
EtONa
HN
HN
O
N
N
∆
idrazobenzene
CHO
n-C4H9Br
OH-
O
O
N
O
N
fenilbutazone
H2 / Ni Raney
O
N
N
Agenti antiinfiammatori: 3,5-pirazolidindioni
Relazioni struttura attività
La funzione dicarbossilica in posizione 3 e 5 incrementa
l’acidità del protone in posizione 4.
H
O
O
R
R
O
N
N
H
H
O
N
N
O-
R
H
+
H+
O
H
N
N
H
H
dell’acidità
attività antiinfiammatoria.
dell’acidità
attività antiinfiammatoria.
ritensione di Na+
Agenti antiinfiammatori: 3,5-pirazolidindioni
Relazioni struttura attività
La funzione dicarbossilica in posizione 3 e 5 incrementa
l’acidità del protone in posizione 4.
L’introduzione di sostituenti polari sull’alchile in posizione 4
influenza l’attività.
O
OH
O
O
O
N
N
γ-idrossifenilbutazone
attività
antiinfiammatoria
effetti uricosurici
O
N
N
γ-chetofenilbutazone
(ketobutazone)
antiifiammatorio
Agenti antiinfiammatori: 3,5-pirazolidindioni
Relazioni struttura attività
La funzione dicarbossilica in posizione 3 e 5 incrementa
l’acidità del protone in posizione 4.
L’introduzione di sostituenti polari sull’alchile in posizione 4
influenza l’attività.
Derivati più attivi sono quelli con due fenili su entrambi gli
atomi di azoto.
R
O
O
N
N
Altri sostituenti:
pirrolo,
isossazolo
Composti
attivi
ciclopentani,
ciclopenteni
Composti
non attivi
Agenti antiinfiammatori: 3,5-pirazolidindioni
Metabolismo del fenilbutazone
O
O
N
O
Glu
N
O
N
N
OH
O
ossifenbutazone
O
N
N
OH
O
fenilbutazone
O
O
O
N
N
O
N
N
Glu
γ-idrossifenilbutazone
Agenti antiinfiammatori: 3,5-pirazolidindioni
Metabolismo del fenilbutazone
OH
O
OH
O
O
Glu
O
N
N
N
N
OH
OH
O
O
N
N
O
O
γ-idrossifenilbutazone
O
N
N
antiinfiammatorio
γ-chetofenilbutazone
(ketobutazone)
Agenti antiinfiammatori: 3,5-pirazolidindioni
Preparazioni disponibili
O
O
N
N
O
O
N
N
OH
fenilbutazone
ossifenbutazone
Trattamento artrite reumatoide, artrite
gottosa e malattie degenerative delle ossa.
Raccomandata l’assunzione con cibo e latte
E’ disponibile in compresse
Acidi arilalcanoici
R
OH
Ar
Ar = arile o eteroarile
O
R = CH3, H o alchile
Tutti i composti hanno un centro di acidità (COOH, acido idrossammico,
solfonammide...
Allungamento della catena tra porzione acida e anello aromatico
attività antiinfiammatoria
Acidi arilalcanoici
R
OH
Ar
Ar = arile o eteroarile
O
R = CH3, H o alchile
L’introduzione di un metile in α al carbossile genera un centro chirale
enantiomero S-(+)
responsabile dell’attività
antiinfiammatoria
Acidi arilalcanoici
COOH
COOH
F
H3CO
CH3
CH3
N
H
O
Cl
Indometacina (indocin)
H3C
S
O
Sulindac (clinoril)
Acidi arilalcanoici
CH3
COOH
CH3
H3C
Ibuprofene (motrin)
O
CH3
CH3
COOH
COOH
H3CO
CH3
chetoprofene (orudis)
COOH
F
flurbiprofene (ansaid, Oufen)
naprossene (Naprosyn
Acidi arilalcanoici
COOH
NH
Cl
Cl
O
O
N
H
COOH
Diclofenac
(Voltaren)
CH3
H3CO
CH3
H3C
Etodolac
(Lodine)
Nabumetone
(Relafen)
O
N
COOH
Ketorolac
(Toradol)
Acidi arilalcanoici
COOH
COONa
NH
NH
CH3
CH3
Acido mefenamico
(Ponstel)
Cl
Cl
CH3
Meclofenamato sodico
(Meclomen)
Acidi arilalcanoici
COOH
H3CO
CH3
N
O
Cl
Indometacina (Indocin)
Antipiretico più potente di aspirina e
paracetamolo
Analgesico circa 10 volte più potente
dell’aspirina
Acidi arilalcanoici
COOH
Relazioni struttura-attività
H3CO
CH3
N
O
Sostituzione del carbossile con altre
funzioni acide
Cl
Indometacina (Indocin)
attività
L’efficacia può essere modulata: > acidità
> attività
Acidi arilalcanoici
COOH
Relazioni struttura-attività
H3CO
CH3
N
O
Acilazione azoto indolico con acidi
alifatici o aralchilici
Cl
Indometacina (Indocin)
Derivati ammidici meno attivi di quelli
benzoilici
Acidi arilalcanoici
COOH
Relazioni struttura-attività
H3CO
CH3
N
O
Sostituenti in posizione 5 dell’indolo
Cl
Indometacina (Indocin)
Attività
Acidi arilalcanoici
COOH
Relazioni struttura-attività
H3CO
CH3
N
O
Cl
Azoto indolico non è strettamente
necessario per l’attività
Analoghi 1-benzilidendienici sono attivi
Indometacina (Indocin)
COOH
F
CH3
(Sulindac)
H3C
H
S
O
Acidi arilalcanoici
COOH
Relazioni struttura-attività
H3CO
CH3
N
O
Sostituenti alchilici in posizione 2
Cl
Indometacina (Indocin)
Derivati più attivi rispetto a quelli sostituiti
con un arile
Acidi arilalcanoici
COOH
Relazioni struttura-attività
H3CO
CH3
N
O
La presenza di un metile in posizione
α dell’acido acetico genera una
chiralità
Cl
Indometacina (Indocin)
Solo la molecola di configurazione S(+)
risulta responsabile dell’attività
Acidi arilalcanoici
Relazioni struttura-attività
COOH
H3CO
CH3
N
O
Cl
Indometacina (Indocin)
Conformazione preferita è quella in cui:
il gruppo N-p-clorobenzoilico è lontano
dal metile in posizione 2 (cioè in posizione
cis rispetto al metossifenile del nucleo
indolico)
il gruppo N-p-clorobenzoilico risulta
non coplanare con l’indolo a causa
dell’ingombro sterico tra il metile in 2 e
l’idrogeno in 7.
Acidi arilalcanoici
Meccanismo d’azione
COOH
H3CO
CH3
N
O
L’attività
Cl
antiinfiammatoria, antipiretica
e analgesica dipendono dalla sua capacità di
inibire la sintesi delle prostaglandine
Indometacina (Indocin)
Effetti collaterali
•Disturbi al tratto gastrointestinale
•Disturbi al SNC (vertigini, mal di testa)
•tinnito
Acidi arilalcanoici
COOH
Somministrazione con cibo o latte :
H3CO
CH3
N
Effetti secondari
O
Cl
Indometacina (Indocin)
Indicazioni
Artrite reumatoide
Artrite gottosa
Spondilite anchilosante
Osteoartrite moderata o lieve
Metabolismo e assorbimento dell’indometacina
CO2
Glu
H3CO
CH3
N
O
COOH
H3CO
Cl
COOH
HO
CH3
CH3
N
COOH
HO
CH3
N
O
Cl
Indometacina
N
H
O
Cl
CO2
COOH
HO
H3CO
CH3
N
H
CH3
N
H
Glu
Acidi arilalcanoici
COOH
F
CH3
H
H3C
S
E’ uno dei FANS più utilizzati
E’ un profarmaco che viene convertito in
un metabolita che agisce inibendo la
cicloossigenasi
Analgesico paragonabile all’indometacina
Antipiretico e antiinfiammatorio
potente dell’indometacina
meno
O
Sulindac (clinoril)
La sostituzione del sistema indolico con quello indenico porta a:
minori effetti tossici a livello g.i. e del SNC
il sulindac risulta meno solubile
dell’indometacina
Cristalluria
Acidi arilalcanoici
COOH
Relazioni struttura attività
F
CH3
H
H3C
La minore solubilità del derivato
indenico è stata compensata sostituendo
l’atomo di cloro dell’indometacina con un
solfinile
S
O
Sulindac (clinoril)
L’isomero (Z) è un antiinfiammatorio
molto più energico dell’isomero (E)
Metabolismo e assorbimento del sulindac
COOH
CO2
F
F
CH3
H3C
COOH
F
Glu
S
CH3
H3C
COOH
O
O
F
S
O
O
CH3
CH3
Metabolita attivo
H3C
H3C
S
O
sulindac
S
COOH
F
CO2
F
OH
OH
OH
H3C
S
O
OH
H3C
S
O
Glu
Acidi arilalcanoici
COOH
F
Effetti secondari
CH3
H
H3C
S
O
Sulindac (clinoril)
Irritazione tratto gastrointestinale
Reazioni cutanee
Indicazioni
Da assumere con il cibo
Artrite gottosa
Spondilite anchilosante
Osteoartrite moderata o lieve
Acidi arilalcanoici
E’ uno dei FANS più utilizzati
COOH
NH
Cl
Cl
presenta
caratteristiche strutturali degli
acidi arilalcanoici e degli acidi antranilici
Analgesico
dell’indometacina
6
volte
più
Antipiretico e antiinfiammatorio
potente dell’indometacina
Diclofenac (voltaren)
efficace
Artrite gottosa
Indicazioni: Spondilite anchilosante
Osteoartrite moderata o lieve
più
Acidi arilalcanoici
Meccanismi d’azione
COOH
NH
Cl
Inibizione della cicloossigenasi
Cl
Produzione prostaglandine
Diclofenac (voltaren)
Inibizione del rilascio di ac.
Arachidonico e stimolazione del suo
riassorbimento
Disponibilità di tale acido
Inibizione della via della
lipoossigenasi
Produzione leucotrieni (LTB4)
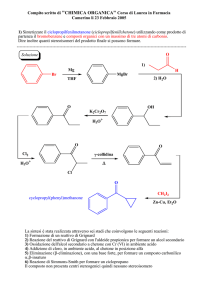
Sintesi del diclofenac
COOH
NH2
COOH
Cl
(Ullmann)
Cl
Cl
NH
Cu, K2CO3
+
Cl
∆
∆
-CO2
Cl
O
O
N
Cl
Cl
N
AlCl3
Cl
Cl
O
Cl
Cl
Cl
NH
Cl
1) NaOH dil,
∆
2) H+
COOH
NH
Cl
Cl
diclofenac
Cl
Acidi arilalcanoici
Relazioni struttura-attività
COOH
I due atomi di cloro in orto forzano l’anello
NH
Cl
Cl
Diclofenac (voltaren)
che li contiene fuori dal piano della porzione
fenilacetica
Effetto di distorsione importante per
l’interazione con il sito attivo della
cicloossigenasi.
Acidi arilalcanoici
Assorbimento e metabolismo
COOH
NH
Cl
Cl
Diclofenac (voltaren)
OH
Solo il 50-60% della dose orale è
biodisponibile a causa di un’estensiva
metabolizzazione epatica.
Il metabolita principale è ossidrilato in
posizione 4 e può contribuire all’attività
biologica complessiva
Il farmaco viene escreto principalmente
come solfato
Acidi arilalcanoici
Rappresenta il prototipo di una nuova
classe di antiinfiammatori: gli acidi
piranocarbossilici
O
N
H
COOH
CH3
H3C
Etodolac (lodine)
Solo l’enantiomero S(+) possiede
proprietà antiinfiammatorie
antiinfiammatorio 50 volte più attivo
dell’aspirina e circa 3 volte più attivo del
sulindac
Presenta una minore incidenza di disturbi gastrointestinali a causa
della maggiore inibizione della biosintesi delle prostaglandine a livello di
sinoviociti e condrociti reumatoidi rispetto alle cellule della mucosa
gastrica
Acidi arilalcanoici
E’ un profarmaco non acido che in
seguito a metabolizzazione dà origine ad
un metabolita principale attivo.
O
CH3
H3CO
Nabumetone (relafen)
Il nabumetone non essendo acido non
produce danno primario significativo
una volta assorbito il farmaco è
metabolizzato
in
acido
6-metossi
fenilnaftalen-2-acetico (6MNA)
Efficace inibitore della sintesi delle
prostaglandine nelle giunture.
Metabolismo e assorbimento del nabumetone
OH
CH3
glucuronide
OH
H3CO
CH3
HO
O
O
CH3
H3CO
CH3
HO
nabumetone
OH
O
H3CO
6MNA
Metabolita attivo
Acidi arilalcanoici
Primo analgesico da banco (moment)
CH3
CH3
COOH
H3C
Ibuprofene (motrin)
E’ in commercio come miscela
racemica, sebbene la sua attività sia
dovuta quasi esclusivamente all’isomero
S(+).
Enantiomero
R(-)
in vivo
Enantiomero
S(+)
Acidi arilalcanoici
Relazioni attività-struttura
CH3
CH3
COOH
L’inserimento di un metile in α al
carbossile di molti acidi arilacetici
H3C
Ibuprofene (motrin)
Attività
antiinfiammatoria
Effetti collaterali
Acidi arilalcanoici
Assorbimento e metabolismo
CH3
CH3
COOH
H3C
Ibuprofene (motrin)
Il farmaco viene escreto quasi
completamente con l’urina, immodificato
o ossidato.
Il metabolismo consiste principalmente
nell’ossidazione della catena laterale pisobutilica
Indicazioni:
Artrite reumatoide
Osteoartrite moderata o lieve
Stati febbrili
Trattamento della dismenorrea
Sintesi ibuprofene
O
CH3
HO CH3
O
CH3
+
H3C
EtONa
Cl
OEt
COOEt
H3C
CH3
CH3
CHO
H3C
O
CH3
1) H+
2) -CO2
H3C
Cl
CH3
COOEt
H3C
1) H+
<O >
2) -CO2
CH3
CH3
COOH
CH3
H3C
H3C
Ibuprofene
OH
CH3
O
O H
Acidi arilalcanoici
Meccanismo d’azione
O
CH3
COOH
Inibizione della biosintesi delle
prostaglandine
Inibizione
leucotrieni
chetoprofene (orudis)
della
sintesi
dei
Inibizione della migrazione dei
leucociti nelle giunture infiammate
Stabilizza le membrane lisosomiali
durante l’infiammazione limitando la
distruzione dei tessuti.
Antagonizza la bradichinina che attiva i recettori
periferici del dolore
Acidi arilalcanoici
Ha attività antiinfiammatoria,
antipiretica e analgesica
O
CH3
Metabolismo e assorbimento
COOH
chetoprofene (orudis)
Può coniugarsi
glucuronico
con
acido
Può
subire
idrossilazione
dell’anello benzoilico
Il gruppo chetonico può ridursi
Artrite reumatoide
Indicazioni: Osteoartrite moderata o lieve
Trattamento della dismenorrea
Acidi arilalcanoici
Meccanismo d’azione
CH3
COOH
Inibisce la biosintesi delle
prostaglandine
E’ circa 12 volte più attivo
dell’aspirina
L’isomero
H3CO
naprossene (Naprosyn)
attivo è l’S(+); è
l’unico FANS arialcanoico ad
essere
in
commercio
come
enantiomero puro.
Artrite reumatoide
Indicazioni: Osteoartrite
Trattamento della dismenorrea
acuta o lieve
Spondilite anchilosante
Acidi arilalcanoici
Relazioni struttura-attività
CH3
COOH
I derivati 2 naftopropionici sono più
potenti dei corrispondenti analoghi acetici
Sostituzione in
posizione 6
Attività massima
Piccoli gruppi
lipofili (Cl, MeS, )
Composti attivi
H3CO
naprossene (Naprosyn)
gruppi di dimensioni
maggiori
Attività
Acidi arilalcanoici
Assorbimento e metabolismo
CH3
COOH
circa il 70% è eliminato come farmaco
immodificato o suoi coniugati
può essere trasformato in derivato 6desmetilato
H3CO
naprossene (Naprosyn)
I metaboliti
antiinfiammatoria
non
hanno
attività
Acidi arilalcanoici
Primo FANS topico ad uso oculare
(Ocufen)
CH3
COOH
F
Flurbiprofen (ansaid)
Inibizione
Inibizione della
della miosi
miosi operatoria
operatoria indotta
indotta dalle
dalle
PGs
PGs nell’asportazione
nell’asportazione chirurgica
chirurgica della
della
cataratta.
cataratta.
Più attivo dell’aspirina e del fenilbutazone
E’ antiinfiammatorio, antipiretico e antinocicettivo
Acidi arilalcanoici
Assorbimento e metabolismo
CH3
COOH
F
Flurbiprofen (ansaid)
Il 60-70% del farmaco viene escreto
sottoforma di solfato e di glucuronide
²
può subire idrossilazione in posizione 4’ o
nelle posizioni 3’ e 4’
²
²Tutti i metaboliti che si formano risultano
inattivi
artrite reumatoide
Indicazioni:
osteoartrite
Miosi operatoria
Acidi arilalcanoici
²Derivato eteroarilpropionico ciclizzato
E’ indicato solo come analgesico
periferico per brevi trattamenti
²
O
N
COOH
²Possiede attività
e antipiretica
antiinfiammatoria
ketorolac (toradol)
Attività analgesica:
Paragonabile a quella degli analgesici ad
azione centrale
(analgesia equivalente a 12mg di
morfina)
Acidi arilalcanoici
O
N
COOH
Meccanismo d’azione:
delle PGs
ketorolac (toradol)
a p-idrossi derivato e a
glucuronidi
escreti
prevalentemente
tramite le urine
²Metabolizzato
inibisce la sintesi
Acidi N-arilantranilici
Bioisosteri azotati dell’acido salicilico
COOH
COONa
NH
NH
CH3
CH3
Acido mefenamico
(Ponstel)
Cl
Cl
CH3
Meclofenamato sodico
(Meclomen)
Meccanismo d’azione: inibiscono la biosintesi delle PGs
Acidi N-arilantranilici
Relazioni struttura attività
COOH
COONa
NH
NH
CH3
Cl
CH3
Acido mefenamico
(Ponstel)
Cl
CH3
Meclofenamato sodico
(Meclomen)
disostituzione in 2’ e 3’ con gruppi uguali
Attività
Acidi N-arilantranilici
Relazioni struttura attività
COOH
COONa
NH
NH
CH3
Cl
CH3
Acido mefenamico
(Ponstel)
Cl
CH3
Meclofenamato sodico
(Meclomen)
disostituzione in 2’ e 3’ con gruppi uguali
Attività
derivato 2’-Cl sostituito è più attivo di quello 3’-Cl sostituito
Acidi N-arilantranilici
Relazioni struttura attività
COOH
COONa
NH
NH
CH3
Cl
CH3
Acido mefenamico
(Ponstel)
Cl
CH3
Meclofenamato sodico
(Meclomen)
Sostituenti sull’anello aromatico che forzano
questa parte della molecola a non essere
coplanare con l’altra porzione aromatica
Attività
Acidi N-arilantranilici
Relazioni struttura attività
COOH
COONa
NH
NH
CH3
CH3
Acido mefenamico
(Ponstel)
La sostituzione del gruppo NH con O,
CH2, S, SO, NCH3
Cl
Cl
CH3
Meclofenamato sodico
(Meclomen)
Attività
Acidi N-arilantranilici
Relazioni struttura attività
COOH
COONa
NH
NH
CH3
CH3
Acido mefenamico
(Ponstel)
La posizione della funzione acida è
critica:
Cl
Cl
CH3
Meclofenamato sodico
(Meclomen)
Acidi m- e pamminobenzoici
sono inattivi
Acidi N-arilantranilici
COOH
² Unico farmaco di questa classe a produrre
NH
²
CH3
CH3
analgesia centrale e periferica
Il metabolismo avviene attraverso
l’ossidazione stereoselettiva del CH3 in 3’ e
glucuronidazione dell’acido e dei suoi
metaboliti
Acido mefenamico
(Ponstel)
COOH
Indicazioni:
Dolore moderato
Dismenorrea primaria
Acidi N-arilantranilici
COONa
²Il metabolismo avviene attraverso:
ossidazione del gruppo metilico
NH
HO
Cl
Cl
idrossilazione aromatica
monodealogenazione
CH3
Meclofenamato sodico
(Meclomen)
Indicazioni:
coniugazione
Dolore lieve o moderato
Artrite reumatoide o osteoartrite
Dismenorrea primaria
Oxicam
OH
S
O
N
classe relativamente nuova di derivati 4idrossi-1,2-benzotiazincarbossammidi
²
O
N
H
N
Me
O
Piroxicam (feldene)
Meccanismo
d’azione:
Unico rappresentante di questa classe ad
essere usato in clinica
²
inibisce la migrazione delle cellule
polimorfonucleate nel sito di infiammazione
²
² inibisce il rilascio di enzimi lisosomiali
² impedisce l’aggregazione piastrinica
indotta dal collagene
²
inibitore della cicloossigenasi
Oxicam
Relazioni struttura attività
OH
S
O
pKa compresa tra 4 e 6
le carbossammidi N-eterocicliche
sono più acide delle N-ariliche
N
O
Arile o eteroarile
O
N
H
R
R1
Migliore attività con
un metile
Oxicam
Metabolismo
OH
S
O
N
O
Prodotto
principale
deriva
dall’idrossilazione dell’anello piridinico e
glucuronidazione
²
N
H
N
Me
O
Piroxicam (feldene)
²Nessun
²Si può avere idrossilazione aromatica in
posizioni diverse dell’anello benzotiazinico
metabolita è attivo come antiinfiammatorio
²Il
piroxicam presenta una lunga emivita (sufficiente una
somm.ne giornaliera)
²Impiegato per il trattamento osteoartrite e artrite reumatoide
Farmaci COX-2 selettivi
IL-1
Acido arachidonico
+
COX-1
costitutiva
STOMACO
INTESTINO
RENE
PIASTRINE
COX-2
TNFα
Glucocorticoidi
-
costitutiva inducibile
MACROFAGI
CELLULE ENDOTELIALI
CERVELLO
OVAIE
INFIAMMAZIONE
IL-4
Farmaci COX-2 selettivi
NHSO2Me
NHSO2R
X
O
Cy
NO2
Nimesulide
(aulin)
EWG
Cy = gruppo arilico
eteroaromatico
cicloalifatico
R = alchile
X=OoS
EWG = gruppo
elettronattrattore
Sintesi nimesulide
NO2
-
OK
+
NO2
Br
O
+
O
H3C
O
S
NH
NH2
O
CH3SO 2Cl
HNO3
O
H3C
O
S
NH
O
nimesulide
NO2
H2
Ni/Raney
O
Farmaci COX-2 selettivi
R=SO2Me
R=SO2NH2
SO2Me
O
O S
CH3
F
SO2R
S
SC57666
Br
Dup697
O
O S
H3C
NH2
O
O S
O
O S
N
NH2
N
CF3
celecoxib
O
N
O
CH3
valdecoxib
O
rofecoxib
CH3
Farmaci COX-2 selettivi
O
NHSO2Me
O S
H3C
O
NH2
O S
O
N
NO2
Nimesulide
(aulin)
N
CF3
Celecoxib
(Celebrex)
O
O
Rofecoxib
(Vioxx)
CH3
Sintesi rofecoxib
H3C
O
S
MCPA H3C
O
S
CH3
CH3
O
O
Br2
O
H3C
O
S
OH
+
O
O S
O
Br
CH3
O
base
O
O
Rofecoxib