Traccia T11)Descrivere la tavola periodica LA STORIA DELLA TAVOLA PERIODICA Durante il corso della storia della chimica gli studiosi, a fronte della scoperta di nuovi elementi chimici, decisero di introdurre una notazione simbolica e di assegnare, dunque, ad ogni elemento un simbolo chimico (es. C = Carbonio , H= idrogeno) . Con l’aumentare degli elementi scoperti (1669-­‐
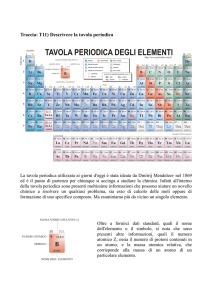
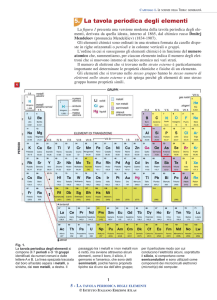
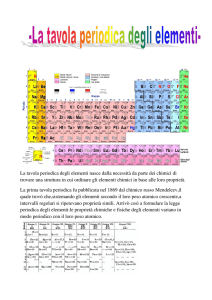
Fosforo, 1737-­‐Cobalto , 1748-­‐Platino , 1751-­‐Nichel , 1766-­‐Idrogeno , 1774-­‐Ossigeno...) gli studiosi iniziarono a raggrupparli seguendo criteri logici. Uno dei primi tentativi svolti fu per mano di Antoine Lavoisier che nel 1789 pubblicò una lista di 33 elementi chimici che raggruppò e divise in gas, metalli, non-­‐metalli e terrosi. Nel 1829, un secolo dopo, il chimico tedesco J. W. DOBEREINER classificò gli elementi che presentavano proprietà simili in gruppi da tre da lui chiamati triadi (Es. Litio, Sodio e Potassio rappresentano una triade). Nel 1865 il chimico inglese J.A. R. NEWLAND sistemò i 62 elementi, all’epoca noti, in otto gruppi in accordo con la loro massa atomica crescente ritenendo, inoltre, che le proprietà fisiche e chimiche simili degli elementi ricorrevano ad intervalli di 8. Questa sua legge, definita “legge delle ottave”, gli permise di stilare una tavola periodica degli elementi e di predire l’esistenza di elementi all’epoca ancora ignoti, come ad esempio il Germanio. (Legge delle ottave) Nel 1870, dopo diversi tentativi da parte di numerosi chimici, il professore di chimica russo Dimitrij Mendeleev ed, indipendentemente, il chimico tedesco Julius Lothar Meyer pubblicarono due versioni di tavole periodiche degli elementi, nelle quali gli elementi erano divisi in righe e colonne in ordine di peso atomico, poiché le proprietà degli elementi si ripetevano ad intervalli regolari quando questi erano ordinati in funzione delle loro masse atomiche crescenti. Fu, però, adottata la tavola di Mendeleev poiché presentava degli spazi vuoti che prevedevano l’esistenza, le proprietà e le masse di elementi ancora ignoti e poiché le colonne erano formate da elementi con le stesse proprietà chimiche. (Prima tavola periodica di Mendeleev) La Tavola periodica moderna La tavola periodica degli elementi vigente è caratterizzata da: 1. Elementi ordinati in funzione del numero atomico crescente; 2. 7 periodi (orizzontali): il periodo indica il livello di energia su cui sono collocati gli elettroni di valenza; 3. 18 gruppi (verticali) che designano l’appartenenza degli elementi ad una determinata famiglia chimica (ES: gli elementi appartenenti all’VIII gruppo sono definiti gas nobili). I 18 gruppi hanno una doppia numerazione: una in numeri arabi (1-­‐18) l’altra in numeri romani (I a VIII), ai quali corrispondono gli elettroni di valenza dell’elemento (nell’VIII gruppo l’He fa eccezione poiché ha due elettroni di valenza), quest’ultima designa gli otto gruppi nei quali gli elettroni riempiono i sottolivelli s e p; 4. La presenza fra il II ed il III gruppo di elementi di transizione nei quali si riempiono i sottolivelli di tipo d; 5. La presenza dei lantanidi e degli attinidi. I primi sono dei metalli fortemente elettropositivi con numero atomico compreso fra 58 e 71 (Cerio, Praseodimio, Neodimio, Promezio, Samario, Europio, Gadolino, Terbio, Disprosio, Olmio, Erbio, Tulio, Iterbio e Lutezio). I secondi hanno generalmente carattere metallico ed un numero atomico compreso fra 90 e 103 (Torio, Proattinio, Uranio, Nettunio, Plutonio, Mercurio, Curio, Berchelio, Californio, Mendelio, Einstenio, Nobelio, Fermio, Laurenzio). SUDDIVISIONE DEGLI ELEMENTI DELLA TAVOLA PERIODICA Gli elementi nella tavola periodica possono essere classificati in: Metalli, Non-­‐metalli e semimetalli. I METALLI I metalli, generalmente, presentano un aspetto lucente e sono buoni conduttori di elettricità e di calore. I metalli (elementi più numerosi) si trovano nella parte sinistra della tavola periodica. Le loro proprietà chimiche dipendono dalla loro tendenza a perdere elettroni, mentre quelle fisiche dipendono dal legame metallico (i metalli perdono gli elettroni di valenza trasformandosi in ioni positivi o cationi). Nomenclatura dei metalli: 1. I metalli del IA sono detti Alcalini: essi sono caratterizzati dalla presenza di un elettrone di valenza nell’orbitale s più esterno; 2. I metalli del IIA sono detti Alcalino-­‐terrosi: in natura, si trovano solo sottoforma di composti. Essi sono caratterizzati da un orbitale s completo (tendono a perdere 2 elettroni formando dei cationi bivalenti). 3. I metalli del IIIA sono detti Terrosi: in natura, non si trovano allo stato elementare a causa della loro reattività (la loro struttura elettronica esterna è s2p e, promuovendo un elettrone dall’orbitale s all’orbitale p, svolgono un’ibridazione sp2). Metalli di transizione I metalli di transizione sono gli elementi che costituiscono i blocchi d ed f della tavola periodica. Essi prevedono il riempimento degli orbitali di tipo d ed f. I Semimetalli I Semimetalli hanno carattere anfotero, dunque possono assumere sia il comportamento dei metalli che quello dei non metalli. Nella tavola periodica sono compresi nella linea immaginaria che unisce il Boro con il Polonio (Boro, Silicio, Germanio, Arsenico, Antimonio, Tellurio e Polonio) I Non Metalli I non-­‐metalli sono situati a destra nella tavola periodica (l’H è un non metallo pur trovandosi nella parte sinistra della tavola periodica). In una reazione chimica tendono ad acquistare elettroni, dunque, a formare ioni negativi. In generale, i non-­‐metalli sono cattivi conduttori di elettricità e calore e presentano un aspetto opaco. Le Proprietà Periodiche Le proprietà periodiche sono quelle proprietà che variano gradualmente nell’ambito di un periodo o di un gruppo e sono: 1. Raggio Atomico; 2. Energia di Ionizzazione; 3. Affinità Elettronica; 4. Elettronegatività; 5. Carattere Metallico. 1) RAGGIO ATOMICO -­‐Il raggio atomico esprime la distanza tra il nucleo e l’elettrone più esterno. -­‐Il raggio atomico lungo un gruppo(procedendo dall’alto verso il basso) aumenta poiché gli elettroni, con l’aumentare del numero quantico principale, si collocano nei livelli più esterni dove risentono in maniera minore l’attrazione del nucleo carico positivamente. -­‐Il raggio atomico lungo un periodo(procedendo da sinistra verso destra) diminuisce poiché con l’aumentare del numero atomico aumentano i protoni (+) nel nucleo e gli elettroni (-­‐) questi ultimi si posizionano nello stesso orbitale e risentono maggiormente l’attrazione del nucleo. (Variazione del raggio atomico nella tavola periodica) 2)Energia di Ionizzazione -­‐L’energia di ionizzazione è l’energia necessaria ad una mole di atomi allo stato gassoso per trasformarla in una mole di cationi monovalenti. L’energia di prima ionizzazione è quella che serve per allontanare l’elettrone più esterno (A+E→A++ e-­‐). -­‐L’energia di ionizzazione lungo un periodo, muovendosi verso destra, aumenta. -­‐L’energia di ionizzazione lungo un gruppo, muovendosi verso il basso, diminuisce. (Variazione dell’energia di ionizzazione nella tavola periodica) 3)Affinità Elettronica -­‐L’affinità elettronica è l’energia liberata da una mole di atomi neutri allo stato gassoso quando si trasforma in una mole di anioni monovalenti (A+e-­‐ → A-­‐ + E). L’affinità elettronica è inversamente proporzionale alle dimensioni del volume atomico. -­‐L’affinità elettronica lungo un gruppo, procedendo dall’alto verso il basso, diminuisce. -­‐L’affinità elettronica lungo un periodo, procedendo da sinistra verso destra, aumenta. (Variazione dell’affinità elettronica nella tavola periodica) 4)L’elettronegatività L’elettronegatività è una grandezza che caratterizza il potere di attrazione di un atomo nei confronti degli elettroni del legame con un altro atomo. Essa dipende dall’energia di ionizzazione e dall’affinità elettronica, per questo, l’elettronegatività diminuisce lungo un gruppo ed aumenta lungo un periodo. I valori dell’elettronegatività sono tabulati nella tavola periodica secondo una scala pensata dal chimico statunitense Pauling, il quale assegnò il valore minimo (0,7) al Francio ed il valore massimo (4) al Fluoro. L’elettronegatività dei gas nobili, a causa della loro configurazione stabile (ottetto o duetto nel caso dell’He), è pari a 0. (Variazione dell’elettronegatività nella tavola periodica) 5)Carattere Metallico I metalli, nelle reazioni chimiche, tendono a perdere elettroni, mentre i non metalli tendono ad acquistarli,per questa ragione: 1. Il carattere metallico muovendosi lungo un periodo,da sinistra verso destra, diminuisce. 2. Il carattere metallico muovendosi lungo un gruppo,dal basso verso l’alto, aumenta (aumenta con l’aumentare della massa atomica).