Prof. Maria Nicola GADALETA
E-mail: [email protected]
Facoltà di Scienze Biotecnologiche
Corso di Laurea in
Biotecnologie Sanitarie e Farmaceutiche
Biochimica e Tecnologie Biochimiche
DISPENSA N. 17
ENZIMI V: Chimotripsina
La chimotripsina
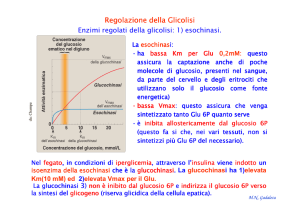
La chimotripsina è una endopeptidasi: catalizza l’idrolisi di legami peptidici
interni di una proteina e, in alcuni casi, catalizza anche legami esterei. Il sito di
legame della chimotripsina accoglie catene laterali aromatiche di AA o grossi
gruppi non polari.
La chimotripsina catalizza una reazione a
due substrati con meccanismo a ping pong.
Maturazione del chimotripsinogeno in α-chimotripsina
Sintetizzato e secreto a
livello del pancreas
Attiva a livello
intestinale
(3 catene polipeptidiche
legate da 2 ponti
disolfuro intercatena)
da: Campbell et al.
M.N. Gadaleta
da: Campbell et al.
Elissoide: 51 x 40 x 40 Ǻ
Poca α-elica
Catena molto distesa con
ponti H
Struttura quasi β
241 AA
3 catene polipeptidiche
3 intracatena
5 ponti SS
2 intercatena
M.N. Gadaleta
Tutti gli AA polari sono all’esterno
tranne quelli con un ruolo
fondamentale nella
catalisi:Ser195,His57,Asp102
La chimotripsina rompe il legame peptidico di una proteina
da: Nelson & Cox
Intermedio covalente
Nel meccanismo d’azione
della chimotripsina si ha una
catalisi covalente aiutata da
una
catalisi
acido-basica
generale.
M.N. Gadaleta
Trasferimento di cariche (relais) nella chimotripsina: triade catalitica
nel sito attivo dell’enzima
Ser195, His57 e Asp102
costituiscono la triade
catalitica.
Mediante acido
iodoacetico è stata
individuata
His57,mentreSer 195
attraverso DIPF
M.N. Gadaleta
da: Voet, Voet & Pratt
Stiramento del substrato:legame del sito attivo più forte con lo stato di transizione
che con S
M.N. Gadaleta
Meccanismo d’azione della chimotripsina: 1^ fase acilazione
1° prodotto di reazione
-
L’atomo di O2 di Ser195 attacca il C carbonilico del legame
peptidico suscettibile. Si forma C-O e l’O di S acquista una
carica negativa netta: intermedio tetraedrico temporaneo
stabilizzato dall’ossianione (O-) e da 2 NH della proteina.
Un H+ passa da Ser195 a His57. La carica di His57 è in parte
neutralizzata da Asp102. Asp102 orienta l’anello imidazolico di
His57. H+ passa al legame peptidico suscettibile che viene
rotto: il componente aminico rimane legato a His57, mentre il
componente acido è esterificato a Ser195. Il componente
aminico si stacca.
Meccanismo d’azione della chimotripsina: 2^ fase deacilazione
2) His57 strappa un protone all’H2O. OH- attacca il C carbonilico del gruppo acilico
legato a Ser195: intermedio tetraedico temporaneo. His57 dona un protone all’O di
Ser195 che libera il componente acido del S.
2° prodotto di
reazione
Evoluzione convergente. Tutte le peptidasi condividono la triade catalitica e la
formazione dell’ossianione. Peptidasi di origine evolutiva diversa convergono
verso questa struttura che è evidentemente ottimale per la catalisi di un
legame peptidico.
Richiede catene laterali
aromatiche nel AA che
fornisce il C-O
Richiede Lys+ o Arg+
nel AA che
fornisce il C-O
Richiede catene laterali piccole
e prive di carica nel AA che
fornisce il C-O
N.B. La conformazione spaziale e di carica
del sito attivo è responsabile della
specificità di substrato.