Prof. Maria Nicola GADALETA
Email: [email protected]
Facoltà di Scienze Biotecnologiche
Corso di Laurea in
Biotecnologie Sanitarie e Farmaceutiche
Biochimica e Biotecnologie Biochimiche
DISPENSA N. 9
MIOGLOBINA ED EMOGLOBINA:
STRUTTURA PRIMARIA ed EVOLUZIONE
MOLECOLE TRASPORTATRICI DI O2
NEGLI ANIMALI:MIOGLOBINA ED EMOGLOBINA
Fig. 7.4
Rappresentazione schematica del
trasporto respiratorio negli animali.
L’ossigeno è trasportato dall’emoglobina dai
polmoni o dalle branchie ai tessuti periferici.
Quì una parte di esso può essere direttamente
utilizzata per il metabolismo.
Un’altra parte può essere immagazzinata
mediante il legame alla mioglobina e resa quindi
disponibile quando la domanda di ossigeno da
parte dei mitocondri dei tessuti periferici è
forte.
La CO2 è rilasciata dai processi ossidativi nei
tessuti e viene trasportata ai polmoni o alle
branchie ed espirata.
da: vH. Mathews
M.N. Gadaleta
Eritrocita = un sacchetto pieno di emoglobina e poche altre molecole;
non contiene nucleo nè mitocondri; non si ha sintesi proteica.
Necessità di vita breve non avendo la capacità di sostituire eventuali
componenti danneggiati.
Eritrocita: t1/2 20 gg
Contenuto di Hb 150 g/lt; Hb occupa
gran parte del volume dell’eritrocita
M.N. Gadaleta
O2, essendo un gas, è poco solubile in soluzione acquosa. La sua
concentrazione in soluzione è proporzionale alla sua pressione parziale.
Sangue arterioso: pO2 = 100 mm Hg (13,3 kPa); [O2] = 0,13 mmol/lt
Sangue arterioso: [Hb] = 150 g/lt;
[O2] = 8,6 mmol/lt
La presenza dell’Hb aumenta di ~ 70 volte la capacità del sangue di
trasportare O2.
O2 permette l’estrazione di energia da 1 molecola di glucosio maggiore
di 15 volte:
Organismi anaerobi: 1 molecola di Glucosio → 2 ATP
Organismi aerobi: 1 molecola di Glucosio → 30 ATP
La maggior disponibilità di energia utilizzabile dalla cellula per
compiere lavoro (ATP) ha permesso l’evoluzione degli organismi
superiori sino all’uomo.
M.N. Gadaleta
MIOGLOBINA ED EMOGLOBINA: proteine coniugate
PROTEINE CONIUGATE: apoproteina + gruppo prostetico
Apoproteina = catena polipeptidica = Globina
Gruppo prostetico → gruppo non proteico → Eme → responsabile del colore
rosso per la presenza di Fe+2
OGNI gruppo EME lega una molecola di O2
M.N. Gadaleta
MIOGLOBINA
Molecola purificata dai muscoli di capodoglio: fonte ricca di questa proteina
(Kendrew, 1950)
153 AA; una sola catena
polipeptidica
75% α-elica:8 segmenti(da A
ad H);7 gomiti
Struttura terziaria:
core idrofobico: solo 4
molecole di H2O
Tasca idrofobica tra i
segmenti E ed F: lega l’EME
Nella tasca idrofobica: solo
2 His = ruolo funzionale;
a contatto con l’ambiente
esterno
da: Stryer
M.N. Gadaleta
La Mioglobina ha un solo sito di legame per l’ossigeno
da: Nelson & Cox
Curva o gomito o ripiegamento
4 proline nella molecola
l’Eme è legato alla globina
da numerosi legami deboli
per lo più idrofobici e dal
legame di coordinamento
con la His prossimale (F8)
M.N. Gadaleta
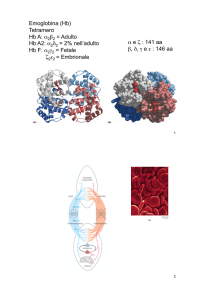
EMOGLOBINA
EMOGLOBINA (Hb)
Struttura tridimensionale studiata ai raggi X (come la Mb)
da Perutz 1936 → 1959
- 4 catene polipeptidiche unite da interazioni non covalenti
Nell’adulto
98% Hb A → α2 β2
2% Hb A2 → α2 δ2
Nell’embrione
Hb E → α2 ε2
Nel feto
Hb F → α2 γ2
ζ2ε2 ζ2γ2
Catena α ζ
141 AA
Catene β δ γ
146 AA molto simili tra loro
M.N. Gadaleta
da: Stryer L.
EMOGLOBINA: proteina polimerica; struttura quaternaria
- Molecola quasi sferica
∅ 50Å; quattro catene
organizzate a
tetraedro, unite da
interazioni non
covalenti
- 4 Gruppi eme posti in
fessure vicine alla
superficie della
molecola
HbA α2 β2
Ogni subunità di Hb è
molto simile alla catena
della mioglobina: la catena
α manca del segmento D.
Lega 4 molecole di O2
- I 4 siti per l’O2 sono
molto distanti fra loro,
la distanza fra i due
atomi di Fe più vicini
è 25Å
M.N. Gadaleta
da: Stryer L.
M.N. Gadaleta
Sono note le sequenze AA delle Hb da più di 60 specie (lampreda → uomo).
Notevoli variabilità per la maggior parte delle posizioni in quasi tutte le specie.
In 9 posizioni però c’è sempre lo stesso AA (residui costanti:costrizioni funzionali)
RESIDUI ESSENZIALI DELLA EMOGLOBINA (costrizioni funzionali)
Posizione
Aminoacido
Ruolo
F8
His
Istidina prossimale, lega Eme
E7
His
Istidina distale, vicina Eme
CD1
Phe
In contatto con Eme*
F4
Leu
In contatto con Eme*
B6
Gly
Permette la stretta vicinanza tra eliche B e E
C2
Pro
Termine dell’elica (gomito della catena polipept.
HC2
Tyr
Lega tra loro eliche H e F
C4
Thr
H10
Lys
Le forti caratteristiche non polari dell’interno si conservano inalterate a causa della sostituzione tra AA
idrofobici. Molto più variabili sono i residui della superficie della molecola.
* Contribuisce a creare l’ambiente idrofobico necessario all’eme ostruendone la tasca idrofobica.
M.N. Gadaleta
Confronto tra la struttura primaria (sequenze AA) della Mb di Capodoglio e le
catene α e β di Hb umana (confronto tra proteine diverse che hanno la stessa
funzione)
Solo 27 AA risultano identici dal confronto delle catene Mb, Hbα
α e Hbβ
β
o identici
ma ~ 40%
o sostit. conservative
(AA con le stesse caratteristiche,
i.e. R idrofobico con R idrofobico)
Le somiglianze sono maggiori tra le catene α e β di Hb che non tra queste e Mb a
causa delle DIVERSE PRESSIONI EVOLUTIVE sul gene della catena mioglobinica
→ monomerica e su quelli delle catene dell’Hb → oligomeri di un tetramero
Nelle catene α e β occorrono sulla superficie di contatto, potenzialità di legame e
interazioni non richiesta nella Mioglobina:
13 residui che nella struttura terziaria occupano posizioni analoghe:
- sono polari perché rivolti verso la soluzione acquosa nella mioglobina
- sono idrofobici perché si trovano nelle zone di contatto degli oligomeri
nelle catene α e β
M.N. Gadaleta
Confronto tra la struttura primaria (sequenze AA) della Mb di
Capodoglio e le catene α e β di Hb umana
da: Nelson & Cox
M.N. Gadaleta
Famiglia di proteine: evoluzione per duplicazione genica.
da: Voet & Voet (1^ Ed.)
M.N. Gadaleta