Biotecnologie applicate alla progettazione e
sviluppo di molecole biologicamente attive
A.A. 2010-2011
Modulo di Biologia Strutturale
Proteasi a Serina
Marco Nardini
Dipartimento di Scienze Biomolecolari e Biotecnologie
Università di Milano
Proprietà generali
Proprietà generali
Enzimi proteolitici con meccanismo catalitico basato su una Serina reattiva
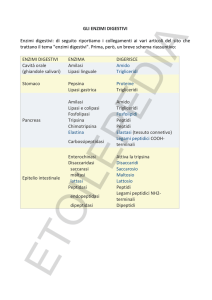
Enzimi digestivi (chimotripsina, tripsina, elastasi)
- idrolisi di legami peptidici
- diverse specificità per le catene laterali che affiancano il legame peptidico
suscettibile
- sintetizzati nel pancreas e secreti nel duodeno come zimogeni
Proprietà generali
Struttura 3D
chimotripsina, tripsina, elastasi
- 240 aa, Mw ~ 25 kDa e strutture simili tra loro (40% identità di sequenza)
- 2 domini (entrambi barili β antiparalleli)
- triade catalitica His57-Asp102-Ser195
(depressione superficiale)
- tasca di specificità (riconoscimento)
Struttura 3D
chiave greca
β hairpin
• duplicazione gene di una
proteasi a serina ancestrale
• evoluzione divergente
Struttura 3D
Tasca di specificità
Struttura 3D
Tasca di specificità
- preferenza ma non ha una specificità assoluta rispetto al substrato
- non-specificità: legami a H regione di loop dell’enzima-catena substrato
⇒ formazione di breve foglietto β antiparallelo (enzima-substrato)
Struttura 3D
Evoluzione
Evoluzione
- duplicazione del gene di una proteasi a serina ancestrale (solo Ser catalitica)
- mutazioni ed evoluzione divergente ⇒ triade catalitica
- i 3 enzimi pancreatici hanno omologhi batterici ⇒ evoluzione prima della divergenza
fra procarioti ed eucarioti
subtilisina (endopeptidasi), serina
carbossipeptidasi II (esopeptidasi)
geometria del sito catalitico è molto
simile ⇒ evoluzione convergente
Attivazione funzionale
Zimogeni
precursori inattivi di enzimi che acquisiscono piena attività in seguito a tagli proteolitici
specifici di uno o più legami peptidici
⇒ attivazione irreversibile
Enzimi digestivi:
- sintesi degli zimogeni nello stomaco o nel pancreas, attivazione nel duodeno
- zimogeni pancreatici in vescicole intracellulari (“granuli di zimogeno”)
- attivazione mediante taglio proteolitico N-terminale
Attivazione funzionale
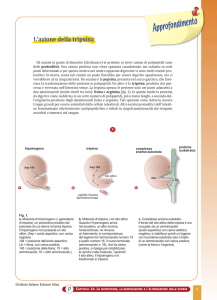
Attivazione del chimotripsinogeno
processo di autolisi
Attivazione funzionale
Attivazione enzimi digestivi
Attivazione funzionale
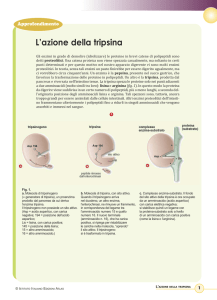
Attivazione della tripsina
numerazione
chimitripsina
secreta dalla mucosa del duodeno
sotto controllo ormonale
attivazione del tripsinogeno lenta
a causa dell’azione repulsiva dei
4 Asp su Asp della tasca di
specificità
attivazione autocatalitica del tripsinogeno
Meccanismo catalitico
(catalisi covalente)
intermedio tetraedrico
simile a stato di transizione
(catalisi favorita dal legame
dello stato di transizione )
H2O è il nucleofilo
Ser il gruppo uscente
deacilazione dell’enzima
formazione di un intermedio tetraedrico
acil-enzima
rilascio del prodotto carbossilato e rigenerazione dell’enzima
Meccanismo catalitico
Stabilizzazione dello stato di transizione
distorsione tetraedrica:
⇒ formazione di 3 legami a idrogeno che non si possono formare quando il
gruppo carbonilico è in configurazione trigonale
⇒ efficienza catalitica dovuta al legame preferenziale dello stato di transizione
Inibizione
Inibizione con analogo dello stato di
transizione
DIPF = diisopropilfosfofluoruro
Il gruppo fosforico tetraedrico rende DIPF analogo dello stato di transizione
⇒ veleni nervini (inibizione acetilcolina esterasi) ⇒ incapacità di respirare
acetilcolina esterasi ⇒ degradazione acetilcolina: neurotrasmettitore che trasmette
impulsi nervosi attraverso sinapsi (impulsi ~1ms)
inibizione ⇒ ridotta idrolisi acetilcolina ⇒ recettore Na+-K+ rimane aperto troppo a lungo ⇒
interferenza con la regolare sequenza degli impulsi nervosi
Inibizione
Inibitore della tripsina di pancreas bovino
BPTI: proteina di 58 a.a.
BPTI
- catena laterale di Lys (BPTI)
occupa la tasca di specificità
della tripsina (struttura rigida)
contatto di van der Waals
molto corto (2.6 Å)
BPTI-tripsina: complesso compatto (costante di associazione 1013 M-1)
⇒ nessuna proteolisi
⇒ il gruppo uscente non può allontanarsi
⇒ H2O non può entrare nel sito di reazione
- importanza fisiologica : la tripsina attivata prematuramente nel pancreas non
può digerire le proteine dell’organo
Struttura 3D
Subtilisina
Subtilisina: proteasi a serina batterica
- interesse commerciale (additivi ai detersivi in polvere)
- 257 a.a. senza omologia di sequenza con la chimotripsina
- dominio di tipo α/β costituito da 5
filamenti β paralleli e 4 α eliche,
due su ciascun lato del foglietto β
- sito attivo alle estremità carbossiliche
dei filamenti β centrali
Struttura 3D
Subtilisina
- sito attivo sorprendentemente simile a quello della chimotripsina
⇒ (evoluzione convergente)
- anomalia strutturale:
cross-over-connection sinistrorsa
His64
se il motivo β2-αB-β3 fosse destrorso, l’elica αB (His64) si troverebbe sull’altro lato
del foglietto β, molto lontano dal sito attivo