CATABOLISMO AMMINOACIDI
1
Catabolismo aminoacidi
Digestione di
proteone dalla
dieta
Turnover delle
proteine
Digiuno
prolungato
2
Digestione delle proteine dalla dieta
L’organismo ricava la maggior parte degli
aminoacidi di cui ha bisogno dalle proteine
alimentari;
Per essere utilizzati questi aminoacidi le
proteine devono essere “digerite” cioè
idrolizzate negli aminoacidi costituenti;
Meno di 1/10 delle proteine ingerite con una
dieta equilibrata viene eliminata senza essere
stata “digerita”
3
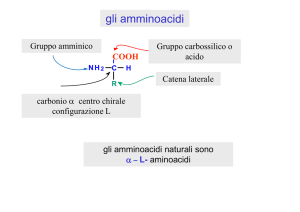
Aminoacidi essenziali e non
per la sintesi proteica
sono necessari tutti e 20
gli aminoacidi naturali;
alcuni aminoacidi sono
definiti essenziali perché
non possono essere
sintetizzati e sono
introdotti con la dieta;
La fenilalanina è
necessaria per la sintesi
di ormoni tiroidei e
dell’adrenalina
4
Cosa succede se mancano
aminoacidi essenziali?
l’organismo è costretto a demolire alcune
sue proteine;
Durante il digiuno prolungato il fegato può
arrivare a perdere il 50% delle proprie
proteine, il muscolo scheletrico il 30% il cuore
solo il 3%;
Cioè fegato e muscolo scheletrico possono
servire da “riserva” di aminoacidi.
5
Stomaco
Intestino
6
Proteine introdotte con la dieta
Enzimi proteolitici:
Proteasi gastriche
Pepsina
Proteasi pancreatiche
Tripsina
Chimotripsina
7
8
Zimogeni e proteasi
9
Degradazione proteine da dieta: proteasi
gastriche
Pepsina
•L’attacco enzimatico inizia nella cavità dello stomaco;
•pH ottimale ~ 2;
•Secreto dalle cellule della mucosa gastrica come
pepsinogeno (zimogeno);
•L’attivazione avviene spontaneamente a pH =2 realizzato con
la secrezione di HCl
10
Pepsina
• non particolarmente specifica;
•Idrolizza preferenzialmente i i legami peptidici con il gruppo
carbossilico di aminoacidi aromatici (fenilalanina, triptofano,
tirosina)
HCl
•Attiva la pepsina;
•Svolge azione
battericida;
•Denatura le proteine
11
Proteasi pancreatiche
Tripsina
• Endopeptidasi (pH 7-8);
•Idrolizza legami peptidici con il gruppo carbossilico di
aminoacidi basici quali arginina e lisina;
•E’ particolarmente attiva sui prodotti di degradazione della
pepsina;
•E’ sintetizzata come zimogeno (tripsinogeno) ed attivata da
una enteropeptidasi (enzima prodotto dalla mucosa
intestinale.
12
Peptidasi intestinali
•Enzimi endocellulari;
•Aminopeptidasi staccano gli aminoacidi Nterminali;
•Dipeptidasi rompono i dipeptidi che resistono
alle aminopeptidasi;
13
Assorbimento intestinale degli aminoacidi
Gli aminoacidi così formati sono assorbiti
dall’intestino mediante trasporto attivo.
Specifici trasportatori fannoentrare gli
aminoacidi insieme a ioni Na+ con idrolisi di
ATP.
14
Turnover delle
proteine
15
Regola dell’N-terminale
E1
E2
E3
Enzima di attivazione dell’
ubiquitina
Enzima di coniugazione
dell’ubiquitina
Ubiquitina-proteina ligasi
16
ATP
+
E1
+
+
Ubiquitina
E2
+
E3
+
Target
17
3 enzimi sono necessari per il tag
di una proteina con l’ubiquitina
18
Ubiquitina= proteina di
8,5 kDa ~76 aa
Il residuo di glicina
carbossiterminale
forma il legame
isopeptidico con residui
di lisina della proteina
da degradare
19
Proteasoma
La degradazione delle
proteine è essenziale per la
crescita cellulare
Fornisce amminoacidi
Rimuove enzimi in eccesso
Rimuove o porta
all’attivazione di fattori di
trascrizione
Struttura del proteasoma 26S
20S Parte centrale con
attività catalitica
19S complesso regolatorio
20
Il Proteasoma 26S degrada le
proteine legate all’ubiquitina
19S subunità regolatoria
(7 α subunità)
20S proteasoma
(attività catalitica)
2 x 7 β subunità
19S subunità regolatoria
(7 α subunità)
21
Inibitori del proteosoma
Il blocco dell’attività del proteasoma
potrebbe essere una strategia vincente
contro alcuni tumori
Meccanismo d’azione
•Peptide boronico inibisce le serine proteasi imitando il
substrato nel legame nel sito attivo.
•Queste molecole possono inibire il proteosoma legandosi
al sito centrale 20S del proteasoma
25
BORTEZOMIB: UN FARMACO INTELLIGENTE
Effetti biologici
PROLIFERAZIONE
p21 p27
APOPTOSI
p53 Bid Bax
ACCUMULO DI I-KB
Repressione di NF-KB
Induzione Apoptosi
Repressione proliferazione
Etc….
STABILIZZAZIONE
APOPTOSI
APOPTOSI
JNK
ANGIOGENESI
NF-kB
PROLIFERAZIONE
PROTEOSOMA
26
Rimozione del gruppo amminico
degli amminoacidi
27
Da dove vengono i
gruppi amminici?
28
α-chetoacidi
Ossalacetato
COO
COO
COO
|
C=O
|
R
|
C=O
|
CH3
Piruvato
|
C=O
|
CH2
|
COO29
α-aminoacidi
Acido Aspartico
COO
COO
|
COOCH-NH2
|
|
CH-NH2 CH-NH2 |
CH2
|
|
|
R
CH3
COO
Alanina
30
COO|
C-NH2
|
CH3
Alanina
COO
|
C=O
|
CH3
Piruvato
31
32
Transaminazione
NH2
|
+
HOOC - CH - R1
O
||
HOOC - C - R2
O
||
HOOC - C - R1
NH2
|
HOOC - CH - R2
+
33
34
PLP Piridossal fosfato
35
36
Sintesi della
Glutammina
40
Nel
fegato
41
La glutammina serve come
donatore di gruppi amminici per
molte altre molecole
carbamoyl-phosphate
CO2+H
glucosamine-6-P
3N-C-H
histidine
CH2
tryptophan
CH2
O
C-NH2
AMP
CTP
42
Sei dei prodotti finali inibiscono allostericamente
la glutammina sintetasi
carbamoylGlu
CO2+H
3N-C-H
glutamine
synthetase
ATP
ADP
+
Pi
NH4
Gln
CO2+H N-C-H
3
phosphate
glucosamine
-6-P
histidine
CH2
CH2
CH2
CH2
AMP
C-NH2
CTP
X X X X X X X X
CO2-
O
tryptophan
glycine
alanine
Ser, Gly e Ala inibiscono il sito
di legame con il substrato
L’effetto inibitorio di tutti I prodotti
insieme è maggiore della somma
degli effetti individuali.
43
Nel Fegato
CO2+H N-C-H
3
CH2
CH2
O
C-NH2
Glutamminasi
CO2+H N-C-H
3
CH2
+ NH4+
CH2
O
C-O-
44
Sintesi dell’alanina
45
Alanina
46
47
Reazione della
Glutammico deidrogenasi
48
Regolazione della Glutammato deidrogenasi
49
Come vengono
degradati gli
aminoacidi?
50
Destino del gruppo amminico degli aminoacidi
nei vertebrati
51
Ciclo dell’urea
Glutammato
GDH
α-chetoglutarato
52
53
Sintesi del Carbamil fosfato
Carbamil fosfato sintetasi
54
mitocondri
55
citosol
56
citosol
57
citosol
58
CICLO DELL’UREA
59
60
Ossalacetato
COO|
C=O
|
CH2
|
COO
Transamminazione
ad aspartato e
ciclo dell’urea
Conversione in glucosio
nella gluconeogenesi
Condensazione con
acetilCoA
nel ciclo di Krebs
61
62
63
Deaminazione degli aa (rimozione del gruppo aminico)
deaminazione ossidativa
(AAO con FAD o FMN)
aminoacido deidrogenasi
(glutamico deidrogenasi = GDH)
Deaminazione degli aa (TRANS-AMINATIVA)
(solo spostamento del gruppo aminico da aa ad αchetoglutarato, con formazione del chetoacido e di
glutammato)
GOT- glutamico-ossalacetico
transaminasi
AST (aspartico transaminasi)
GPT- glutamico-piruvico
transaminasi
ALT (alanina transaminasi)
64
Transaminasi
GDH
GPT
Glutaminasi
Glutamina
sintasi
65
Regolazione del ciclo dell’Urea
• a breve termine:
Attivazione della carbamilfosfato sintetasi da
parte dell’ N-acetilglutammato;
• a lungo termine:
Induzione della sintesi di enzimi del ciclo in
seguito a dieta iperproteica e nel digiuno
prolungato
66
Regolazione del ciclo dell’Urea
67
Destino dello scheletro carbonioso
Glucogenici
Chetogenici
68
Piruvato
69
α− chetoglutarato
70
71
Ossalacetato
COO|
CH-NH2
|
asparaginasi
CH2
|
CONH2
asparagina
COO|
CH-NH2
|
Aspartato
CH2
transaminasi
|
COO-
COO|
C=O
|
CH2
|
COO-
aspartato
72
Succinil CoA
73
Acetil CoA
74
75
Difetti del ciclo dell’urea
IPERAMMONEMIA
Congenita: carenza di uno qualsiasi degli enzimi
del ciclo dell’urea
Acquisita: patologie epatiche (epatite, cirrosi,
ostruzione vie biliari)
76
Difetti del ciclo dell’urea
Carenza di carbamil fosfato sintetasi o di
ornitina transcarbamilasi
77
Argininosuccinasi
Ornitina
transcarbamilasi
78
Il trattamento è basato sulla
combinazione di una dieta ipoproteica
integrata con aminoacidi (Arg) e
farmaci che favoriscono l’escrezione
dell’azoto attraverso vie alternative al
ciclo dell’urea
79
Vie alternative: impiego di benzoato e
fenilacetato che reagiscono principalmente con
glicina e glutammina producendo composti che
vengono eliminati con le urine
80
Citrullinemia I – difetto in argininosuccinato
sintetasi provoca crisi
epilettiche e tensioni
muscolari. Può essere curata
con una dieta opportuna
Citrullinemia II– difetto nel trasportatore
mitocondriale aspartatoglutammato provoca
iperammonemia
Sindrome HHH- iperammonemia,
iperornitinemia,
omocitrullinemia
81
Fenilchetonuria
Accumulo di
fenilalanina nel sangue
provoca grave ritardo
mentale.
Può essere trattata
con un’opportuna dieta
povera di fenilalanina
82
Morbo di ParkinsonMalattia neurologica
associata anche alla
limitata produzione di
dopammina.
Un tentativo di cura è la
somministrazione
proprio di dopammina
83