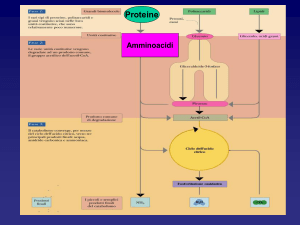
DEGRADAZIONE
DELLE
PROTEINE
AL FEGATO
DEGRADAZIONE INTRACELLULARE
DELLE PROTEINE
• Eliminazione di proteine abnormali o invecchiate
• Regolazione del metabolismo celluare
• Proteine dal muscolo
Processo ubiquitina-dipendente (solo negli eucarioti)
Processo specifico
PROTEASOMA
Proteine ubiquitinilate
Biosintesi
Peptidi 8-merici
Degradazione ossidativa
DEGRADAZIONE LISOSOMIALE
– Non selettiva (in condizioni normali)
– Degradazione di sostanze provenienti da
endocitosi
– Selettiva in condizioni particolari (digiuno, stress
cellulare)
• Degradazione muscolare (denervazione, disuso,
trauma)
• Regressione dell’utero postpartum
• Sindromi infiammatorie croniche
OSSIDAZIONE
DEGLI
AMMINOACIDI
Urea sintetizzata nel fegato, poi immessa nel
sangue e sequestrata dal rene
TRANSAMINAZIONE
E
A+B
P+Q
Reazione a ping pong
A
E
P
EA-E’P
B
E’
Q
E’B-EQ
E
DEAMINAZIONE OSSIDATIVA
La regolazione è importante per non accumulare
l’ammoniaca, che è tossica
CICLO DELL’UREA, Krebs and Henseleit, 1932
CARBAMIL FOSFATO SINTETASI I
Contiene biotina, attivata da N-Acetilglutamato
Sintesi dell’urea
Sintesi della
citrullina
Reazione
dell’argininosuccinato
sintetasi
Produzione
di arginina
Reazione dell’arginasi
Connessioni tra
ciclo dell’urea e ciclo di Krebs
DEMOLIZIONE DELLA CATENA
CARBONIOSA DEGLI AMINOACIDI
• Degradazione in composti che possono essere metabolizzati a
CO2 e H2O o utilizzati nella gluconeogenesi
• La degradazione ossidativa degli aminoacidi acconta per il
10-15% dell’energia metabolica negli animali
• Gli aminoacidi vengono degradati a formare 7 intermedi
metabolici:
– Piruvato
- α-Chetoglutarato
– Succinil-CoA
– Fumarato
– Ossalacetato
– Acetil-CoA
– Acetoacetato
BIOSINTESI AMMINOACIDI
ASSIMILAZIONE DELL’AZOTO
SCHEMA BIOSINTESI AMMINOACIDI
Retroinibizione nella sintesi di aminoacidi
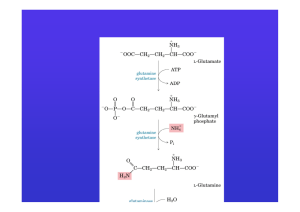
ATTIVAZIONE AMMINOACIDI
DERIVATI AMMINOACIDICI
EME
Succinil-CoA + Glicina
POLIAMMINE
Ornitina
CATECOLAMINE
Tirosina
NO•
Arginina
ISTAMINA
Istidina
SEROTONINA
Triptofano
GABA
Glutamato
BIOSINTESI NUCLEOTIDI