gastrulazione
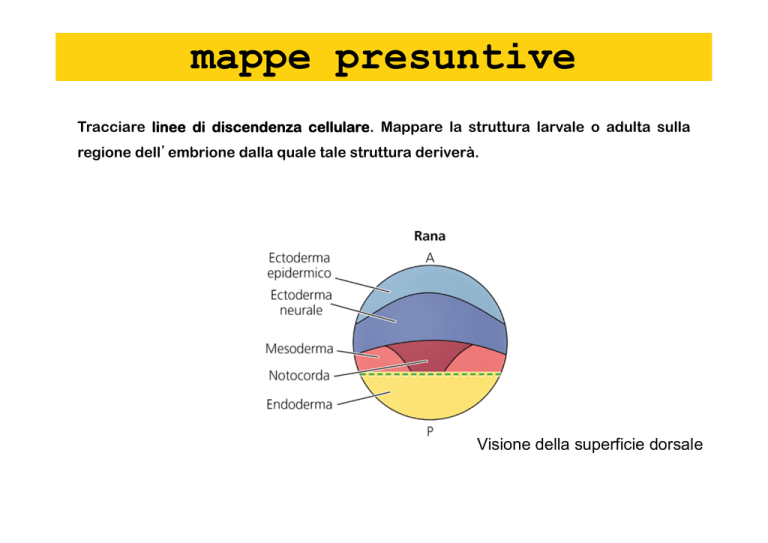
mappe
presuntive
Tracciare linee di discendenza cellulare. Mappare la struttura larvale o adulta sulla
regione dell’embrione dalla quale tale struttura deriverà.
Visione della superficie dorsale
mappe presuntive
presuntive
mappe
1. Osservazione dei viventi. Alcuni organismi hanno il vantaggio di essere trasparenti,
composti di poche cellule le figlie delle quali rimangono in posizioni adiacenti,
quindi “facilmente” individuabili. La mappa presuntiva del tunicato Styela partita è
stata tracciata da EG Conklin nel 1905 che seguì il destino dei singoli blastomeri
grazie alla loro peculiarità d’essere colorati in modo differente (presenza di
pigmento) a seconda del destino.
mappe presuntive
1. Marcatura con coloranti vitali. Coloranti vitali (es. blu Nilo, rosso neutro) colorano le
cellule senza ucciderle. Se ne può quindi seguire il destino.
Vogt (1929) mappe presuntive
2. Marcatura con radioisotopi. Un’area dell’embrione viene resa radioattiva: si incuba un
embrione in terreno contenente timidina radioattiva (che verrà incorporata nel DNA delle cellule
che si replicano); l’area di interesse viene espiantata e con essa si sostituisce la regione
corrispondente in un embrione incubato in terreno “freddo”. Le cellule “marcate” verranno
riconosciute nell’embrione “non marcato” mediante tecniche autoradiografiche.
Vogt (1929)
mappe presuntive
3. Marcatura con coloranti fluorescenti. Coloranti vitali e radioisotopi vengono diluiti nel succedersi
delle divisioni cellulari. La detection dei composti diviene difficoltosa. Si usano quindi coloranti
fluorescenti (es. carbocianine), di maggiore intensità. Tali coloranti vengono microiniettati nella
cellula(e) d’interesse, la cui discendenza sarà tutta marcata. Alternativamente, l’iniezione del
colorante fluorescente “inattivo” (caged) avviene ai primissimi stadi di sviluppo in modo che
diffonda nell’intero embrione. Successivamente, mediante un laser, si colpisce la cellula(e)
d’interesse nella quale il colorante verrà “liberato” e diverrà fluorescente. Si bypassa il
macchinoso step della microiniezione in blastomeri specifici a stadi più avanzati di sviluppo.
mappe presuntive
4. Marcatura genetica. Costruzione di embrioni “chimera” nel quale le cellule sono
geneticamente (quindi fenotipicamente) differenti. Trapianto di cellule di quaglia in
embrione di pollo.
equivalenza del genoma
Tutte le cellule dell’organismo hanno
effettivamente lo stesso identico genoma?
Oppure il patrimonio genetico della cellula
ormai dif ferenziata ha subito delle
modificazioni funzionali irreversibili?
Gilbert, BIOLOGIA DELLO SVILUPPO, Zanichelli editore
S.p.A. Copyright © 2005
equivalenza del genoma
Hans Spemann e la Teoria del Trasferimento Nucleare
1938: una cellula già terminalmente differenziata è in grado di
riprogrammare l'informazione in termini di espressione genica e
di controllare lo sviluppo embrionale? Spemann propose di
prelevare il nucleo da una cellula di un embrione in avanzata fase
di sviluppo e trasferirlo nel citoplasma di una cellula uovo
enucleata. Spemann non pote' condurre l'esperimento per la
mancanza di strumenti adatti alla manipolazione e dissezione
delle cellule somatiche e germinali.
equivalenza del genoma
exp. Robert Briggs e Tom J. King, 1952
Rana pipiens
equivalenza del genoma
equivalenza del genoma
Briggs e King pongono le basi sperimentali (creano quegli strumenti che
erano mancati a Spemann 14 anni prima quando elaborava la teoria del
Trasferimento Nucleare) per fornire le risposte ai quesiti di quegli anni:
(?) Il nucleo di una cellula differenziata conserva ancora tutte le
informazioni originarie; inoltre, tale nucleo risulta riprogrammabile ed in
grado di originare un nuovo individuo.
(?) La sinergia tra il citoplasma ospite dell’uovo e il nucleo che in esso
viene rilocato è sufficiente a riattivare il nucleo a dirigere lo sviluppo del
nuovo individuo.
equivalenza del genoma
1962: J. Gurdon ritenta l'esperimento di
Briggs e King, usando nuclei di cellule
differenziate d'intestino di girino di
Xenopus laevis. 1.4 la % di successo a
girino. Utilizzando il trapianto in serie - il
nucleo viene trapiantato nell’uovo che
viene lasciato sviluppare fino a blastula. Il
nucleo della cellula di blastula si
trasferisce in un altro uovo enucleato e
così via - ottenne un successo del 7%
comprendente 7 rane adulte fertili.
Gurdon dimostra che i nuclei di cellule
somatiche differenziate, trasferiti nel
citoplasma di un uovo enucleato,
modificano il proprio programma
genetico.
equivalenza del genoma
1997: I. Wilmut e collaboratori clonano il
primo mammifero.
Prelievo cellule somatiche da ghiandola
mammaria di adulto (razza Finn-Dorset).
Coltura cellulare e arresto in G1 (le cellule,
2n, son quindi sincronizzate).
Oociti dalla donatrice (razza Scottish blackface)
in seconda metafase meiotica enucleati.
Fusione cellulare somatica/oocito e attivazione
dell’oocito stesso mediante impulsi elettrici.
Trasferimento in utero di pecora gravida.
% di successo: 1/434 oociti impiantati = Dolly.
Dimostrazione della totipotenza del nucleo dei
mammiferi: il genoma rimane inalterato e
capace di differenziare in tutti i tipi cellulari.
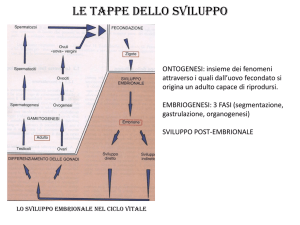
primi stadi di sviluppo
Segmentazione: rapide divisioni cellulari (mitosi) che dividono il citoplasma dell’uovo fecondato
in numerose cellule (blastomeri).
Gastrulazione: le cellule formate in segmentazione si muovono in modo coordinato,
ridistribuendosi. Con la gastrulazione si formano i tre foglietti embrionali, Ectoderma,
Mesoderma, Endoderma, che daranno origine, successivamente, alle strutture di competenza.
segmentazione
segmentazione
Segmentazione: rapide divisioni cellulari (mitosi) che dividono il citoplasma
dell’uovo fecondato in numerose cellule figlie (blastomeri).
Rana pipiens segmentazione
MBT
(midblastula transition – transizione della blastula intermedia)
MPF (Mitosis Promoting Factor)
MPF si compone di 2 subunità:
- cdc2, capace di trasferire gruppi fosfato dall’ATP a specifici residui di Ser e Thr di specifiche proteine
- ciclina B, che regola la cdc2.
MPF fosforila diverse proteine, tra cui:
- le condensine, che favoriscono la condensazione della cromatina e la segregazione dei cromosomi;
- le lamìne, i cui dimeri vengono dissociati determinando la degradazione della membrana nucleare;
- istoni.
tipi di segmentazione 1
Il solco di segmentazione interessa l’intero uovo
tipi di segmentazione 2
Il solco di segmentazione non penetra nella regione ricca di vitello
segmentazione
Blastula riccio di mare
blastocele
1. Permette la migrazione cellulare durante i massivi movimenti della gastrulazione
2. Impedisce il contatto – quindi l’interazione – tra le cellule.
emisfero (calotta) animale
Nieuwkoop (1973)
adesione cellulare
Cell Adhesion Molecules
adesione cellulare
oligonucleotidi antisenso anti-EP-caderina.
Heasman et al, 1994 anfibi - segmentazione
Blastocele (cavità)
Morula (16-64 cellule)
Blastula (128 cellule)
blastocele
controllo
Heasman et al, 1994
oligonucleotidi antisenso anti-EP-caderina
adesione cellulare
doi: 10.1073/pnas.0905349106
adesione cellulare
gastrulazione
x
e
n
o
p
u
s assi corporei
ASSE ANTEROPOSTERIORE
(cefalocaudale): capo > coda
ASSE DORSOVENTRALE:
dorso > addome
ASSE DESTRA-SINISTRA:
lato Dx > lato Sx