1
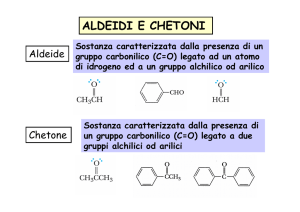
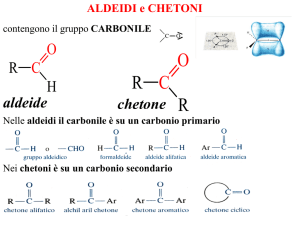
Aldeidi
H
O
O
O
C
C
C
H R
H Ar
2
H
Chetoni
R
O
O
O
C
C
C
R Ar
R Ar
3
Ar
Chetoni
I termini R1 e R2 sono radicali alchilici o arilici.
Se R1 = R2 si ha un chetone simmetrico.
Se R1 ≠ R2 si ha un chetone asimmetrico.
O
C
R1
Formula generale di un chetone
R2
4
Impieghi e usi
Alcune aldeidi e alcuni chetoni sono largamente diffusi in natura
e hanno odori che ricordano la loro origine. Il citronellale, per
esempio, si trova nel limone, l’aldeide cinnamica nel cinnamone,
l’aldeide vanillica nella vaniglia. Tra i chetoni ricordiamo la
canfora e il carvone, che si trovano nell’olio di comino.
Vaniglia
5
Rodinale
La rodinale si trova nel comune citronellale, derivante dall'olio essenziale di
citronella, ed è quindi responsabile dell’odore caratteristico.
3,7-Dimetilott-6-en-1-ale
6
In natura
Pianta di citronella
Candela di citronella
Pianta di ciannamone
7
Pianta di canfora
Impieghi e usi - Chetoni
I chetoni sono un gruppo di composti molto importanti dal punto di vista
industriale. Vengono largamente utilizzati per la produzione di materie
plastiche, medicinali, profumi e molto importante è anche il loro utilizzo come
solvente.
Alcuni profumi contenenti aldeidi includono
Chanel No.5 e No.22, Lancôme Climat,
Givenchy L'Interdit, Estée Lauder Estée, e D & G
Sicilia. Chanel n.5 non è stato il primo profumo
ad includere aldeidi, ma è responsabile della
diffusione del loro uso nei profumi.
8
Aldeidi e chetoni
Le aldeidi e i chetoni sono molto simili in molte delle reazioni data la presenza
del gruppo funzionale carbonilico in entrambe le famiglie. Tuttavia differiscono
di molto in una delle più importanti reazione, l’ossidazione. Le aldeidi sono
prontamente ossidate da acidi carbossilici, mentre i chetoni resistono
all’ossidazione, per la loro ossidazione sono necessarie condizioni estreme.
9
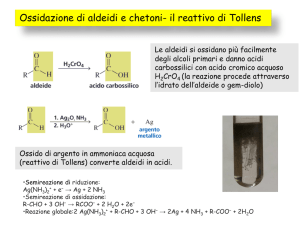
Impieghi e usi
Le aldeidi sono infatti, tra i composti organici più facili da ossidare. Sono
ossidati dall’ossigeno dell’aria ad acidi carbossilici.
2RCHO + O2 → 2RCOOH
La facilità nell’ossidazione è utile per la loro identificazione. Un ossidante
sufficientemente debole può distinguere le aldeidi non solo dai chetoni
ma anche dagli alcol. Il reagente di Tollen, per esempio, è una soluzione
alcalina di ioni di argento (Ag) complessati con ammoniaca che
mantengono lo ione di argento in soluzione.
[H 3
+
N—Ag —NH
10
3
]
Impieghi e usi
Depositato su una superficie di vetro pulito, l'argento viene usato per formare
uno specchio. I chetoni ordinari non reagiscono con il reattivo di Tollens. Una
reazione correlata alla reazione Tollens viene spesso utilizzata per produrre
specchi d'argento. Questi ornamenti sono argentati da tale reazione in cui il
glucosio, uno zucchero semplice, con un gruppo funzionale aldeidico, viene
utilizzato come agente riducente.
11
Acetone - Propanone
12
Formaldeide - Metanale
La formaldeide trova innumerevoli impieghi; viene utilizzata come battericida,
disinfettanti per uso domestico. Soluzioni di aldeide formica vengono anche
utilizzate per conservare campioni di materiale biologico. Trova del resto vasto
impiego anche nelle tecniche di imbalsamazione e come conservante “tra gli
additivi alimentari identificata come E240” soprattutto negli alimenti
affumicati.
La maggior parte della formaldeide prodotta è destinata però alla produzione di
polimeri e di altri composti chimici. Del resto è utilizzata come vernice collante
insieme all’urea e nei pannelli fonoassobenti e divisori degli uffici open space.
Per reazione con il fenolo polimerizza dando la bachelite, una resina termoindurente.
13
Formaldeide - Metanale
Sedia in
bachelite
14
Cervello conservato in formaldeide
Benzaldeide - Fenilmetanale
Sebbene la benzaldeide possa essere
impiegata come solvente, il suo principale
utilizzo è quello di precursore per la sintesi di
diversi composti organici, dai farmaci agli
additivi per le plastiche. È anche un
importante intermedio per la preparazione di
profumi e fragranze come anche nella sintesi
di coloranti anilinici.
15
Acetaldeide - Etanale
L’acetaldeide è un’importante reattivo impiegato
nelle sintesi industriali organiche. A partire
dall’acetaldeide vengono ad esempio prodotti:
• Acido Acetico
• Acido paracetico
• Anidride acetica
• Chetene
• Etil acetato
• Crotonaldeide
• 1-Butanolo
• 2-etilesanolo (utilizzato per la preparazione del
di-2-etilesilftalato)
16
Propanale
Viene impiegato principalmente per produrre trimetiloletano CH3C(CH2OH)3
attraverso una reazione di condensazione col metanolo. Questo triolo è un
importante intermedio nella produzione di resine alchidiche.
La condensazione di propionaldeide con t-butilammina dà CH3CH2CH=N-t-Bu,
un'unità costruttiva di tre atomi di carbonio di uso frequente in sintesi organica.
La deprotonazione di questa immina con litio diisopropilammide produce
CH3CHLiCH=N-t-Bu, che a sua volta può essere condensato con aldeidi.
17
Acroleina, 2-propenale, o 2-propen-1-ale
È una sostanza tossica per il fegato e irritante per la mucosa gastrica. Viene
prodotta dalla disidratazione del glicerolo, reazione che si presenta durante la
frittura oltre il punto di fumo dell'olio utilizzato.
Fa inoltre parte dei componenti in fase gassosa del fumo di sigaretta,
causando danni all'organismo per la sua azione irritante.
In ambito vinicolo, l'acroleina è una degradazione per disidratazione della
glicerina ad opera di batteri lattici, viene inoltre utilizzata in ambito medico.
18
Acetaldeide - Etanale
L’acetaldeide può formare un tetramero ciclico, di formula (CH3CHO)4,
chiamato metaldeide o meta, che a temperatura ambiente è un solido bianco,
cristallino, sublimante a 112°C, utilizzato come molluschicida, e come
combustibile solido, in particolare nei fornelli da campo, in analogia con
l’altrettanto diffuso Esbit (o urotropina).
19
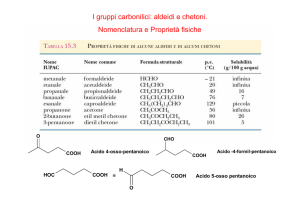
Nomenclatura IUPAC - Aldeidi
L’atomo di carbonio del gruppo -CHO si considera il primo atomo della
catena principale. La catena viene numerata in modo da assegnare all'atomo
di carbonio del gruppo C=O il numero più basso possibile.
Il nome che viene dato alla catena principale è simile a quanto visto per
l’idrocarburo corrispondente con la perdita dell’ultima vocale e l’aggiunta
del suffisso “-ale”
Quando il gruppo -CHO viene considerato un gruppo sostituente, prende il
nome di “formil-“
20
Nomenclatura - Aldeidi
21
Nomenclatura - Aldeidi
22
Nomenclatura - Aldeidi
23
Nomenclatura IUPAC - Chetoni
L'atomo di carbonio del gruppo C=O si considera appartenente alla catena
principale. La catena viene numerata in modo da assegnare all'atomo di
carbonio del gruppo C=O il numero più basso possibile.
Il nome che viene dato alla catena principale è simile a quanto visto per
l’idrocarburo corrispondente con la perdita dell’ultima vocale e l’aggiunta del
suffisso “-one”
Quando il gruppo -CHO viene considerato un gruppo sostituente, prende il
nome di “oxo-“
24
Nomenclatura - Chetoni
25
Nomenclatura - Chetoni
Simmetrici
Asimmetrici
26
Proprietà chimiche
Il gruppo funzionale in comune di aldeidi e chetoni è il carbonile.
Nelle aldeidi il carbonile si trova in posizione terminale, nei chetoni si trova
all’interno della catena.
Il carbonile ha una struttura planare perché ha al centro un carbonio con
ibridazione sp2.
Nel carbonile il carbonio è parzialmente positivo sia per effetto induttivo, a
causa dell’elettronegatività dell’ossigeno, sia per delle vere e proprie strutture
di risonanza come è illustrato nella slide seguente.
I relativi momenti di dipolo di formaldeide, altri aldeidi e chetoni confermano
l'influenza stabilizzante che i sostituenti alchilici hanno sui carbocationi
(maggiore è il momento di dipolo maggiore carattere polare del gruppo
carbonilico).
27
Strutture di risonanza
R
C
R
R
•O•
••
C
R
28
•O••
•
••
Momenti dipolari
Formaldeide
H
H
•
•
C O
••
Aldeidi
R
••
C O
••
H
D=2,5
D=2,29
29
Chetoni
R
R
••
C O
••
D=2,9
Mappe potenziali elettrostatici
Aldeide
Chetone
30
Proprietà chimiche
La struttura di risonanza di destra mette in evidenza che, nelle reazioni dei
gruppi carbonilici, il carbonio si comporta da elettrofilo e da acido di Lewis
mentre l’ossigeno da nucleofilo e da base di Lewis.
A causa della polarità del gruppo carbonilico, le aldeidi e i chetoni sono
composti polari e allo stato liquido mostrano interazioni dipolo-dipolo. Per
questo motivo hanno punti di ebollizione più alti dei composti non polari di
peso molecolare paragonabile.
Poiché i gruppi carbonilici delle aldeidi e dei chetoni interagiscono con le
molecole d’acqua mediante la formazione di legami idrogeno, le aldeidi e i
chetoni a basso peso molecolare sono più solubili in acqua rispetto ai
composti non polari di peso molecolare paragonabile.
31
Legami intermolecolari
Molecola
Punto di
Peso molare Tipo di forze
Famiglia
ebollizione
(g/mol)
intermolecolari
(°C)
CH3CH2CH2CH3
Alcano
58
Dispersione (di London)
–1
CH3OCH2CH3
Etere
60
Dipolo debole
6
CH3CH2CHO
Aldeide
58
Dipolo forte
49
CH3CH2CH2OH
Alcol
60
Legame idrogeno
97
Dispersione (di London): dipoli istantanei
32
Proprietà fisiche
Il doppio legame carbonio-ossigeno è molto polare, più polare di un singolo
legame carbonio-ossigeno:
In aldeidi e chetoni, questa separazione di carica comporta interazioni dipolodipolo che sono abbastanza grandi da influenzare in modo significativo i punti
di ebollizione. La tabella mostra che i legami singoli polari negli eteri
influiscono poco in tale effetto, mentre i legami idrogeno tra le molecole di
alcol influiscono più del carbonile.
Anche se i membri inferiori della serie omologhe hanno odori pungenti, molte
aldeidi superiori hanno piacevoli odori e sono utilizzati in profumi e aromi
artificiali. Per quanto riguarda i chetoni, l’acetone ha un odore gradevole, ma la
maggior parte degli omologhi superiori hanno odori piuttosto blandi.
33
Proprietà fisiche
A causa della presenza di interazioni dipolo-dipolo, aldeidi e chetoni hanno punti
di ebollizione più elevati rispetto alcani di dimensioni e struttura simile.
L'ossigeno carbonilico di aldeidi e chetoni può essere accettore nei legami
idrogeno, con l’acqua ad esempio. La solubilità in acqua è particolarmente
elevata per molecole a basso peso molecolare come la formaldeide e acetone.
34
Proprietà fisiche
Molecola
Formula bruta
Punto di
fusione
Aldeide formica
HCHO
-92
-21
37
Aldeide acetica
CH3CHO
-121
21
illimitata
Propanale
CH3CH2CHO
-81
49
16
Butanale
CH3(CH2)2CHO
-99
76
7
Pentanale
CH3(CH2)3CHO
-92
103
scarsa
Benzaldeide
C6H5CHO
-26
178
insolubile
Acetone
CH3COCH3
-95
56
illimitata
Butanone
CH3COCH2CH3
-86
80
26
2-Pentanone
CH3COCH2CH2CH3
-78
102
6,3
Cicloesanone
C6H10O
-16
156
scarsa
35
Punto di
ebollizione
Solubilità g/100g
di H2O
Reazioni
Sito di reazione con acidi ed elettrofili
O
Sito di reazione con
nucleofili
R
C
C
H
Attacco da parte di basi forti
36
Reazioni - Riduzione ad alcoli
La riduzione su grande scala di aldeidi e chetoni per ottenere alcoli viene
eseguita con idrogeno e catalizzatore, Ni, Pt, Pd o Ru. In queste condizioni, però,
il doppio legame degli alcheni si riduce molto più velocemente del carbonile,
quindi per questa via non è possibile ridurre aldeidi e chetoni ad alcoli senza
ridurre anche un eventuale doppio legame carbonio-carbonio presente nella
molecola.
37
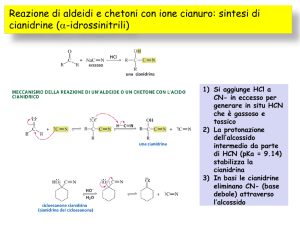
Formazione di cianidrine
La formazione di cianidride si ottiene per reazione di un'aldeide o chetone
con l'acido cianidrico, HCN. Dal momento che l'acido cianidrico è debole, si
suole trattarlo precedentemente in ambiente basico in modo da
massimizzare la concentrazione del nucleofilo (che, ovviamente, è il gruppo
cianuro, CN-). Il meccanismo di reazione segue quello dell'addizione
nucleofila, per quanto nel secondo stadio lo ione idrogenione è dato
dall'acqua (in modo da ripristinare la base che ha favorito la dissociazione
dell'acido cianidrico). Le cianidrine sono interessanti intermedi nella sintesi
organica.
38
Reazioni - Addizione di HCN
La reazione di sintesi delle cianidrine è perfettamente reversibile.
39
Reazioni - Addizione di alcol
40
Cianidrine
OH
CH3 C
C
N
C
2 - Idrossipropionitrile
41
Reazioni - Addizione composti di Grignard
I reattivi organometallici come i reattivi di Grignard (magnesio organici), i litio
organici e gli acetiluri di sodio reagiscono con aldeidi e chetoni con una
addizione nucleofila che forma alcoli superiori. Queste sono quindi reazioni
importanti dal punto di vista sintetico.
Con la formaldeide si ottengono alcoli primari, con le aldeidi si ottengono alcoli
secondari, con i chetoni si formano alcoli terziari.
42
Reazioni - Addizione composti di Grignard
43
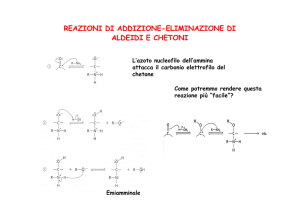
Reazioni - Addizione di composti azotati
L’ammoniaca e i suoi derivati (ammine primarie e secondarie, idrossilammina,
fenilidrazina, ecc.) sono molecole nucleofile e quindi reagiscono regolarmente
con le aldeidi e i chetoni con una reazione di sostituzione nucleofila nella quale
l’azoto si lega con doppio legame al carbonio e viene espulsa acqua. Si formano
degli analoghi azotati di aldeidi e chetoni.
44
Tautomeria cheto-enolica
Un atomo di carbonio adiacente ad un gruppo carbonilico è detto carbonio
in α, e tutti gli atomi di idrogeno a esso legati sono detti idrogeni in α. Le
aldeidi e i chetoni che posseggono almeno un idrogeno in α sono in
equilibrio con il loro isomero costituzionale detto enolo. Le forme
chetonica ed enolica sono esempi di tautomeri, isomeri costituzionali in
equilibrio tra loro che differiscono nella posizione di un atomo di idrogeno
e di un doppio legame rispetto a un eteroatomo (in genere O, S o N).
Questo tipo di isomeria è detto tautomeria.
45
Tautomeria cheto-enolica
La tautomeria cheto-enolica è un particolare tipo ditautomeria.
È caratteristica di tutte le specie carboniliche (ma in particolar modo
di aldeidi e chetoni) che abbiano almeno un atomo di idrogeno legato
al carbonio in posizione α rispetto al gruppo funzionale (-CHO o -C=O).
Il doppio legame del carbonile si rompe e si forma un ossidrile, trasformando
così l'aldeide o il chetone di partenza in un enolo (alcol con un doppio legame
fra gli atomi di carbonio e il gruppo ossidrile direttamente legato ad uno di
essi).
46
Tautomeria cheto-enolica
La reazione che porta alla formazione dell'enolo è la seguente:
• Il carbonio del carbonile è un dipolo positivo ed attira a sé gli elettroni
del legame C-H vicinale, portando alla dissociazione dell'idrogeno
asportabile da una appropriata base.
• Le due forme fra parentesi quadre sono le formule limite che
rappresentano l'anione che si viene a formare, stabilizzato
per risonanza. Se lo ione idrogeno si lega alla prima forma, si riottiene
l'aldeide (o il chetone) di partenza, altrimenti si ottiene la forma
enolica.
Le due forme, chetonica ed enolica, sono sempre in equilibrio tra loro.
Normalmente la forma chetonica è la più abbondante, ma ci sono alcune
eccezioni, come nei fenoli, in cui la forma chetonica è molto rara poiché in
questa forma manca l'effetto stabilizzante della delocalizzazione
elettronica aromatica.
47
Tautomeria cheto-enolica
Tautomeria cheto-enolica;
(a) è il chetone o l'aldeide,
(b) l'enolo corrispondente e
(c) l'anione stabilizzato per
risonanza
48
Legenda per rappresentazione molecole 3D
Atomo di ossigeno
Atomo di carbonio
Atomo di idrogeno
49
Chetoni
Cicloesanone
Propanone
2-Pentanone
50
Butanone
Aldeidi
Butanale
Propanale
Pentanale
51
Acetaldeide