Composti Carbonilici
1
Introduzione
• Due grandi classi di composti contengono il gruppo carbonilico:
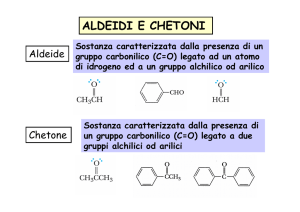
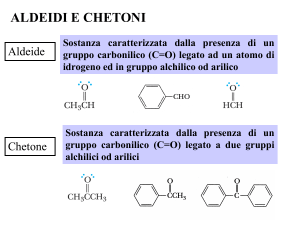
1. Composti che hanno solo atomi di carbonio e di idrogeno
legati al carbonile: aldeidi e chetoni.
O
C
O
C
H
R
aldeidi
R'
R
chetoni
2. Composti che contengono un atomo elettronegativo legato al
carbonile: acidi e derivati.
R
O
C
acidi
OH
R
O
C
Cl
cloruri acidi
R
O
C
O
O
C
anidridi
R'
R
O
C
OR'
esteri
R
O
C
N
ammidi
2
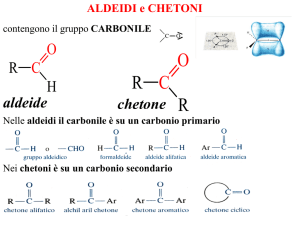
Il gruppo carbonilico
• Il gruppo carbonilico consiste di:
– un legame σ formato da
sovrapposizione di orbitali ibridi sp2
– un legame π formato da sovrapposizione di orbitali 2p.
• Il legame C=O è polarizzato verso l’atomo più elettronegativo,
rendendo il carbonio elettron deficiente.
• Usando la descrizione della risonanza il carbonile ha due forme
di risonanza.
C O
C O
contributo
maggiore
contributo
minore
δ+ δC O
ibrido
carbonile polarizzato
3
Aldeidi e Chetoni
4
Molecole che contengono il gruppo
carbonilico
O
O
O
H
H
H
HO
OCH3
aldeide cinnamica
geraniale
(E)-3,7-dimetil-2,6-ottadienale
vanillina
trans-3-fenil-2-propenale 4-idrossi-3-metossibenzaldeide
OH
O
O
O
O
testosterone
progesterone
canfora
5
Nomenclatura aldeidi
A. IUPAC
1. generale: alcanale (carbonio aldeidico #1)
2. aldeidi cicliche: cicloalcancarbossaldeide
3. priorità: aldeide > chetone > alcool
B. Nomi comuni
Usare il prefisso del nome comune dell’acido che si forma per
ossidazione, facendolo seguire da aldeide.
1 C: acido formico, formaldeide
2 C: acido acetico, acetaldeide
3 C: acido propionico, propionaldeide
4 C: acido butirrico, butirraldeide.
• In una molecola contenente un gruppo funzionale a priorità
maggiore, C=O è osso- e –CHO è formile.
• Aldeide priorità maggiore del chetone.
6
Nomenclatura chetoni
A. IUPAC
1. generale: alcanone (carbonio carbonilico # più basso)
2. priorità: aldeide > chetone > alcool
B. Nomi comuni
alchil alchil′ chetone (dagli alchili legati a C=O)
chetoni aromatici: fenoni
O
O
O
O
R
fenone
acetofenone
propiofenone
benzofenone
7
Proprietà Fisiche
Proprietà Composti con PM paragonabile: i p. eb. e p.f. seguono il solito trend.
Maggiori le forze intermolecolari, maggiore il p.eb o il p.f.
p. eb.
e p.f.
CH3CH2CH2CH2CH3
CH3CH2CH2CHO
CH3CH2CH2CH2OH
PM 72
p.eb. 36°C
PM 72
p.eb. 70°C
PM 74
p.eb. 118°C
VDW
VDW, DD
CH3CH2COCH3
VDW, DD, HB
PM 72
p.eb. 80°C
forze intermolecolari crescenti
p. eb. crescente
Solubilità
RCHO e RCOR solubili in solventi organici
RCHO e RCOR con <5C sono solubili in acqua
RCHO e RCOR con >5C sono insolubili in acqua
VDW = van der Waals, DD = dipolo-dipolo, HB = legame idrogeno
8
Formaldeide
• Gas a t.a.
• Formalina è una soluzione acquosa al 40%.
O
O
O
triossano
p.f. 62°C
H2O
O
calore
H
H
formaldeide
p.eb. –21°C
HO OH
H
H
formalina
• Esiste anche un polimero lineare della formaldeide che si
chiama paraformaldeide.
9
Preparazione di aldeidi e chetoni
• Aldeidi
– Ossidazione di alcoli 1° con PCC
– Riduzione di esteri e nitrili con DIBAL-H e cloruri di acidi
con LiAlH[OC(CH3)3]3
– Idratazione di alchini terminali per idroborazioneossidazione
• Chetoni
–
–
–
–
Ossidazione di alcoli 2° con reagenti di Cr6+
Reazione di cloruri di acidi con organocuprati
Acilazione di F.C.
Idratazione di alchini interni per idroborazione-ossidazione
10
Preparazione di aldeidi e chetoni
• Riduzione di esteri e nitrili con DIBAL-H e cloruri di acidi con
LiAlH[OC(CH3)3]3.
OBut
H Al OBut
OBut
Li+
H Al
Litio tri-tert-butilossialluminio idruro
Diisobutilalluminio idruro
• Essi sono meno reattivi di LAH, in parte perché stericamente
ingombrati.
O
R
Cl
O
R
OR'
R-C≡N
1) LiAlH(OBut)3, etere, -78°C
2) H2O
O
R
H
O
1) DIBAL-H, esano, -78°C
2) H2O
R
1) DIBAL-H, esano
2) H2O
R
H
O
H
11
Riduzione di esteri e nitrili e cloruri di acidi
• Meccanismo:
O
R
Cl
Al(OC(Me3)3
H
R
O Al[But]3
H
Cl
O Al[But]3
R C H
− Cl−
Cl
O Al[But]3
R C H
H2O
O
R
H
O
R
AlBui2
H
OR'
R-C≡N
AlBui2
H
R
O AlBui2
O AlBui2 H O
2
R C H
R C H
− −OR′
OR'
O AlBui2
H
OR'
R C N
AlBui
H
2
R C N
H
AlBui2
H2O
O
R
H
O
R
H
12
Reattività di aldeidi e chetoni
C O
basico
δ+ δC O
1. Formazione di legami H
2. Protonazione
Nucleofili dell’O
4. Addizione di alcoli
C elettrofilo
ADDIZIONE
NUCLEOFILA
3. Addizione di H2O (idratazione)
Nucleofili dell’N
5. Addizione-eliminazione di NH3
e derivati G-NH2
Nucleofili del C
6. Addizione ioni CN–
7. Addizione di organometallici
Nucleofili dell’H
8. Addizione di idruro
9. Riduzione catalitica ad alcoli
10. Riduzione C=O a CH2
11. Ossidazione di CHO a COOH
13
Reattività di aldeidi e chetoni
•
Le aldeidi sono più reattive dei chetoni verso i nucleofili per
ragioni steriche e elettroniche.
aldeidi
δ-
: O:
R
chetoni
: O:
H
ingombro sterico
minore
R
δ-
: O:
δ+
H
un solo R
stabilizza la
carica +
R
: O:
R
ingombro sterico
maggiore
R
δ+
R
due R
stabilizzano
la carica +
C meno
elettrofilo
14
Addizione Nucleofila
•
•
I carbonili reagiscono con i nucleofili carichi (:Nu−) o neutri
(:Nu). Se neutri, hanno un H legato (:Nu–H).
La presenza o assenza di un gruppo uscente sul carbonile
determina il tipo di reazione.
1. Aldeidi e chetoni subiscono addizione nucleofila.
O–
O
R
:Nu–
R
H (R')
H (R')
H2O
Nu
intermedio tetraedrico
O H
H (R')
R
Nu
Nu– e H+
si addizionano
2. I composti carbonilici che contengono un gruppo uscente
subiscono sostituzione nucleofila.
Nu– sostituisce Z–
O
R
:Nu–
Z
–
O
R
O
Z
Nu
–Z–
intermedio tetraedrico
Z = Cl, OH, OR, OCOR, NH2, NHR, NR2
R
Nu
Questa reazione è
chiamata sostituzione
nucleofila acilica:
RCO- era legato a Z
ora è legato a Nu.
15
Addizione Nucleofila ad Aldeidi e Chetoni
Quali Nu si addizionano al carbonile?
• Cl–, Br– e I– sono buoni nucleofili nelle sostituzioni al C saturo
ma sono inefficaci nelle reazioni al C insaturo.
– Quando essi si addizionano a un carbonile, si forma un
alcossido. Dato che X– è una base molto più debole
dell’alcossido, l’equilibrio è spostato verso i reagenti.
base forte
O
C
Cl–
base debole
O
C
Cl
alcossido
16
Addizione Nucleofila ad Aldeidi e Chetoni
Meccanismo:
O
O
C
C
C
Nu
Nu
Nu
H+
OH
intermedio
tetraedrico
Con alcuni nucleofili neutri l’addizione ha luogo solo con catalisi acida.
O
H+
OH
C
C
OH
C
HNu
HNu
–H +
OH
C
Nu
intermedio
tetraedrico
17
3. Addizione di H2O – Idratazione
• Per trattamento di un aldeide o chetone con H2O in presenza di
un acido o una base si ha addizione di H e OH sul legame π
C=O, generando un 1,1-diolo, gem-diolo o idrato.
R
OH
O
H–OH
C
H+ o –OH
H(R')
R C H(R')
OH
• La resa in gem-dioli è buona solo con aldeidi non ingombrate o
con aldeidi con gruppi elettron attrattori. Gruppi elettron
attrattori destabilizzano il carbonile favorendo la forma idrata.
O
H
C
H2O
H
OH
H C H
OH
O
Cl3C
C
H2O
H
OH
Cl3C C H
OH
18
3. Addizione di H2O – Idratazione
• Sia l’acido che la base catalizzano l’addizione di H2O al carbonile.
1. In base, il nucleofilo è –OH, più forte di H2O.
H OH
O
C
O
OH
C
C
OH
OH
+ OH
intermedio
tetraedrico
HO
2. In ambiente acido la protonazione dell’ossigeno del carbonile rende più
elettrofilo il carbonio.
H3O
H
O
O
C
C
H2O
H2O
H
OH
OH
C
C
O
OH
H
intermedio
tetraedrico
+ H3O
19
3. Addizione di H2O – Idratazione
• Aumentando il numero di alchili (elettron donatori) sul carbonio
carbonilico, diminuisce la quantità di forma idrata.
numero di R crescente
stabilità crescente del carbonile
H
O
C
H3C
H
formaldeide
H2O
OH
H C H
OH
O
C
H
acetaldeide
CH3
acetone
H2O
OH
H3C C H
OH
99.9%
H3C
O
C
H2O
OH
H3C C CH3
OH
58%
quantità di forma idrata crescente
0.2%
20
4. Addizione di Alcoli: Formazione di Acetali
• Aldeidi e chetoni reagiscono con 2 equivalenti di alcool per dare
acetali.
• La formazione di acetali è catalizzata da acidi come TsOH (acido ptoluensolfonico).
R
O
C
+ 2 R′′OH
R'
H+
H2O
gli acetali
non sono
eteri
R''O OR''
C
R
R'
acetale
• Quando si usa un diolo si forma un acetale ciclico.
O +
HOCH2CH2OH
etilenglicol
TsOH
O
O
+ H2O
• La sintesi di acetali è reversibile. Per favorirne la formazione si rimuove
l’acqua.
21
4. Addizione di Alcoli: Formazione di Acetali
Meccanismo:
1) Attacco nucleofilo al carbonile catalizzato da acido (1 eq di alcool)
O
C
R
O
H
R'
R
C
H
OH
R
R'
H
••
R"OH
••
2) SN1CA (1 eq di alcool):
OH
R
C
R' H
OR"
emiacetale
OH 2
R
C
R'
OR"
••
R"OH
••
R
R'
C
O
R"
C
O
R'
OH
-H
R
R
R'
OR"
R"
H
C
emiacetale
gen. instabile
O
C
R"
R'
OR"
-H
OR"
R
C
R'
OR"
acetale
22
4. Addizione di Alcoli: Formazione di Acetali
Esempi
O
CH O
3
CH3OH, H+
OCH
3
- H2O
O
OEt
EtOH, H+
H
OEt
- H2O
O
OH
HO
O
O
H+
OH
OH
cicloesanone
dimetil acetale
benzaldeide
dietil acetale
2-pentanone
etilene acetale
O
O
H+
O
23
Acetali come gruppi proteggenti
O
O
?
Br
H
O
Br
O
Br
HO
H
OH
1) HC CNa
H
protezione
del
carbonile
HC C
2) H2O
Br
l’addizione al
carbonile è più
veloce della SN2
C CH
OH
H+
O HC CNa
H
non reattivo
con nucleofili
O
HC C
O
H
O
H3O+
HC C
deprotezione
H
24
Acetali come gruppi proteggenti
O
O
?
Br
OH
O
O
incompatibili
Mg
MgBr
Br
OH
HO
H+
O
O
O
O
1)
Mg
O
2) H3O+
Br
MgBr
O
OH
25
4a. Emiacetali ciclici
• Emiacetali ciclici a 5 e 6 termini sono composti stabili isolabili.
OH
C legato a:
HO OR
un OH
un OR
emiacetale
O
O
O
HO
H
5-idrossipentanale
H
4-idrossibutanale
6%
O
=
O
C legati a:
un OH
un OR con R
parte dell’anello
OH
H
OH
=
O
HO
OH
H
OH
11%
O
94%
OH
O
89%
Sono reazioni intramolecolari, molto più veloci di quelle intermolecolari:
i gruppi reattivi OH e C=O sono spazialmente vicini.
26
5. Addizione Nucleofila di R−
• Il trattamento di un’aldeide o chetone con un organometallico (RLi,
RNa, RMgX, RZnX), seguito da acqua produce un alcool 1°, 2°, 3°.
• Il nucleofilo è R–.
R
O
C
R′′MgX
H (R')
H2O
o R′′Li
OH
R C H (R')
R''
• Il meccanismo è a due stadi.
Li
O
O–Li+
H–OH
H
H
attacco
nucleofilo
OH
H + LiOH
protonazione
(ac. debole)
intermedio
tetraedrico
27
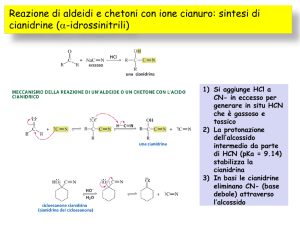
6. Addizione Nucleofila di −CN
• Il trattamento di un’aldeide o un chetone con NaCN e un acido forte
come HCl addiziona HCN sul carbonile generando una cianidrina.
• Il meccanismo è il solito.
O
R
C
O–
R C H(R')
H(R')
OH
H–CN
R C H(R') + –CN
CN
NaCN + H2SO4 → –CN
attacco
nucleofilo
intermedio
tetraedrico
CN
cianidrina
protonazione
• La reazione è reversibile in ambiente basico.
O H
R C H(R')
CN
–OH
O–
R C H(R')
CN
Keq > 100
aldeidi e chetoni
ciclici
Keq < 0.02
chetoni lineari
O
R
C
H(R')
+ −CN
28
Cianidrine come Intermedi di Sintesi
• Il ciano gruppo di una cianidrina può venir idrolizzato a gruppo
carbossilico per riscaldamento con un acido o una base acquosi o
può essere ridotto ad ammino gruppo (con un atomo di C in più).
OH
R C R'
CN
H2O
H+
o
–OH
OH
R C R'
COOH
α-idrossiacido
riduzione
1) LiAlH4
2) H3O+
OH
R C R'
CH2NH2
β-amminoalcool
29
La Reazione di Wittig
• La reazione di Wittig usa un carbonio nucleofilo (il reagente di Wittig)
per formare alcheni.
• Il gruppo C=O viene trasformato in C=C.
Ilide: una
R
C O
(R') H
Ph3P C
R
ilide del
fosforo
(R') H
C C
molecola che,
scritta nella
struttura di
Lewis, ha una
carica positiva
e una negativa
su atomi
adiacenti.
+ Ph3P=O
alchene
• Formazione dell’ilide:
– Nel primo stadio si forma il sale di fosfonio.
– Nel secondo stadio una base forte rimuove un protone dando l’ilide.
Ph3P:
+
CH3–Br
H
Bu–Li
Ph3P CH2 –BuH
metiltrifenilfosfonio
bromuro
SN2
Ph3P CH2
Ph3P CH2
ilide
carbonio nucleofilo
30
La Reazione di Wittig
• La reazione di Wittig è una addizione-eliminazione.
+
R
C O
R'
H2C PPh3
O PPh3
R C CH2
R'
betaina
O PPh3
R C CH2
R'
ossafosfetano
R
R'
C CH2
+
O=PPh3
trifenilfosfina
ossido
• La formazione del doppio legame P=O, molto forte, è la driving
force per la reazione di Wittig
• Quando il carbonio dell’ilide è sostituito si ottiene una miscela di
alcheni.
31
7. Addizione Nucleofila di Idruro H−
Riduzione di C=O a CHOH
• Fonti di idruro sono sodio boridruro NaBH4 (in acqua o alcool) o litio
alluminio idruro LiAlH4 (in etere anidro). NaH non va bene perché H– è
un Nu debole. Segue la protonazione che produce un alcool 1° o 2°.
• Il nucleofilo è H:¯
O
R
C
H(R')
NaBH4
LiAlH4
H2O
OH
R C H(R')
H
• Meccanismo:
–
–BH3 Na+
–
O–AlH3 Li+
O
H
H
Li+ H3Al–H
Na+ H3B–H
–
–B Na+
–
O––Al Li+ H–OH
H
H
4
intermedio
tetraedrico
attacco
nucleofilo
OH
H
+ LiOH
protonazione
32
Riduzione di C=O a CH2
1. Riduzione di Clemmensen: condizioni acide: Zn(Hg), HCl conc.,
riscaldamento.
O
R
C
Zn(Hg), HCl
R'
EtOH, 80°C
R–CH2–R′
2. Riduzione di Wolff-Kishner: condizioni basiche.
R
C O
(R') H
NH2NH2
R
C N
(R') H
NH2
1) NaOH, H2O, ∆
2) H3O+
R
CH2
(R') H
idrazone
3. Desolforazione di tiochetali (idrogenolisi): condizioni neutre
HS
O
SH
BF3, etere
Ni Raney
S
S
EtOH
33
Meccanismo della Wolff-Kishner
R
R
C N
(R') H
N H
H
C N
(R') H
N H
HO–
R
(R') H
R
C N
(R') H
N H
H2O
H2O
R
H C
(R') H
R
H C N
lento (R') H
N
–N2
R
H C N
(R') H
N H
si protona il
C-, più
basico di N-
–OH
carbanione
34
8. Addizione Nucleofila di Ammine e
Derivati
R
G-NH2
G
R
N
C
O
C
CH2R
R2NH
R
CH2R
immine
R
N
C
R
CHR
enammine
G = –H, –R, –OH, –NH2, –NHC6H3(NO2)2, –NHCONH2
35
Meccanismo Formazione di Immine
• È simile all’addizione di alcoli:
R
O
C
H+
CH2R
La formazione
dell’immina è
più veloce
quando il mezzo
è debolmente
acido (pH 4-5).
+
OH
C
R
CH2R
‥
G–NH2
+
HO NH2 G
C
R
CH2R
HO NHG
addizione
C
nucleofila
R
CH2R
carbinolammina
instabile
H+
G
R
N
C
CH2R
G +
+
NH
H2O NHG
disidratazione
C
C
R
CH2R −H2O R
CH2R
stereoisomeria
geometrica!
G = –H, –R, –Ar, –OH, –NH2, –NHC6H3(NO2)2, –NHCONH2
36
Meccanismo Formazione di Enammine
• La prima parte, addizione nucleofila, è uguale:
R
O
C
H+
CH2R
La formazione
dell’enammina è
più veloce
quando il mezzo
è debolmente
acido (pH 4-5).
+
OH
C
R
CH2R
‥
R2 NH
R
R
N
C
+
HO NHR2 −H+ HO NR 2
addizione
C
C
nucleofila
R
CH2R
R
CH2R
carbinolammina
H+
R
CHR
enammina
R + R
N
+
H2O NR2
C
disidratazione
R
CHR −H O
C
2
R
CH2R
H
ione immonio
37
Formazione di Immine
G = –H, –R, –Ar
Composto
carbonilico
‥
Immina
G–NH2
NH
O
+
‥
H–NH2
H+
cicloesilimmina
N
O
+
CH3NH2
H+
CH3
N-metilimmina
del 2-pentanone
O
H
NH2
+
H+
N
N-fenilimmina
della
benzaldeide
38
Formazione di Immine
G = –NH2, –NHC6H3(NO2)2, –NHCONH2
Composto
carbonilico
‥
Immina
G–NH2
O
HO–NH2
+
N
H+
OH
acetone ossima
idrossilammina
acetone
+
H2N–NH2
NNH2
H+
acetone idrazone
idrazina
NHNH2
NHN
H+
+
O2N
NO2
NO2
O2N
acetone 2,4dinitrofenilidrazone
2,4-DNP
2,4-dinitrofenilidrazina
O
O
H+
+
H2N
NHNH2
semicarbazide
H2N
NHN
acetone semicarbazone
39
Ossidazione delle aldeidi
O
R
C
O
[O]
R
H
[O] =
C
OH
CrVI
MnVII
CrO3 KMnO4
K2Cr2O7
Ag2O/NH3
OH
O
R
C
C
R
OH
H
H
CrO3
H3 O+
O2
O
R
C
OH
Alcune aldeidi sono ossidate facilmente:
O
O
H
Ag 2 O
NH4 OH, H2 O,
EtOH
OH
O2
aria
40
Ossidazione dei chetoni
• I chetoni sono inerti alla maggior parte degli agenti ossidanti.
– Subiscono lenta rottura in soluzione bollente alcalina di KMnO4.
O
1 . KMn O 4 , H2 O,
Na OH
COOH
2 . H3 O +
COOH
• Reazione di Bayer-Villiger:
O
O
R
C
+
R′′COOOH
R'
protonazione
chetone
O
–
R"COO
R′
C
O
R +
O–H
OH
RCR'
R−CR'
O−OCR′′
O
R′′COOH
R migra con ritenzione
di configurazione
attitudine migratoria:
3° > 2° > 1° > CH3
41
Ossidazione dei chetoni di J. Baeyer-Villiger
Esempi
O
O
O
CH3CO3H
O
non
O
CH3CO3H
O
OCH3
O
42