Chimica Organica
Definizione
La chimica organica è la chimica dei
composti contenenti carbonio
I carbonati, l’anidride carbonica e i cianuri metallici sono un’eccezione in quanto vengono
classificati come composti inorganici.
Il carbonio è l’unico elemento capace di legarsi fortemente con se stesso e formare
lunghe catene o anelli e allo stesso tempo capace di legarsi fortemente con elementi non
metallici come idrogeno, ossigeno, azoto e con gli alogeni.
Per queste sue proprietà questo elemento dà origine a miriadi di composti (sono noti
diversi milioni di composti, corrispondenti a circa il 98% di tutte le sostanze chimiche
note, e il loro numero continua a crescere)
Breve storia della chimica organica
Il termine chimica organica deriva dal fatto che una volta con questo
termine si definivano i composti che potessero essere sintetizzati da
organismi viventi, come ad esempio legno, ossa, vestiti, cibi,
medicine, e le sostanze complesse che formano il nostro corpo (in
antitesi con la chimica inorganica che era quella basata sui composti
sintetizzati artificialmente).
Questa teoria fu abbandonata nel 1828 quando il chimico tedesco
Friedrich Wohler preparò l’urea (componente dell’urina quindi
materiale chiaramento organico) riscaldando un sale inorganico: il
cianato di ammonio.
NH4 OCN
O
T
H2 N
C
NH2
Fu quindi evidente che una sostanza organica poteva essere
sintetizzata anche in laboratorio oltre che da organismi viventi.
Nonostante ciò si ritenne opportuno mantenere la vecchia divisione tra
materiali organici ed inorganici
Campi di interesse della chimica organica
Visto l’elevatissimo numero di composti organici esistenti, la chimica
organica riveste un ruolo fondamentale in innumerevoli campi. In particolare, la
chimica organica svolge un ruolo fondamentale per la comprensione dei sistemi
viventi. Come detto in precedenza gli organismi viventi sono composti
principalmente da molecole organiche e i meccanismi che permettono a
questi organismi di sopravvivere e riprodursi, possono essere scomposti in una
serie di semplici reazioni di chimica organica. La chimica organica e’ stata quindi
fondamentale per capire i processi biologici e per sintetizzare farmaci.
Un altro importante campo di applicazione della chimica organica è nella sintesi
dei materiali polimerici. I polimeri (o materie plastiche) sono infatti delle
molecole organiche e i processi di sintesi (polimerizzazione) sono delle reazioni di
chimica organica.
I composti del carbonio (in particolare quelli ottenuti dal petrolio) svolgono inoltre
un ruolo fondamentale nel soddisfare il nostro fabbisogno energetico
(riscaldamento, trasporti, illuminazione…..)
Nomenclatura Chimica organica
Nomi tradizionali e nomi IUPAC:
In passato si assegnavano i nomi alle molecole organiche in base alla loro
origine o a certe proprietà. Per esempio l’acido citrico deriva dal fatto che
si trova nel frutto del cedro, l’acido formico è sintetizzato dalle formiche o
la morfina induce il sonno (da Morpheus dio greco del sonno). Visto
l’enorme numero di composti organici che sono stati successivamente
scoperti, è stato necessario creare una nomenclatura sistematica che
potesse permettere una facile ed univoca identificazione di ogni
molecola organica. Le regole generali di questa nomenclatura sono state
codificate dalla International Union of Pure and Applied Chemistry
(IUPAC).
Per molti composti (in particolare quelli di uso più comune) viene ancora
utilizzato anche in campo scientifico il nome tradizionale accanto alla
nomencaltura IUPAC.
In queste lezioni verranno prima descritti gli idrocarburi alifatici e
aromatici e successivamente verranno descritti tutti gli altri composti come
derivati di queste molecole più semplici, per ogni classe di composti
verranno descritte :
• la formula generale,(di struttura e struttura semplificata)
• la nomenclatura,
•Proprietà (ibridazione C , solubilità, isomerie )
• le reazioni principali (preparazione e reazioni)
•usi in medicina
Nomenclatura IUPAC degli Alcani vedi file a parte n°15a
Sono elencate di seguito alcune delle regole principali, definite dalla IUPAC (International Union of Pure and Applied
Chemistry) per la nomenclatura degli alcani:
1. Si sceglie come struttura base la catena più lunga possibile.
2. Si considera il composto come derivato da questa struttura per sostituzione degli atomi di
idrogeno con gruppi alchilici.
[Si dicono alchilici quei gruppi che contengono un idrogeno in meno del relativo alcano. Il nome di
questi gruppi si ottiene semplicemente sostituendo con -ile il suffisso -ano dell'alcano
corrispondente: CH3-, metile; CH3-CH2-, etile; CH3-CH2-CH2-, propile; ecc.]
3. Si numerano gli atomi di carbonio della catena principale cominciando dall'estremità che
permette di usare i numeri più bassi per indicare i sostituenti.
4. Se lo stesso gruppo compare più di una volta come catena laterale, si aggiunge il prefisso di, tri-, tetra-, ecc.
5. Se vi sono gruppi alchilici diversi legati alla catena principale si elencano in ordine di
alfabetico (prima gli etili poi i metili, i propili,, ecc.).
6. I nomi IUPAC siscrivono in un’unica parola, i numeri sepatrati da virgole mentre numero e
lettera da un trattino es. 2,3,5- trimetileptano
7. Se ci sono due ramificazioni la numeraqzione inizia dall’estremità più vicina al sostituente
che viene per primo in ordine alfabetico
Elettrofili e Nucleofili
Elettrofilo: Si definisce elettrofilo un atomo, uno ione o una molecola
elettron-deficiente (quindi positivo o parzialmente positivo)) che mostra
affinità per una coppia elettronica e che perciò cercherà di legarsi ad un
nucleofilo
Nucleofilo: Si definisce nucleofilo un atomo, ione o molecola che possiede
una coppia di elettroni (quindi negativo parzialmentenegativo)che può
impegnare nella formazione di un legame chimico per reazione con un
elettrofilo
Le molecole polarizzate reagiscono con reattivi di carica opposta
NUCLEOFILO
Y
H
H
d+
C X
H
Se la molecola ha una parziale carica positiva, reagirà con reattivi che
hanno elettroni disponibili, i reattivi NUCLEOFILI
ELETTROFILO
H+
R
dO H
Se la molecola ha una parziale carica negativa, reagirà con reattivi che
hanno carica positiva, i reattivi ELETTROFILI
Classificazione degli atomi di carbonio
È spesso utile classificare un atomo di carbonio di
un alcano in base al numero di altri atomi di
carbonio a cui è legato.
Un atomo di carbonio potrà quindi essere detto:
primario, secondario, terziario o quaternario, a
seconda che leghi uno, due, tre o quattro altri
atomi di carbonio.
In chimica organica, si definisce carbocatione uno ione
positivo, derivato da una molecola organica, la cui carica
risiede su un atomo di carbonio.
La carica elettrica positiva rende la particella estremamente
reattiva, in grado di legarsi ad anioni o di sottrarre elettroni
da altre molecole vicine.
I carbocationi alchilici derivano dagli alcani ed hanno una
geometria simile a quella dei radicali alchilici: l'atomo di
carbonio che reca la carica positiva ha ibridazione sp2, ha
quindi struttura planare, l'orbitale p perpendicolare al piano
del carbocatione, non coinvolto
Carbocatione
modello del carbocatione metile,
l'ombreggiatura rappresenta l'orbitale p
vuoto
nell'ibridazione, è vuoto.
Similmente ai radicali, sono detti primari i
carbocationi alchilici aventi struttura R-
CH2+, secondari quelli aventi struttura
R2CH+ e terziari quelli aventi struttura
R3C+.
CH3-CH2-CH2-CH2+ carbocatione primario
CH3-CH2- CH-CH3 carbocatione secondario
+
+
CH3 - C -CH3 carbocatione terziario
I
CH3
Il carattere primario, secondario o terziario influisce sulla stabilità e sulla reattività carbocationi
in misura ancora maggiore a quanto avviene per i corrispondenti radicali.
A causa dell'effetto induttivo stabilizzante esercitato dai gruppi R vicini, l'ordine di stabilità dei
terziario > secondario > primario
carbocationi alchilici è
+ stabile
- stabile
I carbocationi possono essere anche stabilizzati per risonanza, quando sono coniugati a sistemi π quali
doppi legami o anelli aromatici.
+
CH2=CH-CH2+ ↔ .CH2-CH=CH2 carbocatione allilico
C6H5-CH2+ carbocatione benzilico
Processi Omolitici ed Eterolitici
Rottura di un Legame
Formazione di un Legame
Basicità e Nucleofilicità
Base
I (-)
Cl (-)
H2O
CH3CO2(-)
RS(-)
CN(-)
RO(-)
NH2(-)
CH3(-)
Acido
Coniugato
HI
HCl
H3O(+)
CH3CO2H
RSH
HCN
ROH
NH3
CH4
pKa
-9
-7
-1.7
4.8
8
9.1
16
33
48
Nucleophilicity: CH3CO2 (-) < Cl(-) < Br(-) < N3(-) < CH3O(-) < CN(-) < I(-) < CH3S(-)
Equilibrio e Velocità di una Reazione
aA + bB
[C]c[D]d
Keq. =
.
a
[A] [B]
-E/RT
Keq. = e
Reazione ad un singolo
stadio, endotermica
b
cC + dD
E = 0, Keq. =1
E > 0, Keq. <1
-E/RT
V= cost. e
E < 0, Keq. >1
Reazione ad un singolo
stadio, esotermica
Reazione a due stadi, esotermica
Idrocarburi
Sono i composti organici binari, costituiti solo da Carbonio e
Idrogeno
Saturi
Alifatici
alcani
alcheni
Insaturi
Idrocarburi
alchini
Aromatici
Idrocarburi saturi: presentano esclusivamente legami singoli carbonio-carbonio
Idrocarburi insaturi: contengono almeno un legame multiplo carbonio-carbonio
Idrocarburi saturi: alcani
•Ogni atomo di carbonio ha ibridazione sp3 ed è legato a 4 atomi mediante
legami s. Insolubili in acqua La famiglia degli alcani costituisce una serie
omologa cioè una serie di composti dove ogni membro differisce dal successivo di
un termine costante CH2 detto gruppo metilene
Formula generale degli alcani:
CnH2n+2
Se o < n > 4 = gas 5 < n>18 liquido
(n > 1)
n> 18 solido
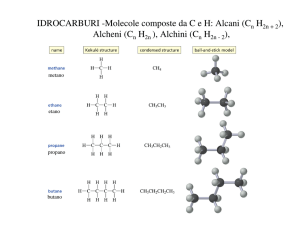
n=1
CH4
CH4
metano
n=2
C2H6
CH3-CH3
etano
n=3
C3H8
CH3-CH2-CH3
propano
n=4
C4H10 CH3-CH2-CH2-CH3
butano
Alcani: struttura tetraedrica del carbonio
Rappresentazione tridimensionale della molecola di CH4.
Dalla teoria è prevedibile che la geometria
imposta dalle coppie elettroniche attorno
all’atomo di carbonio centrale del CH4 sia
tetraedrica e può essere descritta in termini di un
atomo di carbonio che lega quattro atomi di
idrogeno con ibridazione sp3.
109°28
C
Struttura tetraedrica che mostra l’angolo di
legame
Modello per la rappresentazione
“planare”
Modello “ball and stick”
Modello “space filling”
Alcani: rotazione intorno al legame s
La rotazione lungo l’asse carbonio-carbonio non influenza la
sovrapposizione dei due orbitali sp3 che formano il legame
carbonio-carbonio e quindi non modifica l’energia di legame. Per
questo motivo la rotazione intorno all’asse C-C è libera.
Ricordiamo!!
Definizione di isomero
Si definiscono isomeri due o più molecole aventi stessa formula molecolare ma
differente formula di struttura.
Esistono vari tipi di isomeria:
Costituzionale o Strutturale: gli atomi di carbonio sono legati tra di loro in maniera differente
(per esempio isobutano e normalbutano).(cambia l’ordine)
Stereoisomeria: gli stereoisomeri presentano gli stessi legami ma differiscono per il modo in
cui gli atomi sono orientati nello spazio.
Esistonoi due tipi di stereoisomeria :Isomeria Conformazionale e Configurazionale
Abbiamo. isomeri conformazionali gli isomeri che possono trasformarsi l’uno nell’altro
senza la rottura di legami (per esempio le diverse conformazioni anti e gauche del n-butano).
Isomeria Configurazionale si divide in
Si chiamano isomeri geometrici i diastereoisomeri che debbono la loro esistenza alla
mancanza di libera rotazione intorno ai doppi legami (isomeria cis/trans nel 2-butene).
Si chiamano isomeri ottici ( legata all’atomo di C asimmetrico)gli isomeri che non sono
sovrapponibili alla loro immagine speculare.( enantiomeri) Per trasformare uno
stereoisomero nell’altro è necessario rompere e riformare almeno un legame. Si chiamano
diastereoisomeri gli stereoisomeri che non sono uno l’immagine speculare dell’altro
Conformazioni degli alcani
La barriera di energia per passare da una conformazione all’altra è di circa 3kcal/mol e di
conseguenza può avvenire con velocità alta già a temperatura ambiente
Conformazioni degli alcani
Le conformazioni A e B sono dette gauche e presentano un angolo diedro tra gruppi metilici di 60°,
mentre la conformazione C è detta anti e presenta un angolo di 180°. La conformazione anti è più
stabile delle gauche di circa 0,9 kcal/mol a causa delle minori interazioni repulsive tra i gruppi
metilici.
Alcani: isomeri di struttura
Per n>3 esistono più isomeri di struttura. Le diverse strutture di
queste molecole portano a differenti proprietà chimiche e fisiche
Modello ball and sticks
n-butano
isobutano
CH3 CH2 CH2
Modello space filling
CH3
CH3 CH CH3
CH3
Gli alcani a catena lineare sono chiamati normali (n-). Gli altri sono detti
ramificati
Nomenclatura degli alcani
•Gli alcani con n< 4 hanno nomi particolari
•Per n>4 il nome degli alcani si ottiene aggiungendo il suffisso - ano alla radice greca del
numero di atomi di carbonio (pent- per cinque, es- per sei etc.). Per un idrocarburo
ramificato la radice del nome è determinata dalla catena più lunga di atomi di carbonio
•6 atomi di C esano
•Quando gli alcani fungono da sostituenti essi vengono denominati sostituendo il suffisso ano con il suffisso -il. Sono chiamati gruppi alchilici.
CH3
CH2
CH3 CH2
CH2
CH CH2 CH3
CH3
CH2 CH3
CH2 CH2 CH3
CH3 CH CH3
metil
etil
propil
isopropil
Nomenclatura degli alcani
•La posizione dei sostituenti è specificata numerando la catena più lunga
in modo essi abbiano il numero più piccolo
1
CH3
6
2
CH2
5
3
CH2 4 2
1
CH3 CH2 CH3
Numerazione corretta
4
Numerazione non corretta
CH3 CH2
5
6
3-etilesano
•Quando sono presenti diversi sostituenti vanno elencati in ordine
alfabetico usando i prefissi di-, tri-, etc. per indicare la presenza di
sostituenti uguali
Cicloalcani
Oltre a formare catene, gli atomi di C possono formare degli anelli. I cicloalcani sono
anelli formati esclusivamente da gruppi CH2
Formula generale dei cicloalcani:
CnH2n
Il più semplice è il ciclopropano C3H6 in cui gli atomi di C
formano un triangolo equilatero con angoli di 60°; gli orbitali ibridi
sp3 non si sovrappongono estesamente e ciò provoca un legame C-C
debole ed in tensione e la molecola è molto più reattiva del
propano. Analogamente si comporta il ciclobutano (angoli di 90°).
Al contrario il cicloepentano e il cicloesano sono abbastanza
stabili perché i loro anelli hanno angoli di legame più vicini
all’angolo del tetraedro. (TEORIA DELLE TENSIONI DI
LEGAME)
C
C
(n > 3)
C
Reazioni : di addizione fino a n=4 poi sostituzione
Il ciclopropano veniva usato in medicina come anestetico generale
N.B. è esplosivo!
Cicloalcani condensati
I più importanti nel nostro organismo derivano dal
ciclopentanoperidrofenantrene (es colesterolo)
Cicloalcani: nomenclatura
La nomenclatura segue le stesse regole adottate per gli alcani. Si
premette il prefisso ciclo- e l’anello viene numerato in modo da
avere i numeri più bassi per i sostituenti.
CH2 CH3
6
5
1
4
2
3
CH3
1-etil-3-metilcicloesano
La Conformazione del Ciclopropano
Cicloesano: strutture a barca e sedia
Questi due protoni tendono a respingersi
Conformazione a
barca
Conformazione a
sedia
Non si hanno interazioni tra protoni e di
conseguenza questa è la forma più stabile
Gli idrogeni in rosso sono detti equatoriali mentre
quelli in blu sono detti assiali
Le Principali Conformazioni dell'Anello del Cicloesano
Nomenclatura dei CicloAlcani Semplici
Nome
Formula
Molecolare
Struttura
Condensata
Ciclopropano
Ciclobutano
Ciclopentano
Cicloesano
Cicloeptano
Cicloalcano
C3H6
C4H8
C5H10
C6H12
C7H14
CnH2n
(CH2)n
Struttura
Lineare
La Nomenclatura dei cicloalcani non sostituiti è molto semplice: basta mettere il prefisso "ciclo"prima del nome dell'alcano con il corrispondente numero di
atomi di carbonio
Reazioni degli alcani
Gli alcani sono poco reattivi ma possono reagire ad alta temperatura
•Reazione di combustione:
Reazione tra l’alcano ed ossigeno con formazione di CO2 e H2O. Reazione esotermica.
C4H10(g) + 13/2 O2
4 CO2 + 5 H2O + cal
•Reazioni di sostituzione radicalica
hn
CH4 + Cl2
CH3Cl + HCl
hn
CH3Cl + Cl2 hn
CH2Cl2 + HCl
CH2Cl2 + Cl2
CHCl3+ HCl
hn
CHCl3 + Cl2
CCl4+ HCl
clorometano
diclorometano (clouro di metilene)
triclorometano (cloroformio)
tetraclorometano
La reazione avviene con un meccanismo di SOSTITUZIONE radicalica:
Cl2
hn
2Cl•
Il Cl• è molto reattivo e capace di attaccare il legame C-H
Alcani - reazioni
In particolare la reazione di
Combustione:
CH3-CH2-CH3 + 5 O2
___
>
3 O=C=O + 4 H2O + calore
Due punti importanti riguardanti questa reazione:
(1) Poichè tutti i legami covalenti presenti nella molecola di reagente vengono rotti, la
quantità di calore svolto dipende dal numero e dalla forza di questi legami.
(2) La stechiometria dei reagenti è molto importante. Se è presente una quantità di
ossigeno insufficiente, nei prodotti di reazione sarà presente anche monossido di
carbonio, un gas altamente tossico.
CH3-CH2-CH3 + 4 O2
___
>
O=C=O + 2 CO + 4 H2O + calore
Meccanismo della SOSTITUZIONE Radicalica degli Alcani
Meccanismo della Bromurazione Radicalica
First step
•Br
R
R
C
H
R
H-Br
Second step
R
R
Br-Br
C•
R
•Br
Utilizzi degli alcani
USI IN MEDICINA
= gli alcani sono poco reattivi e incopatibili con la vita
cellulare Da ricordare il ciclopropano come anestetico generale
Idrocarburi insaturi: alcheni
Gli alcheni sono idrocarburi con un legame doppio C=C dovuto all’ibridazione
sp2.
Formula generale degli alcheni:
CnH2n
(n > 2)
La nomenclatura è simile a quella degli alcani:
•Il nome di base dell’idrocarburo finisce in -ene
•Il doppio legame è indicato dall’atomo di Carbonio a numerazione più bassa
CH2 CH CH2
CH3
1-butene
CH3 CH
CH3
2-butene
CH
H
H
6
H3C
5 2 CH
4
CH
C
CH
3
2
CH2
CH3
1
4-metil-cis-2-esene
Idrocarburi insaturi: alcheni
Orbitali molecolari dell’etilene
Negli alcheni i carboni dei doppi legami presentano ibridazione sp2. Il legame sC-C è
formato per accoppiamento di due elettroni presenti negli orbitali sp2 e il legame p per
accoppiamento di elettroni p.
I due orbitali p sui due atomi di carbonio dell’etilene devono essere allineati
(paralleli) per poter formare legami p. Questo impedisce la rotazione dei due gruppi CH2
l’uno rispetto all’altro a temperatura ordinaria, contrariamente agli alcani per i quali è
possibile la libera rotazione.
Alcheni: isomeria cis/trans
Attorno agli atomi di C uniti mediante il doppio legame la rotazione è impedita. Ciò
comporta il manifestarsi dell’isomeria geometrica. Ad esempio il 2-butene esiste in due
isomeri geometrici.
Cis 2-butene
H
H
C=C
C=C
CH3
CH3
H
CH3
CH3
H
Trans 2-butene
Idrocarburi insaturi: alchini
Gli alcheni sono idrocarburi con un legame triplo carbonio carbonio dovuto
all’ibridazione sp.
Formula generale degli alchini:
CnH2n-2
(n > 2)
La nomenclatura fa uso del suffisso -ino ed è analoga a quella degli alcheni
1
2
CH3 CH2
3
C
4
C
5
6
CH
7
CH2 CH3
5-etil-3-eptino
CH2
CH3
Anche gli idrocarburi insaturi possono esistere in strutture cicliche
Idrocarburi insaturi: alchini
Orbitali molecolari dell’acetilene
Negli alchini i carboni del triplo legame presentano ibridazione sp. Il legame s C-C è formato
per accoppiamento di due elettroni presenti negli orbitali sp e i 2 legami p per accoppiamento
di due coppie di elettroni p.
Analogamente agli alcheni, anche per gli alchini la rotazione intorno all’asse C-C è impedita a
temperatura ordinaria.
Reazioni di alcheni e alchini
Le principali reazioni sono reazioni di addizione elettrofila con rottura di legami π che sono
più deboli dei legami s.
Gli elettroni π esercitano nel legame un'azione molto minore degli elettroni σ e inoltre si
trovano ad una distanza maggiore dal nucleo: sono quindi meno saldamente legati e perciò più
disponibili per un reattivo alla ricerca di elettroni. Il doppio legame risulta, in definitiva, una
«sorgente di elettroni»;
Le più importanti sono:
Addizione di H2 Reazioni di idrogenazione
CH2 CH CH3
+
Pt
H2
CH3 CH2 CH3
Addizione di alogeni Reazioni di alogenazione
CH2 CH CH2
+
CH3
Br2
Pt
CH2 CH
Br
Addizione di acqua Reazione di idratazione
CH2 CH3
Br
Addizione di Acidi
Un’altra importante reazione degli idrocarburi insaturi è la reazione di polimerizzazione. Tra gli
esempi più importanti di polimeri ottenibili da idrocarburi insaturi ci sono il polietilene, il
polipropilene, il polibutadiene e il polistirene.
cat.
n CH2 CH2
CH2 CH2
n
Il meccanismo della reazione di addizione elettrofila
a:
•Alcheni simmetrici
•Alcheni asimmetrici (regola di Markovnikov)
•Teoria del carbocatione (spiegazione della regola di
Markovnikov)
MECCANISMO dell’Addizione Elettrofila agli alcheni simmetrici
H
H
C
H
C
+
H
+
H
H
C +
H +
H
C +
1o Stadio
H
H
H
H
H
-
Br
H
H
H
H
H
Br
C
C
H
2o Stadio
H
La reazione di addizione all'etene non richiede particolari commenti: i due atomi di carbonio impegnati nel
doppio legame sono infatti perfettamente equivalenti e avremo comunque un unico prodotto.
Non è così nel caso di un termine superiore all'etene, qualora i due atomi di carbonio insaturi si trovino in
una "condizione elettronica" diversa
Orientazione nelle Reazioni di Addizione agli Alcheni:
La regola di Markovnikov
H
Cl
H
H
H
C
C
H3C
Propene
+ HCl
H
H
C
H3C
H
H
C
H
C
H
2-Cloropropano
Cl
C
H
H3C
1-Cloropropano
non si forma
In questi casi, la reazione di addizione segue la regola di Markovnikov
Nell'addizione ad un doppio legame carbonio-carbonio, l'addendo positivo
(generalmente un protone) si lega al carbonio che ha già il maggior numero di
idrogeni legati a sé». La regola di Markovnikov trova giustificazione nella stabilità
del carbocatione che compare come intermedio nella reazione di addizione.
Razionalizzazione della Regola di Markovnikov
No favored
Ogni considerazione sulla stabilità deve essere basata sull'intensità della carica del carbocatione: più la carica è
intensa, maggiore è l'energia potenziale della molecola, minore la sua stabilità.
Poiché il carbocatione secondario porta due gruppi alchilici sul carbonio che ospita la carica positiva, questa sarà
più "indebolita" e quindi meno intensa che nel carbocatione primario. Il carbocatione secondario è dunque più
stabile ed è quello su cui andrà ad addizionarsi l'addendo negativo (o la base) nella reazione di addizione.
L'addizione elettrofila ad un doppio legame carbonio-carbonio implica la
formazione del carbocatione intermedio più stabile e cioè dell'ordine
maggiore possibile
Addizione di acqua
Tra le reazioni di addizione al doppio legame, ne ricorderemo una che ha un
particolare interesse biochimico: l'addizione di acqua.
Gli alcheni sono inerti rispetto all'acqua pura: la dissociazione in H3O+ e OH- è
infatti troppo piccola (10-7 M) per poter dar luogo a reazioni elettrofile. In
ambiente acido, la reazione di addizione invece avviene, con formazione di un
alcol, secondo il consueto meccanismo e in accordo con la regola di
Markovnikov
Con etene si ottiene etanolo (alcol etilico), con propene 2-propanolo
Prova a fare la reazione
Stato di ossidazione del C (abituarsi a vedere in quale
stato di ossidazione è il carbonio)
CH
-4
4
R
C H3
-3
R C H2
C H 2 OH
-2
-1
+1
O
R
C
H
+2
C=O
+3
R
+4
C
O
OH
C02
Idrocarburi aromatici
Orbitali molecolari del benzene
Regola di Huckel
i composti aromatici devono
avere
4n + 2 elettroni p
o Un numero dispari di doppietti
Gli elettroni p sono delocalizzati
su tutto l’anello
Formule di risonanza: si
ha risonanza quando una
molecola può essere
rappresentata da due o più
strutture ad energia simile che si
differenziano solo per la
disposizione degli elettroni
Idrocarburi aromatici
La completa delocalizzazione dei sei elettroni in un
unico orbitale contenente sei elettroni è rappresentato
graficamente con un anello interno all’esagono nei cui
vertici sono collocati i sei atomi di carbonio.
H
H
H
H
H
a
H
b
Il benzene risuona fra le due forme limite.
Il passaggio dall’una forma all’altra si verifica
per semplice spostamento di cariche elettriche.
H
H
H
H
H
H
H
H
H
H
H
H
Nel benzene tutti gli atomi di carbonio hanno
ibridazione sp2 degli orbitali di valenza.
I sei orbitali pz paralleli non ibridati di ciascuno dei sei
atomi di carbonio contengono un elettrone
H
H
H
H
H
H
I 10 carboni del naftalene sono tutti ibridati sp2 e
ciascuno di essi contribuisce con 1 elettrone alla
aromaticità dell’idrocarburo
Regola di Huckel per prevedere il
comportamento aromatico di composti ciclici
e-p = 4n + 2
o un numero dispari di doppietti
n = serie dei numeri naturali
n e-p
2
1 6
2 1
3 14
416
.
.
Composti aromatici policiclici
benzene
naftalene
antracene
fenantrene
Esempi di composti non aromatici
ciclooctatetraene
ETEROCICLICI AROMATICI
furano
piridina
Benzene + Pirrolo
tiofene
pirrolo
indolo
imidazolo
Pirimidina + Imidazolo
purina
Idrocarburi aromatici: nomenclatura
La nomenclatura dei derivati del benzene è simile a quella usata per i sistemi ciclici
saturi.
In presenza di più sostituenti la loro posizione è indicata con i numeri
6
5
4
Si possono anche usare i prefissi
orto- (o-)
meta- (m-)
para- (p-)
3
1
Cl
2
Cl
1,2-diclorobenzene
sostituenti adiacenti
sostituenti distanziati da un atomo di C
sostituenti contrapposti
Cl
Cl
Cl
Cl
Cl
Cl
o-diclorobenzene
m-diclorobenzene
p-diclorobenzene
Idrocarburi aromatici: nomenclatura
Alcuni derivati del benzene hanno nomi tradizionali. Tra questi i più importanti sono:
CH3
CH3
1,4-dimetilbenzene
(para-xilene)
metilbenzene
(toluene)
CH3
Il benzene è la molecola aromatica più semplice; sistemi più complessi possono essere
visti come degli anelli benzenici “fusi”. Queste molecole sono dette composti aromatici ad
anelli condensati
naftalene
antracene
Quando il benzene funge da sostituente è detto gruppo fenile.
fenantrene
Reazioni del benzene
Reazioni del benzene
Il benzene non dà reazioni di addizione poiché queste lo trasformerebbero in
un prodotto meno stabile, distruggendo il sistema aromatico dell'anello.
Il prodotto avrebbe cioè un'energia potenziale maggiore del reagente.
Per fare un'addizione sul benzene occorre fornire molta energia (condizioni piuttosto
drastiche); di conseguenza non è possibile alcun controllo della reazione. Infatti, una
volta iniziata l'addizione, il prodotto (diene) si trova ad un livello energetico molto più
alto del benzene (è più instabile e molto più reattivo) e poiché trova le condizioni per
reagire ancora, si trasforma direttamente in un composto ciclico saturo, che è ad un
livello energetico inferiore rispetto al diene (o all'alchene) intermedio.
In definitiva, qualsiasi reazione di addizione sul benzene porta alla
saturazione di tutti i legami p.
Il benzene tende a dare piuttosto reazioni di sostituzione
Analogamente agli alcheni, per il fatto di avere una nuvola
elettronica p delocalizzata, il benzene si comporta come una
base.
Le sostituzioni che tenderà a dare saranno quindi di tipo
elettrofilo, cioè con reagenti alla ricerca di elettroni
Le reazioni di sostituzione tipiche del benzene sono:
1.
nitrazione
2.
solfonazione
3.
alogenazione
4.
alchilazione
5.
acilazione
Il meccanismo di reazione della sostituzione elettrofila è
rappresentato di seguito:
1. Il sostituente elettrofilo si avvicina all'anello lateralmente rispetto al piano della molecola.
2. Si ha una azione di richiamo sugli elettroni p del benzene e uno dei legami psi polarizza in
modo da consentire
3. l'attacco del sostituente, che sfrutta una coppia di elettroni p per legarsi.
4 - 6. Si forma un intermedio instabile, detto complesso s, al quale contribuiscono tre differenti
forme risonanti (4,5,6). L'atomo che ha subito l'attacco ha cambiato il suo stato di ibridazione
da sp2 a sp3, per cui esso è escluso dalla "coniugazione" col resto del sistema. Anche se si può
ancora parlare di risonanza , non si può più parlare di aromaticità.
7. L'energia di risonanza di questo catione non è elevata come quella del benzene; l'espulsione
di un protone può tuttavia riportare il complesso s alle condizioni di aromaticità.
8. Si ottiene così il prodotto sostituito finale.
Meccanismo generale di sostituzione elettrofila aromatica
addizione
elettrofila
eliminazione
Carbocatione arilico stabilizzato per risonanza