Incontro famiglie VHL
Padova, 1 ottobre 2016
LA GENETICA MEDICA E IL VHL
Isabella Mammi
Genetista Medico
Sindrome di von Hippel Lindau (VHL)
• Sindrome autosomica dominante con elevata penetranza (oltre 90% a 65
anni), espressività variabile
• Incidenza: 1:36.000 nati vivi, 20% dei casi sono mutazioni “de novo”
• Età media alla diagnosi 26 anni (ma variabile età infantile-70 anni)
• Conferisce predisposizione allo sviluppo di multiple lesioni cistiche e di
neoformazioni benigne e maligne a livello di diversi organi
Difetto genetico
• Gene VHL, oncosoppressore, localizzato sul braccio corto del cromosoma 3
(3p25.3), coinvolto nei meccanismi di controllo della proliferazione cellulare
• Nei tessuti delle lesioni VHL un allele del gene è ereditato mutato, il secondo
allele viene inattivato per mutazione somatica (second hit)
=
Esame cromosomico (10 Mb)
VHL
=
Analisi molecolare (bp)
Il codice genetico
La traduzione
….ATTACAGGGATTATTGGGTATAGCGGCAGC..
….TAATGTCCCTAATAACCCATATCGCCGTCG..
ATT ACA GGG ATT ATT GGG TAT AGC GGC AGC …
C
I
O
CIOCCOLATA
C
C
O
L
A
T
A
Le malattie genetiche monogeniche
Le malattie genetiche sono causate da alterazioni
(mutazioni) del patrimonio genetico di un individuo
ATT ACA GGG ATT ATT GGG TAT AGC GGC AGC …
C
I
O
CIOCCOLATA
C
C
O
L
A
T
A
ATT ATA GGG ATT ATT GGG TAT AGC GGC AGC …
C
R
O
C
CROCCOLATA
C
O
L
A
T
A
ATT ACA GGG ATT … GGG TAT AGC GGC AGC …
C
I
O
CIOCOLATA
C
C
O
L
A
T
A
ATT ACA GGG ATT …
C
CIOC
I
O
C
…
…
…
…
AGC …
A
TEST GENETICO
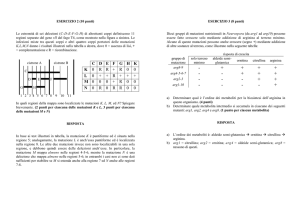
TRASMISSIONE AUTOSOMICA DOMINANTE
ETEROZIGOTE = Affetto
M N
Persona affetta
(eterozigote)
N N
50%
N N
M N
N N
N M
Indipendente
dal sesso
MUTAZIONE VHL:
80% ereditata
20% «de novo»
CONSULENZA GENETICA ONCOLOGICA
Il singolo
soggetto
La famiglia allargata
Il nucleo familiare
Rischio di trasmissione alla prole attuale
?
Alla prole futura:
pianificazione familiare
Opzioni riproduttive
OPZIONI RIPRODUTTIVE E POSSIBILITA’ DIAGNOSTICHE
NON AVERE FIGLI
GRAVIDANZA SPONTANEA
No test (diagnosi
postnatale, età variabili)
ADOZIONE
GRAVIDANZA MEDIANTE
Procreazione Medicalmente Assistita
(PMA)
Da fecondazione eterologa
Diagnosi Prenatale
Da gameti propri (conservati o non)
Diagnosi preimpianto
Diagnosi Prenatale (PND)
Non medicalizzare il concepimento
Probabilità di successo relativamente alta
Proteggere il figlio dalla mutazione e dai suoi effetti
Proteggere una figlia da chirurgia radicale
preventiva
Evitare il senso di colpa di aver trasmesso una
malattia
Diagnosi Preimpianto (PGD)
Sicurezza di feto non affetto fin dall’inizio della gravidanza
Partecipazione attiva ad un processo qualificato
Prevenire la trasmissione sia a maschi che a femmine
Eliminare la mutazione dalla propria discendenza
Evitare alla prole di dover fare scelte riproduttive
No test
Evitare di dover scegliere per ivg
Evitare lo stress e la medicalizzazione delle procedure PMA
Fiducia negli sviluppi terapeutici futuri
Fiducia nella possibilità di sostenere i figli ev. mutati
Natura della HBOC (late onset, penetranza incompleta,
possibilità di prevenzione)
Diagnosi Prenatale (PND)
Paura della disapprovazione
Potenziali conseguenze sulle relazioni
Timore di reazioni negative dai conoscenti
Natura della HBOC (late onset, penetranza incompleta,
possibilità di prevenzione)
Interferenza con i processi naturali della procreazione
Diagnosi Preimpianto (PGD)
Potenziale effetto dell’iperstimolazione sulla
neoplasia
Necessità di PMA anche se fertili
Stress derivante dalla procedura PMA
Perdita del processo naturale del concepimento
Dilemma in caso di insuccesso
Se maschio carrier, senso di colpa per la compagna
Decisioni in merito a embrioni maschi affetti
Ancora medicalizzazione!
Bassa percentuale di successo
CONSULENZA GENETICA
PRECONCEZIONALE/PRENATALE
Conoscenze aggiornate su un argomento eterogeneo (oncologia, genetica,
ostetricia, scienza della riproduzione, psicologia) richiedono
assolutamente una multidisciplinarietà!!
Esperienza nel counseling, empatia
NON DIRETTIVITA’ !!
Aim to enabling individuals to choose a course of action
which seems to them appropriate in view of their risk,
their family goals, and their ethical and religious
standards and act in accordance with that decision
Am J Hum Genet 1975;27:240
Laboratorio Biologia
molecolare
Resp. Francesca Schiavi
Psicologa
Marina Lorusso
Equipe
U.O. Tumori
Ereditari
Genetista Medico
Isabella Mammi
Infermiera
Case Manager
Roberta Pozzani
Massimiliano Ferrara
Silvia Rizzati
Stefania Zovato
Equipe
Diagnosi Prenatale
Equipe PMA
Giuseppe Opocher
CARCINOGENESI
??
TEMPO
GENETICA
ORMONI
AMBIENTE
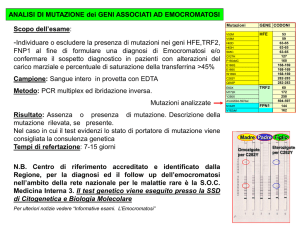
TIPI DI MUTAZIONI GENICHE
Mutazione Germinale
Mutazioni in
cellule uovo
o spermatozoi
Mutazione Somatica
Tutte le
cellule
mutate
• Presente in tutte le cellule uovo
e spermatozoi
• Sono ereditabili
Localizzata in
cellule tumorali
• Insorgono in tessuti non germinali
• Non sono ereditabili
• Alterazioni acquisite comuni per
tutti i tipi di cancro
Cellula normale
germinale
Rapporto geni cancro
CANCRO SPORADICO
somatica
Prima mutazione
Seconda mutazione
Terza mutazione
successive mutazioni
Cellula cancerosa
Cellula normale
germinale
Prima mutazione
Rapporto geni cancro
CANCRO EREDITARIO
somatica
Seconda mutazione
Tutte le cellule
dell’organismo portano la
mutazione
Terza mutazione
Aumento del
rischio di cancro
successive mutazioni
Cellula cancerosa
Mutazione nelle
cellule germinali =
possibile trasmissione
alla prole
DIAGNOSI DI S. VHL
=
Diagnosi di neoplasia
o di predisposizione a neoplasia
in soggetto sano in giovane età
?
La persona/coppia viene posta
davanti a decisioni inattese
riguardo la programmazione della
famiglia futura (reale o ipotetica)
RISCHIO DI RICORRENZA
Persona affetta
(eterozigote)
Indipendente dal sesso
50%