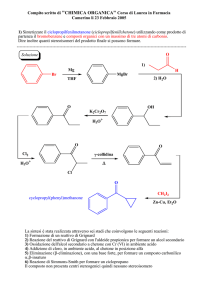
MECCANISMI DI REAZIONE
IN
CHIMICA ORGANICA
Corso di Laurea in Chimica (Laurea Magistrale) A. A. 2009-2010
Che cosa si intende per MECCANISMO DI REAZIONE
?
Descrizione, istante per istante, del cammino degli atomi (e dei loro
elettroni) da prima che le specie in reazione si avvicinino a dopo che
si è formato il prodotto.
.....impossibile!
Ottenimento di informazioni ci possano fornire un quadro delle specie
che partecipano alla reazione in uno o più istanti cruciali, nel coso della
reazione stessa.
in pratica
un insieme di esperimenti può portare all'esclusione di certi
meccanismi, lasciando però possibile un certo numero di altri
meccanismi.
Gi esperimenti si possono sudividere in:
- metodi cinetici
- metodi non cinetici
F
Prima di iniziare a studiare il meccanismo, è necessario
conoscere la stechiometria.
1
1. STECHIOMETRIA
REAGENTI
A
aA + bB + cC + ....
PRODOTTI
X
xX + yY + zZ + ....
(a, b, c, ..., x, y, z, ... = numero di moli di A, B, C, ..., X, Y, Z)
2. PROCESSO ELEMENTARE o NO?
Se la trasformazione ha luogo attraverso una sequenza di intermedi (Ik):
...........
I1
I2
In-1
In
A
Con nessun intermedio
con
n intermedi
X
UNO STADIO
n+1 STADI
Studiare il meccanismo di una reazione significa
studiare gli STADI della reazione stessa.
Informazioni che si cercano nello studio del meccanismo di una reazione:
1. numero di stadi elementari (numero di intermedi)
2. struttura degli intermedi
3. sequenza degli intermedi (degli stadi elementari)
4. velocità degli stadi elementari e velocità globale
5. requisiti stereochimici
6. sequenze e modi di rottura e formazione di legami
7. eventuale ruolo di sostituenti, solventi e catalizzatori
2
METODI NON CINETICI PER LA DETERMINAZIONE
DEI MECCANISMI DI REAZIONE
1. ANALISI DEI PRODOTTI
L'identificazione dei prodotti di reazione è il primo passo nello
studio di un meccanismo
esempi:
a) Clorurazione del metilbenzene
CH2Cl
CH3
hν
+ Cl2
+
HCl
CH3
CH3
FeCl3
Cl
HCl
+
+
Cl
qualunque sia, dall'analisi dei prodotti è evidente che il meccanismo
nelle due condizioni di reazione è diverso
b) Reazione con cianuro di potassio di cloruri primari di tipo benzilico
CH2Cl
CH2 C N
+
O
CH2Cl
+ Cl-
CN-
+ CN-
N
C
O
CH3
+ Cl-
qualunque sia, dall'analisi dei prodotti è evidente che il meccanismo
con i due substrati è diverso
c) Reazione di tosilati alchilici con nucleofili
O
CH3
O S O CH2 C CH3
CH3
O
O S O+ I-
CH3
CH3
H3C C CH2 I
CH3
+
CH3
3
O
O S O-
O
O S O CH2 C
CH CH O CH3
+ CH3O-
+
CH3
CH3
qualunque sia, il meccanismo con i due reagenti deve essere diverso
Ipotesi di meccanismo accettabile
spiega la formazione di tutti i prodotti
isolamento, identificazione ed analisi quantitativa dei prodotti
E’ importante assicurarsi che il bilancio di massa della reazione sia
completo
E pericoloso trarre conclusioni sul meccanismo basandosi
su un prodotto presente in resa bassa, se non si conoscono
gli altri prodotti d reazione
esempio
FATTI SPERIMENTALI:
CH3
HNO3
CH3
CH3
NO2
+
CH3CO2H
O
O
+
NO2
56.5%
CH3
CH3
CH3
CH3
CH3
+
CH3 C O O C CH3
NO2
40.0%
3.5%
CH3
+
CH3
56.5%
26.5%
CH3
17.0%
Ad una prima osservazione, la distribuzione dei prodotti sembrerebbe
analoga (anche se l'elevata percentuale di prodotto 1,3- dovrebbe
mettere in guardia)
4
Il meccanismo della nitrazione aromatica è noto: si tratta di un processo
in due stadi, con formazione, nello stadio lento, dell'addotto σ.
La distribuzione dei prodotti dipende dall'effetto del sostituente sulla
stabilità dell'addotto σ.
CH3
CH3
CH3
H
+
NO2
H+
CH3
NO2+
+
lento
NO2
veloce
CH3
H
NO2
veloce
H+
CH3
NO2
CH3
+
veloce
H+
H NO
2
NO2
e la reazione con perossido di acetile?
Ad un esame più attento sono stati trovati in piccola quantità altri prodotti:
prodotti secondari:
CO2
CH4
CH3CH3
CH2CH3
reazione radicalica!
O
O
CH3 C O O C CH3
2
CO2
+ 2
.CH
3
5
CH3
H
.
CH3
.
3
lento
CH3
3
CH3 veloce
CH3
.CH
CH3
.CH
+ CH4
CH3
.CH
3
H veloce
CH3
CH3
.CH
.
CH3
CH4
.
.
CH4
+
CH4
3
veloce
H CH
3
+
CH3
CH3
CH2
.CH
+
CH2 CH3
3
.
CH2
CH2
+
.CH
3
+ .CH3
CH3CH3
Talvolta è l'assenza di un prodotto che porta ad escludere
un meccanismo
O
CH
esempio:
CH2Cl
H2O
+ (CH2)6N4
C
meccanismo proposto:
CH2 N CH2
O
CH
H2O
+
CH3 NH2
mai trovata
Altre volte un prodotto inatteso mette in evidenza l’esistenza di un
meccanismo alternativo:
esempio
Cl
O 2N
OH
+ -OH
O 2N
SN2
però.....
6
tra i prodotti è stato trovato l’1,2-di(4nitrofenil)etene, che non si può
formare con l’SN2!
NO2
O 2N
O 2N
Cl
-
-OH
Cl
Cl
O2N
O 2N
H2O
NO2
NO2
-OH
Cl
H2O,Cl-
O 2N
O 2N
2. ISOLAMENTO DEGLI INTERMEDI
Esempio: trasposizione di Hofmann:
R-CO-NH2 + NaOBr
R-NH2 + CO2 + NaBr
intermedi isolati: N-bromoammide (RCONHBr) ed isocianato (RNCO)
..
R-CO-NH2
Br2
..
R-CO-NH-Br
HBr
..
R-CO-NH-Br
-OH
H2 O
.. R-CO-N-Br
..
.. R-CO-N-Br
..
..
R-CO-N:
Br -
..
R-CO-N :
..
O=C=N-R
H2O
..
O=C=N-R
R-NH2 + CO2
7
reazione
I
A
si tratta di un
intermedio
X
reazione
reazione
A
NON è un intermedio
X
I
Se si isola un composto che si pensa sia un intermedio, si mette nelle
stesse condizioni di reazione: per essere un intermedio si deve
trasformare negli stessi prodotti, con una velocità non inferiore a
quella della reazione a partire dai reagenti.
esempi:
a) Reazione di Reissert
N
C
C N
H
CHO
HCl
H 2O
O
N
C
O
NH2
+
si osserva la formazione di un intermedio di colore arancione-rossiccio
intermedi proposti:
N
C
e
C N
N
però
N
C
N
NH2
C
H O
O
NH2
C
H O
O
C N
composto arancione-rossiccio
CHO
+ HCl + H2O
+ HCl + H2O
N
+N
Cl-
O
8
b) Reazione di Clemmensen
O
Zn
C
HCl
H H
OH
possibile intermedio:
C
OH
però
Zn
CH
non è un intermedio
HCl
c) Reazione dell'urea con alcooli
O
2 R OH +
C
H2N
veloce
R
NH2
possibile intermedio:
H
N
O
O
R
O
O
R
O
NH2
O
però
R
O
R OH
NH2
R
lento
O
H
N
O
O
O
R
O
non è un intermedio
Nell’idrogenazione catalitica degli alcheni (catalizzatore di Wilkinson) sono stati
isolati due composti
H
Ph3P
Cl
H
Ph3P
PPh3
PPh3
Ph3P
Rh
Cl
Rh
Ph3P
Cl
Rh
Rh
Messi nelle condizioni di reazione
sono risultati poco efficaci
PPh3
Cl
PPh3
PPh3
H2
PPh3
Solv
H
Ph3P
Cl
Rh
H
PPh3
PPh3
Solv
H
Ph3P
Cl
Ph3P
Ph3P
Cl
Rh
Rh
Cl
Rh
Solv
H2
PPh3
Ph3P
Cl
Rh
H
H
Solv
Ph3P
Cl
PPh3
Rh
H
PPh3
H
PPh3
H
PPh3
H
H
Ph3P
Cl
Rh
Solv
PPh3
9
Raramente gli intermedi sono abbastanza stabili da essere isolati.
Negli altri casi bisogna ricorrere a metodi indiretti
rilevamento mediante metodi fisici
intrappolamento mediante metodi chimici
3. RIVELAZIONE DI INTERMEDI E DETERMINAZIONE
DELLA LORO STRUTTURA
intermedi instabili
non isolabili
Possono essere "visti" con metodi spettroscopici
UV
IR (RAMAN)
NMR
ESR
L’intermedio deve avere una vita sufficientemente lunga per essere compatibile con il
tempo di risposta della tecnica spettroscopica e formarsi in quantità sufficientemente
alta per la sensibilità della tecnica stessa.
Bisogna dimostrare che:
-l’intermedio osservato spettroscopicamente è effettivamente un
intermedio del meccanismo studiato
- la risposta spettrale sia proprio dell’intermedio proposto e non di
qualche altra specie sconosciuta.
ESEMPI
NO2+ è isoelettronico con CO2. La frequenza Raman caratteristica di CO2 è
ν = 1332 cm-1.
Nella nitrazione aromatica:
H2SO4 +
H
+O
H
H2O +
NO2
H
H
+ NO2+
NO2 + HSO4
ν = 1400 cm-1
NO2+
H
H
+O
H
..
O NO2
NO2
NO2
HSO4-
+
H2SO4
UV
L'idrolisi dell'acetato di p-nitrofenile è catalizzata da imidazolo
..
N
NO2
O
H 3C
O
+ H2O
N
H
NO2
O
H3 C
+
OH
HO
Quale è il ruolo dell'imidazolo? Sono stati proposti due meccanismi
10
Meccanismo A (Catalisi basica generale)
N
+
N
H
H 3C
O
-O
NO2
O
+
H 3C
H 3C C O
OH
H
N+
NO2
+
+ -OH
N
H
NO2
O-
NO2
+ -OH
O
H
N+
H
:O
H
OH
N
NO2
+
N
H
-O
HO
N
H
Meccanismo B (Catalisi nucleofila)
O
H3C
C
..
N
NO2
+
O
NO2
OH3 C C O
N+
N
H
N
H
NO2
-O
O
+
+ HCCN
3
O
NO2
C
+ H3C N
N H
HO
O
H3C
C
H
+ :O
N
H
N
N
O
H3C
C
N
OH
+
N
H
O
H 3C
C
N
composto noto, preparabile in modo indipendente
N
SPERIMENTALMENTE
UV, λmax= 245 nm
si osserva un massimo a 245 nm, che aumenta con
il tempo e poi scompare
11
ESR
In grado di rivelare specie radicaliche con vita 1 secondo e concentrazione 10-7M
a bassa temperatura si può prolungare la vita dei radicali fino a 10 minuti
:O-
OH
+ 2
OH
O
.
O
-OH
2 H2O
:O-
:O-
e
e
O
.
O
dà all'ESR un quintetto (accoppiamento con 4 H, resi equivalenti
dalla delocalizzazione elettronica)
:O-
NMR
Vengono rivelate solo specie con tempo di vita superiore al tempo di risposta
dello strumento
esempio:
CH3 CH2 CH CH3 + SbF5
F
F-
+
CH3 CH2 CH CH3
F
+
CH3 C CH3
CH3
Spettri NMR di
carbocationi,
registrati in
SbF5-SO2ClF, a -60°C
12
Spettro NMR di
+ CH
in SO2
Spettro NMR
del catione
1-adamantile
+
(Chemically Induced Dynamic Nuclear Polarization)
CIDNP
NMR
Se nel corso della reazione si formano specie radicaliche, alcune righe dello spettro
presentano un aumento di intensità (assorbimento stimolato, A), mentre altre righe
presentano un'emissione (emissione stimolata, E).
Riscaldando il perossido di dipropanoile in un tubo NMR in presenza di benzentiolo,
si forma radicale etile, che reagisce con il benzentiolo, formando etil fenil solfuro.
OO
CH3 CH2 C
C CH2 CH3
O O
.
CH3 CH2 +
SH
O
Δ
2 CH3 CH2 C
.
O
.
2 CH3 CH2
2 CO2
S CH2 CH3
13
Se si registra lo spettro NMR dell'etil fenil solfuro durante la reazione, l'etile è:
spettro CIDNP
spettro normale
Gli spin nucleari dell'etil fenil solfuro subiscono polarizzazione dinamica a
causa della reazione chimica che sta producendo la molecola.
Il meccanismo della polarizzazione CIDNP è complesso e l'effetto osservato
(E o A) dipende dal modo con cui gli stati di spin nucleare interagiscono con
gli spin elettronici dei radicali.
L'osservazione di effetto CIDNP durante una reazione costituisce una prova
di meccanismo radicalico (ma la mancata osservazione, da sola, non permette di escluderlo).
F
esempio:
F
F
F
F
F
F
F
.
F
Δ
+
O
F
F
Cl
O
C
F
C
C
O O
F
F
OO
F
2
F
F
F
F
Cl
.
O
C
F
Cl
O F
O C
.
O
.
F
+
H
F
F
F
O
H
segnale con effetto CIDNP
F
O C
F
F
F
F
sperimentalmente
effetto CIDNP negli spettri 1H e 13C NMR
14
IR
metodi criogenici (matrice di argon solido, a bassa temperatura)
esempio:
nella sostituzione nucleofila aromatica con meccanismo eliminazione-addizione si
forma un intermedio
Possibili strutture:
H
H
H
H
H
H
.
H
H
H
.
H
cicloalchino
H
biradicale ciclico
H
cumulene
O
O
O
O
hν (λ > 340nm)
8K
CO2
O
O
IR
CO2
Una strategia per caratterizzare intermedi a vita troppo breve è generarli
in un mezzo in cui non siano possibili reazioni
persistenza
Mezzo stabile per ioni
Per esempio, generare carbocationi in assenza di qualsiasi nucleofilo
metodo praticabile solo se l’intermedio non reagisce con se stesso
per esempio, non va bene per i radicali
Isolamento in matrice
L’intermedio viene generato in un solvente solido (congelato)
O
CH3
2-metiltetraidrofurano
Forma un vetro a bassa
temperatura
La matrice sopprime tutte le reazioni bimolecolari (ma non i processi unimolecolari)
CH3.
in vetro stabile indefinitamente a temperatura ambiente
15
LASER
spettroscopia picosecondi
Permette di rilevare specie transienti
esempio
a) irradiazione con un raggio laser intenso per alcuni picosecondi
reazione fotochimica
b) irradiazione con laser più debole per alcuni picosecondi
registrazione dell'assorbimento della luce in funzione del tempo
velocità di decomposizione dell'intermedio
esempio:
I2
hν (λ=530nm), CCl4
2 I
la concentrazione di I raggiunge il massimo dopo 20 ps e diventa il 25%
dopo 140 ps
il 75% di I torna a I2 nella gabbia del solvente
4. INTRAPPOLAMENTO DI INTERMEDI
Un metodo per identificare un intermedio è quello di intrappolarlo aggiungendo un
altro reagente
Gli intermedi reattivi hanno vita breve e perciò la “trappola” deve essere
MOLTO REATTIVA, per competere con la reazione in esame.
Intermedi elettrofili possono essere intrappolati con specie nucleofile (e viceversa).
BrBr CH2 CH2 Br
CH2 CH2
Br2
Br-
ClC2H4Br+
Br
CH2 CH2 Cl
Br
CH2 CH2 ONO2
NO3-
questo però non chiarisce la struttura dell'intermedio:
+
Br
ione bromonio ciclico
o carbocatione a catena aperta
CH2 CH2
Br +
CH2 CH2
?
16
Per intermedi radicali
R
.
R'
O
N
O
N
R
reagenti di spin trapping
.
O
R + ON
R'
hν
CH3
H3C C N O
CH3
.
N Br
N
Br
O
.
N
O
N
.
.
CH3
C CH3
CH3
O
N
O
O
O
R
R'
R
R
R
O
R
.
R'
radicale nitrossido
ESR
Anche intermedi neutri possono venire intrappolati
Esempi
Cl KNH2
NH2
+ KCl
NH3
Cl
intermedio:
Cl
KNH2
H
HCl
NO
NH2
NH3
benzino
?
NH2
-
intermedi neutri facilmente intrappolabili sono quelli con l'ottetto incompleto
R
R
+ C N N
hν o Δ
R
N2
diazo composto
R' CH
R
C:
R
CH2
H
H
H
R'
ciclopropano
R
carbene
R
N
.. + R N N N
azide
hν o Δ
N2
..
R N:
R' CH
CH2
H
R'
H
H
aziridina
nitrene
(azaciclopropano)
17
Problema:
MgBr
+
BrMg
C C O
C C O
C C OMgBr
OH2
l'addizione avviene al
C=O o al C=C?
C C O
H
Risposta
oppure
C C O
intrappolamento dell'intermedio
prima del trattamento con acqua si aggiunge alla miscela di reazione un elettrofilo
molto reattivo, che si lega al sito nucleofilo
O
C
Cl
C
INTERMEDIO
C
O
O
C
l'addizione avviene
al C=O
(purché il prodotto non subisca trasposizione durante l'isolamento)
La natura di un intermedio può essere messa in evidenza sintetizzando un
substrato simile a quello in esame, ma con una variazione strutturale che
permetta all’eventuale intermedio di reagire in modo nuovo, ma prevedibile.
esempio
L’enzima mandelato racemasi interconverte gli enantiomeri dell’anione dell’acido 2idrossifenilacetico (acido mandelico).
OH
OH
H
CO2-
Mandelato racemasi
H
CO2-
18
OH
-
intermedio proposto:
CO2-
Per verificare la formazione del carbanione, è stato preparato l’acido p-bromometilmandelico, che è stato trattato con l’enzima.
O
OH
Br
H+
OH
OH
-
CO2-
Mandelato racemasi
H
CO2-
CO2-
CO 2
Br
Il risultato conferma l’ipotesi della formazione del carbanione
5. REAZIONI DI COMPETIZIONE
Un esperimento di competizione comporta l’aggiunta di due o più reagenti, che
competono per uno o più intermedi.
Il rapporto dei prodotti derivati dai diversi tipi di intrappolatori dà
il rapporto delle costanti di velocità corrispondenti
esperimento fattibile solo quando la reazione di intrappolamento è sotto
controllo cinetico
Trap 1
SUBSTRATO
Prodotto 1
INTERMEDIO
Trap 2
Prodotto 2
esempio
Nell’idrolisi di RNA e DNA è stata proposta la formazione come intermedi di specie
pentacoordinate (fosforani)
O
OH
O
O P
Per verificare l’ipotesi, è stata studiata la chimica di
O
sistemi modello, come il fosfoestere
19
Il fosfoestere può ciclizzare per dare un fosforano
OH
O
O OH
P O
O O
O
O P
O
fosforano (pentacoordinato)
mai visto a temperatura ambiente
però, aggiungendo cloruro di acetile all'estere:
O
OH
O
O
O P
O
O
O
+
Cl
O
O
O
O P
O
O
P O
O O
O
+
L’esperimento ha dimostrato che
– Il fosforano è presente in una soluzione di fosfoestere
– i fosforani sono intermedi ragionevoli
Reazioni simili possono procedere attraverso lo stesso intermedio:
Br
H2O
OH
+
I
H2 O
Per verificare se l’intermedio è lo stesso, si può effettuare un esperimento di
competizione: i prodotti risultanti si devono formare nello stesso rapporto.
esempio
Controllo dell’eventuale intermedio comune nelle alchilazioni alliliche catalizzate da Rh
M
Complesso π η3-allile, struttura molto
comune nelle reazioni organometalliche
(ibrido di risonanza)
M
M
I complessi π-allile possono essere attaccati da nucleofili al C, con formazione di
sistemi allilici estesi.
Con esperimenti di competizione è stato dimostrato che, nel caso
dell’alchilazione di Rh allile, l’intermedio non è simmetrico
20
Carbonati allilici non simmetrici, fatti reagire con una quantità catalitica di
Rh(PPh3)3Cl, darebbero prodotti con lo stesso rapporto se l’intermedio fosse
simmetrico:
O
O
O
O
O
Rh
Rh(PPh3)3Cl cat.
Na+ -
O
O
CH(CO2Me)2
CH(CO2Me)2
+
97
O
O
:
3
O
O
O
Na+ -
Rh(PPh3)3Cl cat.
O
O
CH(CO2Me)2
CH(CO2Me)2
+
Questo risultato si interpreta con
un complesso del Rh σ+π
3
:
97
6. ESPERIMENTI STEREOCHIMICI
tecniche
PROBLEMA: natura dell'intermedio cationico
della bromurazione
CH3
Br2
C C
H
H
cis-2-butene
Br-
H3C
H
CH2 CH2
o
H
CH3
C C H
Br
+
+
Br
Br +
CH2 CH2
H3C
BrH 3C
IR, NMR, CD, ORD
Br
C C CH
3
Br
H
(R,R)-2,3-dibromobutano
Br
H 3C
H
C
C C H
Br
(S,S)-2,3-dibromobutano
21
BrCH3
H
C C
H3C
H
H3C
Br-
trans-2-butene
Br
+
C
H C
H3C
infatti
Br-
Br
CH3
H
Br2
C C H
H
H3C
Br
+
CH3
C C H
Br
(R,S)-2,3-dibromobutano
reazione non stereospecifica
con sostituenti che stabilizzano il carbocatione
si perde la specificità
X
I risultati dello studio stereochimico confermano l'assenza di processo sincrono
C C
H
Br
H
CH3
H3C
CH3
H3C
//
H
(R,S)-2,3-dibromobutano
C C H
Br
Br
Br
Altri esempi:
H
CO2H
H
CO2H
OsO4
acido cis-butendioico
(acido maleico)
CO2H
O
O
H
Os
H
O
O
CO2H
CO2H
NaClO3
H
H
OH
OH
CO2H
acido (R,S)-2,3-diidrossibutandioico
acido meso-2,3-diidrossibutandioico,
acido meso-tartarico
Metodo molto usato per distinguere tra SN1 e SN2
OHBr
MeCN
OH
H2O
+
Br
OH
OH
22
H3 C
(R)
Cl-
H
CH3OH
C+
C Cl
H
H 3C
H+
CH3
C OCH3 + CH3O C
H (R)
(S) H
CH3
miscela racemica
intermedio
carbocatione
planare
=/
CH3OC Cl
H3 C
δδCH3O ..........C .......... Cl
H
(R)
H
CH3O C
Cl-
CH3
(S)
H
CH3
7. ESPERIMENTI DI MARCATURA ISOTOPICA
CH3-I* + I-
CH3-I + I*-
isotopi radioattivi
3H, 14C, 35S
marcatura parziale
isotopi stabili
2H, 13C, 15N, 18O
marcatura parziale o
completa
1
2π
ν=
IR
tecniche utilizzate
k
μ
SPETTROMETRIA DI MASSA
Esempio: idrolisi basica degli esteri
con l'aiuto di 18O sono stati dimostrati vari meccanismi
BAc2
O
H 3C
C
+
18OH-
O CH2CH2CH2CH2CH3
O
H3C C
18 OH
-
+ O CH2CH2CH2CH2CH3
OH3C C O CH2CH2CH2CH2CH3
18
OH
O
H3C C
18 O-
+ HO CH2CH2CH2CH2CH3
sensibile agli effetti sterici
Questo è il meccanismo più comune
Se il C acilico è ingombrato stericamente, l'attacco del nucleofilo può avvenire
sull'alchile
23
CH3
BAl2
H 3C
C
CH3
H3C CH3
C CH3
CH3
O
H 3C
+
C
C
H 3C
O CH3
C
CH3
H 3C
CH3
CH3
O
18OH-
+
O CH3
O
C 18
H 3C
-
18OH
C
+
O-
CH3
H3C CH3
C CH3
O
+
C
O
C CH3
H3C CH3
HO CH3
18
HO CH3
La marcatura isotopica sull'alcool permette di escludere il meccanismo BAc2, ma non
permette di distinguere tra BAl2 e BAl1
BAl1
O
C
CH3
C+
O
CH3
O C CH
3
CH3
C
H 3C
+ 18OH
O-
+
CH3
C+
CH
CH3 3
18
H 3C C O H
H 3C
CH
CH3 3
Esempio: trasposizione di Claisen
OH
O
Δ
hν
Reazione termica:
D
D
O
OH
O
Δ
D
D
24
Reazione fotochimica:
D
D
D
O
OH
OH
hν
Si deve formare un
frammento allilico libero
D
D
D +
50
:
50
HO
Esempio: idrolisi dei piranosidi
O+
R'O
HO
acido
+ ROH
NH
Path A
O
HO
O
OR
R'O
HO
SCISSIONE ESOCICLICA
HO
NH
O
OH
OR
+
R'O
HO
acido
NH
Path B
O
Calcoli di dinamica molecolare hanno
suggerito che nei processi catalizzati da
enzimi sia operativo il percorso endociclico
+
O
H+
D OH
D
O
SCISSIONE ENDOCICLICA
CD3OD
O
D OH
D
+ HO
O
+
OCD3
D OH
D
OCD3
O
D OH
D
H+
CD3OD
O
D
OH
O
D
OH
+
O
O
D
D
O
+
OCD3 D
D
OCD3
D
O
D
Con questo metodo si è trovato che circa il 15% della reazione procede
attraverso il percorso endociclico
25
8. ESPERIMENTI DI CROSSOVER
si utilizzano per determinare se la reazione è INTERMOLECOLARE o
INTRAMOLECOLARE
Per effettuare questo tipo di esperimenti si usano due substrati simili, uno dei quali
“etichettato” per distinguerlo dall’altro
La variazione strutturale deve essere la più piccola possibile
A B
C D +
+ A* B*
A B
C D +
+ A* B*
C* D*
C* D* + C*
intramolecolare
D + C D*
intermolecolare
Esempio: trasposizione benzidinica
H+
NH NH
EtOH/H2O
difenilidrazina
H2N
H2N
NH2 + H2N
30%
70%
2,4'-diamminobifenile
difenilina
4,4'-diamminobifenile
benzidina
in solventi aprotici si formano anche altri prodotti:
H 2N
NH2
H2N
NH
NH2
2,2'-diamminobifenile
orto-benzidina
N-fenil-1,2-diamminobenzene
orto-semidina
NH
N-fenil-1,4-diamminobenzene
para-semidina
processo intramolecolare o intermolecolare?
esperimenti con miscele di reagenti che differiscono per i sostituenti
dato sperimentale:
MeO
O Me Me O
NH NH
+
O Et
Et O
H+
EtOH/H2O
H2N
H2 N
Et O
NH2
+
O Et
H2N
NH NH
MeO
O Me
NH2
O Et
NH2
NON OSSERVATO
La formazione dei bifenili deve avvenire con un processo intramolecolare
26
dato sperimentale:
CH3 O
15
CH3 O
NH NH
1. H+
+
CD3 O
2. Ac2O
NH NH
15
NH
CD3 O
NH
+
O
NH
NH
O
Anche la formazione delle difenilammine deve avvenire con un processo intramolecolare
MECCANISMO
PROPOSTO
formazione di un intermedio doppiamente protonato
formazione di legame C-C sincrona alla rottura di legame
N-N
perdita di protoni con riaromatizzazione
H
H
+
H2N ............NH2 =/
H
N N
+ +
H+
NH NH
H
..............+
δH
H
primo intermedio
diprotonato
+
H2N
H
H
+
NH2
H2N
H+
ultimo intermedio
diprotonato
H+
H2 N
stato di transizione
sincrono
H
+
NH2
intermedio monoprotonato
NH2
Questo meccanismo spiega la formazione (intramolecolare) della benzidina,
ma non quella degli altri isomeri
+
NH2NH2
secondo intermedio protonato
+
complesso π
rotazione 0°
i rotameri del complesso π portano agli altri prodotti:
27
+
NH2NH2
0°
H2 N
.....+
+
H2 N
NH2NH2
.....
0°
2 H+
+
NH
.. 2
..
60°
NH2
NH2
+
NH2
NH
+
2 H+
2 H+
NH NH
NH2
2 H+
H2 N
NH2
+ ....
120°
+
NH2
2 H+
NH2
H2 N
NH2
120°
+
.....
2 H+
NH NH
H2 N
+
NH2
2 H+
NH
.. 2
.. .
+
180°
//
H 2N
NH
2 H+
NH2
+
altre evidenze sperimentali indicano che la p-semidina si ottiene attraverso un
intermedio monoprotonato
=/
H
H
N
.
+
.. +
.. +
NH2
NH
H
:
N
. ..
NH NH2
. ..
H
Le conclusioni che si possono trarre dall'indagine sperimentale, basata soprattutto
sugli esperimenti di crossover sono:
1. la benzidina (4,4,'-diamminobifenile) si forma con un meccanismo
sincrono
2. l'o-semidina (N-fenil-1,2-diamminobenzene) e la difenilina (2,4'-diamminobifenile) si formano per scissione del legame N-N e rotazione del
complesso π risultante
3. la p-semidina si forma probabilmente con un meccanismo (sincrono) che
comporta trasposizione sigmatropica [1,5].
28
Talvolta un meccanismo può essere intermolecolare o intramolecolare, a
seconda dei sostituenti
Trasposizione di Beckman
Esempio
ossima
substrato
catalizzatore
H3C
CH3
C
C
N
H2SO4 conc.
acido polifosforico
PCl5
O
alogenuri acilici
H
N
OH
Di solito migra il gruppo in posizione trans all'OH, dal C all'N.
H2SO4 conc.
CH3
C
N
N
H2O
OH
+
N
H 3C C
H3 C C
C
+
O SO3H
H3 C
C
H
O+
H 3C
H
O
C
N
N
+
H3 C C
=/
HSO4-
+
N
H2O
..... . . .C CH3
..........
δ+ ... .
.N
... δ..
OSO3H
CH3
H
H+
N
catione nitrilio
rivelato con 1H NMR; intrappolato (con alcool)
ione nitrilio
H3 C C N
+
OEt
+
EtOH
H3 C C
N
immino estere
con H218O:
18
O
H 3C C N
+
+ H218O:
quando si può formare carbocatione stabile
H3 C C
N
H
reazione intermolecolare
29
H3C CH3
H3 C C
N
H3 C
OH
} {
+
H3C C N C(CH3)3 +
H+3C
N C
H3 C
C
CH3
H3 C C
N
{
+
H3C C N + C(CH3)3 +
OH
{
}
H3 C +
C
N +
H3 C
C
}
H3 C
+
+
H3 C C N C
H3 C
O
O
+ H 3C C
H3 C C
NH C(CH3)3
+
N C(CH3)3
C
CH3
O
C
+
NH C
}
CH3
NH C
CH3
CH3
O
C
+
NH C(CH3)3
La trasposizione di Beckmann è stata investigata con studi computazionali, usando
tre substrati e due gruppi di solventi, H+(AcOH) e H3O+(H2O)6. Calcolando le energie
dei possibili intermedi e stati di transizione, gli autori hanno concluso che il
meccanismo dipende dal tipo di ossima:
H 3C
+
C N
OH
H3 C
H3C C N CH3 + H2O
+
H3C C N CH3 + H2O
H+
+
C N
OH
H3 C
+
H 3C C N
CH3
C N
H
+ H3 C
O
H
+ H 2O
O
HO
C N
C N
H3 C
H
H
HC
H+ 3
+ H
+
N
OH
CH3
C N+
H
H3 C
HO
+
H+
H+
N
N
OH
H+
H
O
L’ossima dell’acetone dà un intermedio carbocationico, che nel caso dell’ossima
dell’acetofenone è preceduto da un intermedio in cui c’è partecipazione del fenile;
invece l’ossima del cicloesanone dà la migrazione senza formazione di intermedi.
(J. Org. Chem. 2005)
30
esempio
Eliminazione riduttiva di metano dal complesso planare quadrato del Pt
Ph3P
H
Pt
Ph3P
Ph3P
CH3
Pt
PPh3
+
CH4
Rottura del legame C-Pt con formazione di CH3.?
Esperimento di crossover:
Ph3P
Pt
Ph3P
CH4
40%
H
CH3
Ph3P
+
Ph3P
D
Pt
CD3
+ CH3 D + CD3 H + CD4
1%
1%
Viene esclusa anche la formazione di specie
bimetalliche Pt-Pt
Ph3P
Ph3P
intramolecolare
40%
H
meccanismo sincrono
=/
Pt
CH3
UN RISULTATO NEGATIVO VA INTERPRETATO CON CAUTELA: l’assenza di
rimescolamento (scrambling) non esclude la frammentazione, se la ricombinazione
dei frammenti avviene più velocemente della diffusione.
9. “RADICAL CLOCKS”
E’ difficile ottenere informazioni su quello che succede dopo lo stadio rate-determining
Nel caso di reazioni radicaliche, è possibile ottenere informazioni, incorporando nel
substrato in esame dei gruppi funzionali che diano radicali che possono riarrangiarsi,
con una velocità nota.
Sono disponibili gruppi la cui velocità di riarrangiamento varia in
un intervallo di 10 ordini di grandezza
O
.
.
.
.
O
k (25°C) = 59 s-1
k (25°C) = 10 s-1
N
.
k (25°C) = 71 s-1
N
+
.
N
N
.
.
k (25°C) = 7.8 x 102 s-1
31
O
.
.
O
.
.
k (25°C) = 9.8 x 103 s-1
O
k (25°C) = 1.3 x 103 s-1
O
O
O
O
.
.
.
+ CO2
.
O
k (25°C) = 1.3 x 105 s-1
k (25°C) = 3.3 x 104 s-1
.
.
.
.
+ CO
O
k (25°C) = 1.3 x 108 s-1
k (25°C) = 5.2 x 107 s-1
.
O
R
R
O
O
.
k (25°C) = 5÷8 x 109 s-1
k (25°C) = 2 x 109 s-1
.
k (25°C) = 1÷4 x 1011 s-1
Ar
Ar
esempio
.
O
Fotolisi dei chetoni:
O
O
hν
R
R
+
+
HO
R
E’ stato proposto che si formi un 1,4-biradicale
O
.O
hν
R
R
H
.
α
γ
OH
β
R
SCISSIONE
OH
O
R
R
+
.
.
CHIUSURA
HO
R
Si sa che l’introduzione di CO, sotto forma di estere, accelera il decadimento dell’1,4biradicale risultante, attraverso frammentazione
O
O
nel chetone è stato inserito un
“radical clock” che si apre con
una costante di circa 108 s-1
O
O
32
OH
O
O
O
.
hν
.
O
O
.
senza
riarrangiamento
OH
O
.
O
O
+ CO +
OH
O
.
O
.
O
HO
Il risultato dice che la framentazione
del radicale ha una velocità
confrontabile con quella del
riarrangiamento del radical clock
O
O
O
HO
O
tempo di vita dell’1,4-biradicale formato per fotolisi: 1÷4 ns
33