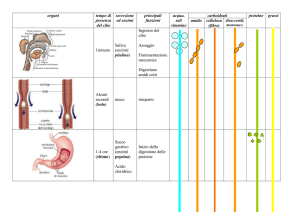
Le PROTEINE sono i biopolimeri maggiormente presenti all’interno delle
cellule, dal momento che costituiscono dal 40 al 70% del peso a secco.
Svolgono funzioni biologiche di fondamentale importanza e possono
essere divise in 7 gruppi principali:
• proteine strutturali (collagene, cheratine);
• proteine catalitiche (enzimi);
• proteine di trasporto (emoglobina, mioglobina, albumina);
• proteine regolatorie (ormoni);
• proteine di protezione (anticorpi, trombina);
• proteine contrattili (actina, miosina, troponina, tropomiosina)
• proteine di riserva (ovoalbumina, caseina)
La cinetica enzimatica
• Può fornire informazioni sul meccanismo di
azione di un enzima
• Fornisce informazioni sul ruolo di un enzima in
condiz. cellulari e sulle risposte a variazioni di
concentrazioni di metaboliti
• Fornisce informazioni su come un enzima è
regolato
• Consente di caratterizzare inibitori (ad es., di
interesse farmacologico)
• E’ utile nel dosaggio di attività enzimatiche quali
indici diagnostici
• E’ utile nel discriminare diverse forme
enzimatiche sia fisiologiche (isoenzimi) sia
anomale
• È utile nella messa a punto di dosaggi enzimatici
di substrati
Velocità di reazione ed attività enzimatica
• Velocità di reazione: quantità di substrato trasformato nel
tempo
v = d [S] / dT = d [P] / dT
Inibizione enzimatica
• Reversibile
– Competitiva
– Non competitiva
– Acompetitiva
• Irreversibile
– Si legano all’enzima con legami stabili (covalenti)
– Non possono essere rimossi con mezzi semplici
– Cinetica analoga all’inibizione non competitiva
– Sono utilizzati: nello studio dei siti catalitici
come farmaci (anti-metaboliti)
come anti-parassitari
Parametri cinetici
• Km
• kcat
Numero di turn-over: Massimo numero di molecole di substrato
convertite nella unità di tempo da una molecola (sito) di enzima
• Vmax
• kcat/Km
(costante efficienza o di specificità) Dà una idea della efficienza
relativa con cui vengono trasformati substrati diversi (specificità) Dà una idea
della efficienza catalitica dell’enzima (enzimi “perfettamente” evoluti hanno
costanti che si approssimano alla diffusione)
•
Inibizione (Ki)
Dosaggi enzimatici in Biochimica Clinica
• Enzimi plasmatici a scopo diagnostico
• carenze/difetti enzimatici responsabili di alterazioni
metaboliche e patologie correlate
Dosaggi enzimatici
• Valutazioni cinetiche
• Valutazioni cliniche
• Dosaggio di metaboliti
• Valutazioni merceologiche (alimentari)
Localizzazione Enzimatica
Gli enzimi si possono trovare:
• Liberi nelle cellule di diversi tessuti ed organi
• Confinati in particolari strutture all’interno delle cellule
stesse
• In un determinato tessuto od organo specifico.
Quando le strutture cellulari vengono danneggiate gli
enzimi cellulari si liberano e si riversano nel circolo
sanguigno.
In questo modo, un aumento della loro concentrazione
nel campione può rappresentare un indice abbastanza
preciso di un danno cellulare.
Enzimi plasmatici da dosare:
• enzimi attivi nel plasma (fattori della
coagulazione)
• enzimi attivi in fluidi extra-cellulari (ad
esempio, enzimi digestivi)
• enzimi del metabolismo cellulare
– ubiquitari
– organo (tessuto)-specifici
Inibitori come farmaci: i sulfamidici
Inibitori come farmaci:
inibitori delle HIV proteasi
• Il virus HIV utilizza aspartato proteasi per scindere
poliproteine
• Le proteasi tagliano legami particolari (Phe-Pro; TyrPro)
• occorrono inibitori ad alta specificità
Meccanismi responsabili di un aumento degli
enzimi nel plasma
1)necrosi o danno cellulare indotto da fattori tossici o da ischemia, in cui
gli enzimi normalmente contenuti nel citoplasma fuoriescono dalle
cellule per citolisi
2)variazione della quantità di tessuto: aumentato turnover cellulare che
si realizza normalmente durante l'accrescimento, la rigenerazione
cellulare o anche in corso di neoplasie
3)alterata sintesi: induzione enzimatica in cui aumenta la sintesi proteica
dell'enzima
4)ostruzione dei dotti escretori per cui enzimi normalmente presenti
nelle secrezioni esocrine si riversano nel plasma
5)variazione nella permeabilità cellulare
6)alterazione nella velocità di inattivazione/ degradazione
7)altri fattori che influenzano l’attività (inibitori, carenza di cofattori...)
Inibitori enzimatici come agenti terapeutici
Inibitore
Enzima
Applicazione
AZT
Trascrittasi inversa
HIV
Ritonavir, saquinavir
Proteasi HIV
HIV
Sulfonammidi
Diidrofolato sintasi
Infezioni batteriche
Trimetoprim,
methotrexate
Allopurinolo
Diidrofolato reduttasi
Infezioni batteriche
Xantina ossidasi
Gotta
Statine
HMG CoA reduttasi
Sintesi colesterolo
Aspirina
Cicloossigenasi
Sintesi prostaglandine