GENERALITÀ SUL
METABOLISMO
I viventi possono considerarsi sistemi
complessi che si conservano e si perpetuano
usando:
Materia (sostanze organiche e inorganiche)
Energia (solare e chimica)
Informazione indispensabile per indirizzare
l’utilizzo di materia e energia nella
costruzione e mantenimento dell’organismo.
Il mantenimento dell’ordine cellulare è
governato dai principi della termodinamica.
Si definiscono sistemi termodinamici porzioni
definite di spazio materia e energia
delimitate da superfici fisiche; ciò che li
circonda si chiama ambiente
Sistemi isolati : non scambiano né energia né
materia
Sistemi chiusi : scambiano energia ma non
materia
Sistemi aperti : scambiano materia ed
LEGGI DELLA TERMODINAMICA
I legge o principio di
conservazione
dell’energia : in un
sistema isolato la
quantità dell’energia
totale resta costante
Epg + Epe + Ec = K
II legge :
a ogni
trasformazione
energetica una
parte dell’energia
utile si disperde
sotto forma di calore
E tot = Emec + Et
Si chiama entropia , che letteralmente vuol
dire cambiamento interno, la grandezza che
misura lo stato di disordine di un sistema.
Ogni trasformazione energetica avviene
spontaneamente verso un aumento di
entropia
TIPI DI REAZIONE
Reazioni esoergoniche
Hanno un contenuto
energetico dei
prodotti minore di
quello dei reagenti
Procedono
spontaneamente
Possono produrre
lavoro
Reazioni
endoergoniche
Hanno un contenuto
energetico dei
prodotti maggiore di
quello dei reagenti
Non procedono
spontaneamente
Esigono lavoro per
poter avvenire
ESEMPI DI REAZIONI
Fotosintesi clorofilliana
6 CO2 + 6H2O + luce solare --- C6H12O6+ 6O2
Respirazione cellulare
C6H12O6+ 6O2 _----- 6 CO2 + 6H2O + energia chimica
Fermentazione
ATP O ADENOSINTRIFOSFATO
Adenina
ribosio
STRATEGIE METABOLICHE
Tutte le trasformazioni chimiche che avvengono
negli esseri viventi necessitano della presenza di
particolari proteine dette ENZIMI
Quale funzione hanno?
Funzionano da CATALIZZATORI in quanto
aumentano la velocità delle reazioni cellulari alle
temperature ordinarie
Infatti tali reazioni potrebbero avvenire
velocemente solo ad alte temperature che nelle
cellule risulterebbero invece distruttive
Ogni enzima è SPECIFICO per una determinata
reazione
L’aggancio tra enzima e SUBSTRATO ( reagente)
avviene in corrispondenza di una zona della molecola
enzimatica detta SITO ATTIVO e ha come effetto quello
di indebolire i legami del substrato che necessitano di
minor energia per essere rotti
I legami dei reagenti devono scindersi al fine di
lasciare gli atomi liberi di riaggregarsi per fornire i
prodotti
L’energia iniziale necessaria per rompere i legami
dei reagenti è detta ENERGIA DI ATTIVAZIONE
Il compito degli enzimi è quello di ABBASSARE
l’energia di attivazione rendendo così più veloce la
reazione
Caratteristiche dell’enzima:
1) È specifico :
• Modello del tipo chiave con la serratura
• Modello di adattamento indotto ( guanto con la
mano che lo indossa )
2) Non si trasforma durante la reazione e quindi lo
si ritrova inalterato al termine del processo. Sono
sufficienti dunque poche molecole enzimatiche per
catalizzare un numero elevatissimo di
trasformazioni di quella reazione
3) Per molti enzimi la capacità catalitica dipende
dalla presenza di componenti non proteiche detti
genericamente cofattori
COFATTORI E COENZIMI
I cofattori sono ioni
inorganici come
quelli del ferro, del
rame , …
Mg 2+ necessario in
tutte le reazioni di
fosforilazione
Zn 2+ necessario per
la DNA polimerasi
I coenzimi sono
piccole molecole
organiche non
proteiche che
agiscono in modo
diverso:
Vitamine *
FAD, NADH NADPH
FATTORI CHE INFLUENZANO
L’ATTIVITÀ ENZIMATICA
Temperatura
1.
se alta aumenta l’agitazione molecolare e
quindi la velocità di reazione ma può
denaturare l’enzima
se bassa può inattivare gli enzimi
2.
pH
ogni enzima è attivo entro certi
intervalli ben definiti di pH ( in
genere è ottimale intorno a 7)
MECCANISMI DI REGOLAZIONE
DELL’ATTIVITÀ ENZIMATICA
A livello del substrato
Maggiore è la concentrazione
più veloce è la reazione fino
alla saturazione
Regolazione per
modificazione
covalente
Esempio fosforilazione
dell’enzima o la
trasformazione di una
forma inattiva in una attiva
Regolazione allosterica
Esistono molecole con
funzione di attivatori o
inibitori che si legano con
legami deboli in siti diversi
e modificano l’attività
enzimatica
Regolazione basata
sulla sintesi degli
enzimi
Esistono, nelle cellule, delle sostanze che hanno
l’effetto di rendere attivi o non attivi (inibitori) gli
enzimi a seconda delle necessità del momento.
È grazie a queste sostanze che le cellule
riescono a regolare la loro attività metabolica
Esistono due tipi di inibizione:
1) INIBIZIONE
COMPETITIVA:
l’inibitore si lega
all’enzima nel sito
attivo avendo forma
simile a quella del
substrato
2) INIBIZIONE NON COMPETITIVA: l’inibitore si lega
all’enzima in un punto diverso dal sito attivo,
determinando il cambiamento di quest’ultimo
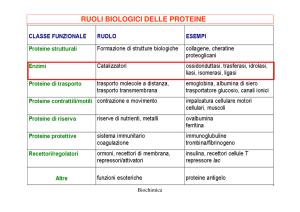
CLASSIFICAZIONE DEGLI ENZIMI
EC1
Ossidoreduttasi
Reazioni di ossidoriduzione; trasferimento di
atomi di idrogeno e di ossigeno, o di elettroni
da una molecola ad un'altra AH + B → A +
BH (ridotta)
A + O → AO (ossidata)
Deidrogenasi, ossidasi
EC 2
Transferasi
Trasferimento di un gruppo funzionale da un
substrato ad un altro. Può trattarsi, ad
esempio, di un gruppo metilico, aminico, fosfato.AB + C → A + BC
Transminasi,chinasi
EC 3
Idrolasi
Formazione di due prodotti a partire da
uno attraverso una idrolisi
EC 4
Liasi
Addizione o rimozione non-idrolitica di
gruppi funzionali dal substrato. Possono
essere rotti legami C-C, C-N, C-O o C-S
EC 5
Isomerasi
EC 6
Ligasi
Riarrangiamento intramolecolare, come
la modificazione di conformazione di
una molecola in seguito a reazioni
di isomerizzazione
Unione di due molecole attraverso la
costituzione di nuovi legami covalenti di
tipo C-O, C-S, C-N o C-C, con la rottura
simultanea di ATP
AB + H2O →
AOH + BH
Lipasi, amilasi,
proteasi
RCOCOOH → Decarbossilasi
RCOH + CO2
AB → BA
X + Y+ ATP
→ XY + ADP
+ Pi
Isomerasi,
mutasi
Sintetasi,
polimerasi