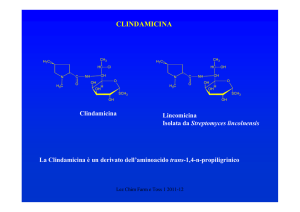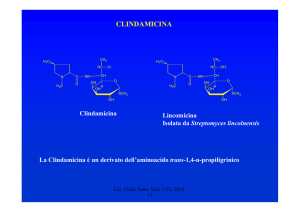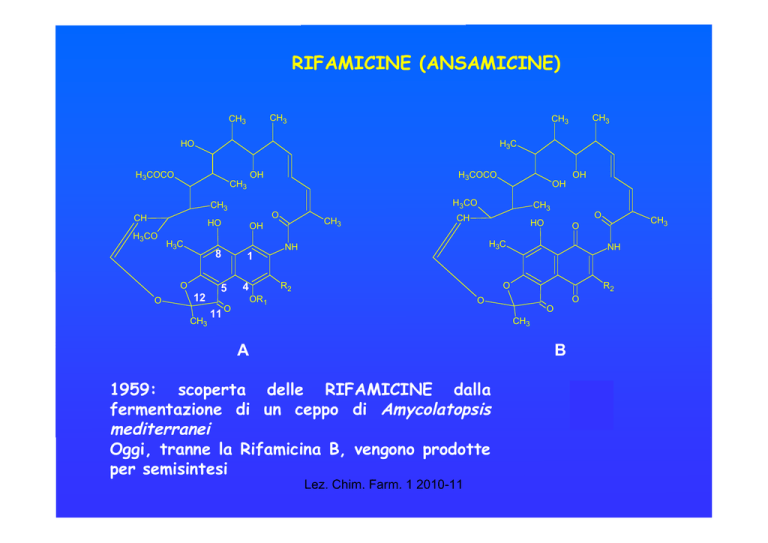
RIFAMICINE (ANSAMICINE)
CH3
CH3
H3C
HO
H3COCO
CH3
H3C
O
O
12
CH3
1
5
11
CH3
OH
8
O
HO
NH
O
R2
O
O
O
CH3
A
B
1959: scoperta delle RIFAMICINE dalla
fermentazione di un ceppo di Amycolatopsis
mediterranei
Oggi, tranne la Rifamicina B, vengono prodotte
per semisintesi
Lez. Chim. Farm. 1 2010-11
CH3
O
H3C
NH
OR1
O
OH
CH3
CH
R2
4
OH
H3CO
O
HO
H3CO
H3COCO
OH
CH3
CH
CH3
CH3
CH4
MECCANISMO DI AZIONE
Inibizione dell’RNA DNA– dipendente interferendo con la subunità β della
RNA Polimerasi batterica
Si forma un complesso rifamicina-RNA polimerasi (1:1) molto stabile
Le rifamicine NON inibiscono le RNA-nucleotidiltransferasi di organismi più
evoluti
Le rifamicine inibiscono anche la nucleotidiltransferasi (polimerasi degli acidi
nucleici) di mammiferi e virus, ma solo a concentrazioni elevatissime
Nell’interazione con l’enzima è importante la posizione dei gruppi ossidrilici
che sono tutti dalla stessa parte
Lez. Chim. Farm. 1 2010-11
FARMACI
RIFAMICINA B
Si ottiene per fermentazione
Amycolatopsis mediterranei
R1 = H, R2 = CH2COOH
Spettro antibatterico: buona attività su
Gram + (stafilococchi anche pen.
resistenti) ma molto meno sui Gram -
CH3
CH3
HO
H3COCO
CH3
CH
HO
H3CO
Attivo su Mycobacterium tubercolosis
OH
CH3
O
CH3
OH
H3C
NH
O
R2
O
O
da
OR1
CH3
Lez. Chim. Farm. 1 2010-11
CH3
CH3
H3C
RIFAMICINA S: è un prodotto naturale con
nucleo naftochinonico
E’
attivo
se
somministrato
per
via
sottocutanea, meno per via orale
H3COCO
OH
H3CO
OH
CH3
CH
O
HO
CH3
O
H3C
NH
O
O
O
O
CH3
Rifamicina S
Riduz.
CH3
CH3
RIFAMICINA SV: è di semisintesi. Si
ottiene per riduzione della Rifamicina S
Rispetto alla Rifamicina S è, in vivo, da
2 a 4 volte più attiva
Veniva usata come antitubercolare
Non è attiva per via orale
HO
H3COCO
CH3
CH3
CH
HO
H3CO
O
OH
H3C
CH3
NH
O
R2
O
O
CH3
Lez. Chim. Farm. 1 2010-11
OH
Rifamicina SV R1 = H, R2 = H
OR1
RIFAMPICINA (RIFADIN®):
è un farmaco di semisintesi:
Antitubercolare di I scelta
Impiegato anche nelle infezioni da M leprae e
nella profilassi da infezioni di N. meningitidis
(passa bene la barriera ematoencefalica)
CH3
CH3
H3C
H3COCO
OH
H3CO
CH3
CH
HO
Attivo su diversi Gram + (stafilcocchi
resistenti, pneumococchi, clostridium) e Gram –
(N. gonorrea e meningitidis, L. pneumofila)
Azione battericida
Viene bene assorbita per via orale
Elevata diffusione nel tessuto polmonare e
buona penetrazione endocellulare
OH
O
CH3
OH
H3C
NH
O
O
O
CH3
OH
N
N
N
H3C
t1/2 = 3 h
Spesso associata ad altri antibiotici
RESISTENZA: Ridotta Affinità del Bersaglio
Lez. Chim. Farm. 1 2010-11
RIFAMPICINA
CH3
CH3
METABOLISMO e ELIMINAZIONE della
rifampicina:
due metaboliti principali:
metabolita desacetilato in posizione C25
metabolita 3-formil
H3C
HO
25
H3CO
OH
OH
CH3
CH
O
HO
CH3
OH
H3C
NH
O
Il metabolita 25 deacetilato conserva la sua
attività antibatterica e viene eliminato
principalmente nella bile (80%) e non
riassorbito
(come
la
rifampicina
non
metabolizzata), e nelle urine (20%), dopo
essere
stato
precedentemente
glucuronoconiugato
O
O
OH
N
CH3
N
N
CH3
25-desacetil rifampicina
CH3
CH3
H3C
il metabolita 3-formil, a diminuita attività
antibatterica, è assente nella bile e si ritrova
nelle urine
H3COCO
OH
H3CO
OH
CH3
CH
HO
O
H3C
La rifampicina è un forte induttore epatico
del citocromo P-450
Lez. Chim. Farm. 1 2010-11
TOSSICITA’: epatica nel 20/30% di pazienti
CH3
OH
NH
3
O
O
O
O
OH
CH3
3-formil rifampicina
RIFAPENTINA:
Rispetto alla rifampicina, la rifapentina ha una
superiore attività nei confronti dei micobatteri
della tubercolosi e della lebbra.
Attiva sul Mycobacterium avium intracellulare
H3C
H3COCO
OH
H3CO
La rifapentina ha una attività inferiore alla
rifampicina sui batteri Gram positivi; inoltre,
non possiede attività nei confronti degli
enterobatteri e di Pseudomonas
t1/2 = 11-13 h
CH3
CH3
OH
CH3
CH
HO
OH
H3C
O
CH3
NH
O
O
O
OH
N
CH3
N
Elevata diffusione tissutale
N
La rifapentina è un forte induttore epatico
del citocromo P-450
Lez. Chim. Farm. 1 2010-11
RIFABUTINA:
Attività Antimicobatterica superiore rispetto
sia alla rifampicina che alla rifapentina
(anche su M. avium intracellulare).
Profilassi da M. avium intracellulare
H3C
H3COCO
OH
CH3
CH
HO
O
CH3
O
H3C
NH
O
NH
O
O
N
CH3
Elevata diffusione tissutale (più lipofila della
rifampicina)
METABOLISMO: due metaboliti principali, il
metabolita C-25 desacetilato (40%), come la
rifampicina, ed il 31-idrossi metabolita
(circa
20%),
a
diminuita
attività
antibatterica.
ELIMINAZIONE:
(lenta)
OH
H3CO
Attività Antibatterica inferiore rispetto alla
rifampicina
t1/2 = 30-40 h
CH3
CH3
in
gran
parte
renale
Lez. Chim. Farm.
1 2010-11
La rifabutina è un forte induttore
epatico
del citocromo P-450
N
CH3
CH3
RIFABUTINA
MICOBATTERI
Sono note più di 20 specie di micobatteri
Tra queste quelle patogene per l’uomo sono: il
•M. tubercolosis,
•M. leprae
•M. avium intracellulare complex (MAC) (occasionalmente patogeno)
Negli ultimi 60 anni la chemioterapia (streptomicina, isoniazide, rifampicina)
ha ridotto la diffusione della tubercolosi.
Negli ultimi 20 anni c’è stata un inversione di tendenza
Dati OMS (2010):
9.400.000 casi/anno nel mondo
1.300.000 morti/anno nel mondo
•4.400 morti al giorno per tubercolosi
•in Italia si contano circa 4500 casi l'anno di Tbc e 4215 decessi nel
periodo 1995-2002
Lez. Chim. Farm. 1 2010-11
CAUSE DELL’INCIDENZA DELLA TUBERCOLOSI
1. Diffusione dell’AIDS
2. Aumento di ceppi resistenti (MDR)
3. Emigrazione
1. DIFFUSIONE DELL’AIDS
L’AIDS è il fattore a più alto rischio per la progressione di infezioni
tubercolari
1/3 dei 42 milioni di malati di AIDS è affetto da TBC
L’AIDS favorisce anche la diffusione di Micobatteri diversi come il M.
avium complex (MAC)
Il MAC è resistente alla maggior parte dei farmaci antitubercolari
Lez. Chim. Farm. 1 2010-11
AUMENTO DI CEPPI RESISTENTI (MDR)
Resistenza primaria
Resistenza secondaria o acquisita
Si parla di MDR-TB quando il ceppo è insensibile almeno all’Isoniazide e
alla Rifampicina
440.000 casi/anno (con 33% di mortalità) (dati 2010)
50 % India e Cina
28% Russia orientale
15% Africa
Le prime resistenze acquisite risalgono ai tempi in cui la streptomicina
era l’unico antibiotico ad uso clinico
Il fenomeno della resistenza si è attenuato prima con:
•l’impiego contemporaneo di Streptomicina (SM) e acido p-ammino
salicilico (PAS)
•Poi con l’impiego di Isoniazide (INH) e Rifampicina (RIF)
XDR-TB, (tubercolosi a estesa farmacoresistenza)
Recentemente sono comparsi in Italia XDR-TB resistenti a tutti i
farmaci di I e II scelta Lez. Chim. Farm. 1 2010-11
STATO ATTUALE DELLA RICERCA FARMACEUTICA NEL CAMPO
DEI FARMACI ANTIMICOBATTERICI
Negli ultimi 20 anni la ricerca di nuovi antitubercolari ha subito un
notevole rallentamento perchè:
1. Si pensava che i potenti antitubercolari quali INH e, RIF e SM
fossero sufficienti per il controllo della malattia
2. Le aziende farmaceutiche non avevano interesse a sviluppare nuovi
antimicobatterici
Lez. Chim. Farm. 1 2010-11
STRUTTURA DELLA PARETE CELLULARE DEI MICOBATTERI
Glicolipidi con a. grassi a.
catena media
Fosfolipidi contenenti a.
grassi e catena corta
Micoilarabinogalattano
Lez. Chim. Farm. 1 2010-11
FARMACI ANTITUBERCOLARI
ACIDO P-AMMINOSALICILICO (PAS) (1946)
H2N
H2N
OH
HOOC
PAS
HOOC
A. P-AMMINOBENZOICO
MECCANISMO DI AZIONE: inibizione della sintesi dell’acido
tetraidrofolico
Lez. Chim. Farm. 1 2010-11
MECCANISMO DI AZIONE
H2N
OH
COOH
OH
OH
N
N
H2N
N
CH2
OH
N
+
H2N
NH
CH2
N
COOH
COOH
H2N
N
H
N
Diidropteroato sintetasi
Pteridina
N
H
A. diidropteroico
O
O
HO
Diidrofolato sintetasi
OH
NH2
OH
H
N
NH
COOH
N
NH CH
H2N
N
N
H
O
Tetraidrofolato
deidrogenasi
OH
N
NH
COOH
N
NH CH
COOH
A. TETRAIDROFOLICO
H2N
Lez. Chim. Farm. 1 2010-11
N
N
H
A. diidrofolico
O
COOH
SINTESI DELL’ACIDO TETRAIDROFOLICO NELL’UOMO
OH
N
NH
COOH
N
NH CH
H2N
N
N
COOH
O
ACIDO FOLICO
Diidrofolato reduttasi
OH
H
N
NH
COOH
N
NH CH
H2N
N
N
H
O
A. TETRAIDROFOLICO
Lez. Chim. Farm. 1 2010-11
COOH
Azione batteriostatica
Era un antitubercolare di prima scelta (in disuso)
Spettro di Attività: solo su M. tubercolosis, non attivo su
micobatteri atipici come MAC
Veniva impiegato in associazione con Streptomicina e Isoniazide
Somministrazione orale (fino a 16 g/die) o per infusione (fino 40
g/die)
Seleziona rapidamente ceppi batterici resistenti
Lez. Chim. Farm. 1 2010-11
ISONIAZIDE (INH) (1952)
E’ un Profarmaco
MECCANISMO DI AZIONE
Inibizione della sintesi degli acidi micolici (α-micolati,
metossimicolati, ketomicolati) attraverso il blocco di un
enzima NADH-dipendente (riduttasi)
CONH2
CO
N
NH2
INH
N
attivazione
COOH
N
NH2
O
N
NH2
O
CONH2
+
N
O
OH
N
OH
OLez.
P
N
O
O
OH
P
N
O
O
OH
Chim. Farm. 1 2010-11
NAD+
OH
OH
N
NH
NH2
Spettro di Attività: solo su M. tubercolosis, non attivo su micobatteri atipici
come MAC
Azione batteriostatica o battericida
E’ un farmaco di Prima Scelta
Seleziona rapidamente ceppi batterici resistenti:
Riduzione dell’attività enzimatica delle catalasi/perossidasi
Dose: 0.3-0.6 g/die
ATTIVITA’ COLLATERALI: epatotossicità, neuriti periferiche
DERIVATI DELL’INH
IPRONIAZIDE
Come l’INH ma rispetto a questa è
più attiva ma anche più tossica
Lez. Chim. Farm. 1 2010-11
CH3
NH
O
NH
CH3
N
ETIONAMIDE (ETH)
S
NH2
MECCANISMO DI AZIONE: come INH
Alle dosi terapeutiche agisce da battericida (0.75-1
g/die)
E’ un farmaco di seconda scelta
Seleziona rapidamente ceppi batterici resistenti
ATTIVITA’ COLLATERALI: tossico su fegato e
stomaco
Le incompatibilità con altri farmaci ne limitano
l’impiego
Lez. Chim. Farm. 1 2010-11
N
ETH
C2H5
N
PIRAZINAMIDE (1952)
CONH2
N
E’ un Profarmaco
MECCANISMO DI AZIONE: differente dall’INH (non c’è resistenza
crociata) ma ancora sconosciuto
E’ un farmaco di prima scelta
Attivo solo sulle forme intracellulari in moltiplicazione di M. tubercolosis
ATTIVITA’ COLLATERALI: tossico sul fegato
Seleziona rapidamente ceppi batterici resistenti
Lez. Chim. Farm. 1 2010-11
ETAMBUTOLO (ETAPIAM®)
H5C2
HO
CH
NH
CH2
CH2 CH2
NH
CH C2H5
H2C
OH
MECCANISMO DI AZIONE:
Inibisce l’α-1,3-arabinosiltrasferasi, enzima fondamentale per la sintesi
dell’arabinogalattano
Azione battericida
E’ un farmaco di prima scelta
CORRELAZIONE STRUTTURA-ATTIVITA’:
•La catena di 2 atomi di C tra i gruppi amminici è ottimale
•I gruppi amminici devono essere secondari e legati a gruppi alifatici
Lez. Chim. Farm. 1 2010-11
ELEVATA TOLLERABILITA’ che associata a basse dosi terapeutiche
(1g/die, x via i.m.) ne fa un farmaco di prima scelta
Somministrazione: orale e intramuscolo
METABOLISMO
80% inalterato
Possibili disturbi della visione. Da somministrare con cautela su bambini <
5 anni
In somministrazione unica seleziona rapidamente ceppi resistenti
Lez. Chim. Farm. 1 2010-11
STREPTOMICINA
NH
È’ un antitubercolare amminoglicosidico
MECCANISMO DI AZIONE:
Inibizione della sintesi proteica (subunità
30S). Determina un errore di lettura del
codon da parte dell’RNA transfert
OH
O
Si usa raramente
H3C
Azione battericida
SOMMINISTRAZIONE: i.m. o i.v.
assorbita per o.s., instabile a pH acido)
TOSSICITA’:
bassi
valori
Nefrotossico e ototossico
di
NH
HN
OH
O
H
Rapido instaurarsi di resistenza (plasmidica)
con inattivazione enzimatica
NH
H2N
OH
CHO H H
OH
O
CH2OH
OH
(non
LD50.
Lez. Chim. Farm. 1 2010-11
O
NHCH3
OH
NH2
RIFAMICINE
H3COCO
OH
HO
OH
H3CO
CH3
CH
H3C
H3COCO
OH
O
CH3
OH
H3C
HO
O
OH
O
CH3
O
OH
N
CH3
N
OH
CH3
CH
HO
O
NH
O
O
O
OH
NH
O
N
CH3
N
CH3
O
H3C
NH
O
O
OH
H3CO
H3C
NH
H3COCO
OH
CH3
CH
CH3
CH3
H3C
H3C
H3CO
CH3
CH3
CH3
CH3
O
N
CH3
N
CH3
N
N
CH3
H3C
RIFAMPICINA
RIFAPENTINA
Lez. Chim. Farm. 1 2010-11
(MYCOBUTIN®)
RIFABUTINA
(RIFADIN®)
CICLOSERINA
H2N
O
NH
O
Tubercolostatico di terza scelta
Meccanismo di azione: inibizione della D-L Alanina Racemasi e D-Alanin
D-alanina Sintetasi
Tossicità: neurotossico (convulsioni, vertigini)
Lez. Chim. Farm. 1 2010-11
CHINOLONI
O
O
F
F
COOH
N
N
N
N
COOH
O
N
HN
CH3
H3C
CIPROFLOXACINA (CIPROXIN®)
OFLOXACINA (OFLOCIN®)
O
O
F
F
H
N
COOH
COOH
H3C
N
O
N
N
N
H3C
N
N
O
H2N
Moxifloxacina (Avalox®)
Gemifloxacina (Factive®)
Lez. Chim. Farm. 1 2010-11
Farmaci in Sviluppo Clinico
PA 824
MECCANISMO DI AZIONE: interazione con due molecole micobatteriche
(Dnd e un cofattore) e successiva produzione di NO
Agisce su forme latenti anche resistenti di M. tubercolosis. Nessuna
attività su Gram (+) e Gram (-)
ATTIVITA’ COLLATERALI: non è mutageno
Nessuna interazione con citocromo P-450
Lez. Chim. Farm. 1 2010-11
TERAPIA ANTITUBERCOLARE
FASE INIZIALE (2 mesi)
•Isoniazide
+
Pirazinamide
+
Rifamicina
(Rifampicina/Rifabutina/Rifapentina) + Etambutolo
FASE DI MANTENIMENTO (4 mesi)
• Isoniazide + Rifamicina(Rifampicina / Rifabutina
/ Rifapentina)
Lez. Chim. Farm. 1 2010-11