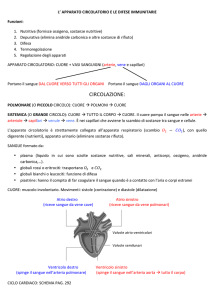
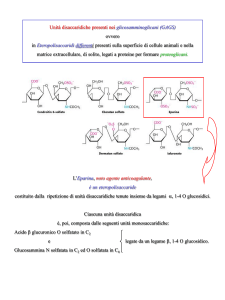
UNIVERSITÀ - OSPEDALE di PADOVA
MEDICINA NUCLEARE 1
Medicina Nucleare “in Vitro” o metodiche
radionuclidiche “non imaging”
Lezione 6:
Generalità sul RIA
D. Cecchin, F. Bui
Dosaggi radioimmunologici ?
Epoca Pre-RIA:
Fino al 1959 circa, il dosaggio di molecole biologiche erano di solito
effettuate mediante l’analisi chimica (isolamento, purificazione e
concentrazione) ed il dosaggio biologico (ad esempio per il dosaggio
dell’insulina si valutava l’ipoglicemia indotta in animali da esperimento resi
diabetici ed ipofisectomizzati).
Tali metodiche risultavano complesse, costose e poco sensibili.
Epoca RIA-IRMA:
Nel 1955-60 Rosalyn Yalow (premio nobel per la medicina e fisiologia nel
1977) e Solomon Berson al Veterans Administration Hospital (Bronx)
rivoluzionano i dosaggi (in primis dell’insulina) introducendo il RIA, una
tecnica che unisce la specificita’ di una reazione immunologica
(formazione di un complesso antigene-anticorpo) e la sensibilita’ di un
metodo radiochimico. Subito la tecnica si diffuse per tutti gli ormoni
proteici e per altri analiti.
Nel 1968 Miles e Hales Proposero una sua variante ovvero l’IRMA
(dosaggio immunoradiometrico).
E nel presente/futuro: epoca post-RIA
Oltre al dosaggio immunologico isotopico (RIA, IRMA) che
qui discuteremo, esiste anche il dosaggio immunologico non
isotopico che possiamo distinguere in:
• “senza marcatura” (nefelometria)
• “con
marcatura
alternativa”
(enzimi,
componenti
luminescenti, radicali liberi ecc).
I metodi isotopici richiedono norme di sicurezza e procedure di
marcatura speciali, un tracciante che decade nel tempo, è solo
parzialmente automatizzabile ed ha una precisione moderata
rispetto ai metodi ottici (o non isotopici).
Tuttavia mentre la sensibilita! dei sistemi ottici e! intorno ad 1
ng/ml quella dei metodi isotopici arriva ad 1 pg/ml
RIA: Componenti
A) ANTICORPO: E! una proteina (della famiglia delle
immunoglobuline) prodotta dalla serie linfoide. Si lega ad un
antigene responsabile della sua produzione. Deve essere
specifico, sensibile e possedere una buona costante di affinita!.
Gli anticorpi sono costituiti da due catene pesanti e due catene
leggere unite da ponti disolfuro e sono caratterizzate da una
regione amino-terminale (costituita da parte delle catene
pesanti e parte delle catene leggere) molto variabile e per
questo responsabile della specificita! e da una regione
carbossi-terminale che ha la stessa sequenza in tutte le
immunoglobuline di una stessa classe.
Perche! la tecnica RIA funzioni l!anticorpo deve legarsi nello
stesso modo (o meglio con la stessa affinita!) all!antigene
marcato e non-marcato
RIA: Componenti
Gli anticorpi maggiormante utilizzati nel RIA sono le IgG
La produzione di anticorpi policlonali si ottiene iniettando
in un coniglio un antigene che deve essere eterologo ed
avere un peso molecolare superiore a 5000 d. Dopo un
opportuno intervallo di tempo ed eventuali richiami si
salassa il coniglio, si centrifuga il sangue e si ottiene plasma
o siero con gli anticorpi desiderati.
La produzione degli anticorpi monoclonali invece si ottiene
con la tecnica degli ibridomi. (Vedi tecnica IRMA)
RIA: Componenti
B) ANTIGENE: Sostanza che stimola la produzione di anticorpi
(ovvero è l’immunogeno). L’antigene è, normalmente, la
sostanza che deve essere misurata (presente nel siero del
paziente…).
Tutti gli ormoni proteici possono essere immunogeni. Gli
steroidi e le sostanze a basso peso molecolare hanno scarsa
capacita’ immunogena a meno che non si leghino a sostanze
piu’ grandi.
C) ANTIGENE MARCATO: E’ uguale all’antigene (o con
capacita’ leganti molto simili. Si noti che e’ sufficiente che
immunologicamente si comporti in modo uguale. L’attivita’
biologica non e’ importante.) Contiene uno o piu’ atomi di un
isotopo radioattivo.
Isotopi utilizzati
Sono prodotti a partire da un precursore, generalmente in un
ciclotrone, in un reattore nucleare o in un generatore.
Gli isotopi piu! utilizzati nelle tecniche radioimmunologiche
sono i seguenti:
• 125I (T1/2 60 giorni – gamma di 28.35 KeV). Utilizzato, in
genere, per marcare gli aminoacidi tirosina e istidina.
• 3H (T1/2 12.66 anni – beta di 18 KeV) Utilizzato, in
genere, per marcare steroidi e farmaci.
• 57Co (T1/2 267 giorni- gamma di 122 KeV) Utilizzato
soprattutto per il dosaggio della cobalamina.
Marcatura
La marcatura dell!antigene si puo! ottenere:
1. Per Sostituzione ovvero scambiando un isotopo
stabile dell!antigene con uno radioattivo.
2. Per Aggiunta ovvero incrementando con un isotopo
radioattivo la molecola dell!antigene.
Uno dei metodi di marcatura piu’ utilizzati e’ la IODAZIONE.
Possiamo distinguere le tecniche di iodazione diretta, nelle
quali il radioiodio (che deve essere presente come catione) è
incorporato direttamente nei residui tirosinici della catena
proteica, da quelle per coniugazione. In questo ultimo caso
nella molecola dell’antigene non ci sono residui tirosinici ed
allora si “attacca”, si coniuga, un residuo tirosinico
premarcato al residuo aminoterminale dell’antigene.
Esempi di iodazione…
• Cloramina: La cloramina T ossida lo iodio radioattivo
(presente come ioduro di sodio) e lo rende cationico e
quindi in grado di legarsi al residuo tirosinico (in genere al
posto di un H+). Si tende a legare un atomo di iodio per
molecola e non di piu! per limitare l!autolisi da radiazioni.
• Iodurazione enzimatica: Un enzima (la lattoperossidasi)
viene legata ad una resina. Aggiungendo in soluzione acqua
ossigenata e glucossidasi l!enzima e in grado di rendere
cationico lo iodio radioattivo e quindi in grado di legarsi ai
residui tirosinici.
• Ossidazione chimica: Si espongono le proteine ad
ipoclorito di sodio. E! una metodica meno utilizzata.
• Elettrolisi: Anche questa e! una metodica poco utilizzata
che prevede l!elettrolisi come “induttore di marcatura”.
Marcatura per sostituzione…
Un altro esempio di marcatura per sostituzione e’ quella con
trizio. Si puo’ ottenere per sintesi chimica, biologica con
precursori marcati o con una reazione di scambio.
Quest’ultima consiste nello scambio di un atomo tra molecole
analoghe. Puo’ essere uno scambio di tipo:
omogeneo ovvero in una stessa fase (come ad esempio
una soluzione alcolica. Prevede la dissociazione per cause
termiche della molecola e la sua riassociazione Es.
AX1+BX2=A B X1 X2=AX2+BX1 )
eterogeneo ovvero tra fasi diverse (solida/liquida).
Una volta marcato si deve controllare la qualita’ del
radiofarmaco con Cromatografia (HPLC - High Pressure
Liquid Cromatography), elettroforesi o reazioni antigene
anticorpo.
Schema generale del RIA
Alla base del RIA c!e la reazione di un anticorpo specifico con
il suo antigene (marcato e non marcato). Il seguente schema
e! una semplificazione della reazione che offre una
panoramica sulla tecnica.
Ka
AB+ AG FRAZIONE LEGATA
AB+ AG*
ANTIGENE NON MARCATO (AG)
ANTIGENE MARCATO (AG*)
ANTICORPO SPECIFICO (AB)
AB
AG
AG*
FRAZIONE LIBERA
Kd
Caveats…
a) La reazione fra anticorpo ed antigene (marcato e non marcato)
possiede una costante di associazione (ka) elevata ovvero la reazione
tende a proseguire verso destra. In altri termini si formano dei complessi
antigene anticorpo molto stabili.
b) I complessi anticorpo+antigene (AB+AG e AB+AG*) vengono chiamati
frazione legata mentre gli anticorpi (AB) e gli antigeni (AG e AG*) non
legati vengono definiti frazione libera.
c) L’anticorpo non distingue tra antigene marcato e non marcato e quindi,
in virtu’ della legge di azione di massa, l’antigene piu’ concentrato
occupa piu’ siti anticorpali.
d) Normalmente la variabile, l’incognita della reazione, e’ l’antigene non
marcato presente nel siero del paziente.
e) Si utilizzano una serie di soluzioni con antigene non marcato in
concentrazione nota per costruire una curva di calibrazione (uno
standard da usare come riferimento per le misure).
Curva di calibrazione: 1
Si supponga di aggiungere concentrazioni crescenti (note)
dell’antigene non marcato mantenendo costanti tutte le altre
componenti della reazione descritta.
CPM
[AG] non marcato
A concentrazioni basse di antigene non marcato aggiunto sara legato
quasi solo antigene marcato. Quindi se elimino la frazione libera e misuro
otterrò alti CPM (conteggi per minuto) dovuti alla grande quota di antigene
marcato legato all’anticorpo.
Curva di calibrazione: 2
CPM
[AG] non marcato
A concentrazioni intermedie di antigene non marcato
aggiunto ci sara’ una quota paragonabile di antigene marcato
e non marcato legato all’anticorpo. Di conseguenza i CPM
rispetto al caso precedente saranno inferiori.
Curva di calibrazione: 3
CPM
[AG] non marcato
A concentrazioni elevate di antigene non marcato
aggiunto si leghera’ all’anticorpo quasi solo antigene non
marcato. Quindi i CPM saranno ulteriormente ridotti rispetto
al caso precedente.
Si noti allora che maggiore e’ la concentrazione di
antigene non marcato minori sono i CPM che misuro
Curva di calibrazione: 4
CPM
A = CPM misurati utilizzando un
campione del paziente
B = Concentrazione dell’antigene
(incognita)
A
B
[AG]
Dopo numerose misurazioni con antigene non marcato in quantità nota con
la procedura illustrata poco sopra ottengo una curva detta di taratura.
Riportando la misura dei CPM ottenuti utilizzando un campione del paziente
(ovvero con la stessa tecnica descrittta ma con antigene non marcato a
concentrazione ignota) sulla curva di taratura posso leggere
“semplicemente” la concentrazione dell’antigene che cerco.