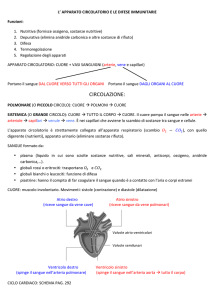
Relazione 09/10/02
Il principio di funzionamento di un immunosensore si basa su un meccanismo di riconoscimento
anticorpo-antigene. Quando ciò si verifica, viene emesso un segnale che verrà rivelato dal
trasduttore.
Quando una sostanza esterna all’organismo, come ad esempio una biomolecola, un composto
chimico o un microrganismo (antigene) entra nell’organismo di un animale vertebrato, i linfociti si
dividono, producendo plasmacellule. Queste, a loro volta, danno vita a molecole specifiche di
anticorpo, aventi una struttura composta da due catene leggere (a bassa peso molecolare) e due
pesanti (ad alto peso molecolare). Agli estremi delle catene c’è un gruppo carbossilico-terminale
COO- che si lega al dominio in cui ha luogo l’attività biologica dell’anticorpo, o il gruppo terminale
NH3+ che ha il compito di legarsi fortemente all’antigene specifico (sarà orientato i maniera diversa
a secondo dell’antigene regione ipervariabile ), e, quindi, alla fine di una lunga sequenza di
eventi biochimici, di provocarne la distruzione. Esistono cinque classi di anticorpi che appartengono
alla categoria delle molecole proteiche dette immunoglobuline.
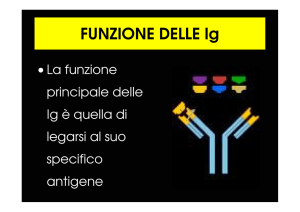
Le reazioni immunochimiche sono caratterizzate da un’elevata specificità che dipende dalla
specificità del legame antigene/anticorpo. Un dato anticorpo, infatti, è in grado si riconosce e legare
l’antigene che ne ha provocato la produzione. Tale specificità può essere usata per realizzare test
analitici molto selettivi.
Per la realizzazione di un immunosensore è fondamentale lo sviluppo di reagenti immunologici:
anticorpi monoclonali e policlonali specifici per erbicidi o contaminanti ambientali e coniugati
antigene/anticorpo-enzima (o fluoroforo) per la rivelazione del segnale.
Produrre anticorpi policlonali (forniscono reagenti con molteplice specificità) non è difficile: si
immunizza l’animale; si aspetta il tempo di risposta del processo di immunizzazione (circa alcune
settimane); si raccoglie il siero e si purifica l’immunoglobulina con tecniche cromatografiche.
Più difficile è la produzione di anticorpi monoclonali (forniscono reagenti con una singola
specificità in quantità potenzialmente illimitata). Generalmente si segue questa procedura.
Si inietta l’antigene, per il quale si vuole creare l’anticorpo, in un topo A.
Si prelevano da un topo B cellule tumorali del suo organo linfatico, che si riproducono
velocemente e non producono anticorpi specifici.
Si mettono a contatto con i linfociti del topo A.
Circa una cellula tumorale su dieci si fonde con i linfociti dando origine ad una nuova cellula detta
ibridoma e produce anticorpi monoclonali per l’antigene inizialmente iniettato nel topo A.
Un immunosensore convenzionale utilizza il metodo ELISA (Enzyme Linked Immunosorbent
Assay). In tale metodo si usa un supporto solido; si tratta comunemente di una micropiastra da
titolazione in polistirene, formata da 96 pozzetti, ai quali vengono legati l’anticorpo o l’antigene
(metodo diretto o indiretto). Il solido è connesso con una soluzione contenente, nel caso dell’ELISA
diretto, l’antigene e un suo analogo marcato e, nel caso dell’ELISA indiretto, l’anticorpo marcato e
l’antigene. In tutti e due i casi la quantità di sostanza marcata legata al solido è inversamente
proporzionale alla concentrazione dell’analita in esame. Il tipo di rivelazione è scelto in base al tipo
di marcatura utilizzata. Nelle tecniche ELISA il marcatore è un enzima.
Commercialmente è disponibile una larga varietà di kit basati sul metodo diretto, che permettono il
coating delle piastre a 96 pozzetti con l’anticorpo monoclinale specifico e la successiva
determinazione quantitativa dell’analita mediante stadi d’incubazione (con il campione per ottenere
la competizione tra antigene e antigene marcato; e con i reagenti opportuni per la reazione
catalizzata dall’enzima).
Nella realizzazione di un immunosensori, un’operazione molto importante è il ricoprimento di un
supporto, in genere un vetrino, con silani. Poiché non è omogeneo, questo rivestimento viene
integrato depositando della streptavidina. Questa proteina riempie le zone lasciate libere dai silani e
crea legami stabili con la biotina, attaccata agli anticorpi. I vetrini così preparati sono inseriti in una
cella di misura, nella quale si manda un flusso del campione da esaminare, contaminato con
Escherichia coli. In seguito si fa fluire l’urea; dall’interazione dell’urea con il battere, si ha un
incremento di pH che viene rilevato tramite un pHmetro, inserito nella cella di misura. il limite
minimo che si riesce a rivelare è di 10 molecole/ml.
La determinazione dell’interazione tra un biomediatore e un analita mediante variazioni di pH viene
realizzata con uno strumento chiamato PAB (Potentiometric Alternating Biosensing). Poiché tale
strumento dà risposte veloci ed efficaci viene usato per screening di massa.
Attività sperimentali
Abbiamo coperto, con una striscia d’isolante, gli elettrodi clorurati.