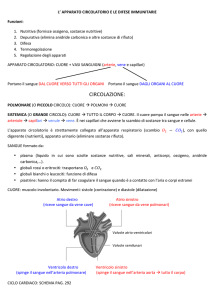
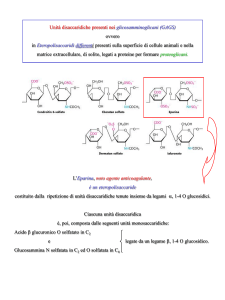
dosaggi ormonali
L’ANALISI CHIMICA
fasi di isolamento, purificazione e concentrazione elaborate
non sufficientemente sensibile per il dosaggio di tutti gli ormoni nel sangue
metodi poco sensibili, laboriosi, costosi, e indaginosi
Il RIA è una metodica rapida, capace di incrementare in
maniera impressionante la sensibilità e la precisione della
misurazione della concentrazione dell’ormone
Marcatore:
sostanza (radioisotopo, enzima, fluoroforo ecc)
che introdotta nella struttura di un reagente
(antigene, aptene, anticorpo) ne consente la
rivelazione
dosaggio radioimmunologico (RIA),
il tracciante è costituito da un isotopo.
Vantaggi:
- elevata sensibilità,
- facilità con cui si ottengono le
marcature isotopiche
- invariabilità delle cinetiche di
reazione a seguito della marcatura
stessa.
Svantaggi:
- alti costi dei reattivi e delle
apparecchiature,
- deperibilità, pericolosità e costi di
smaltimento
dei
composti
radioattivi,
- necessità di personale specializzato
dosaggi immunoenzimatici (EIA). il
tracciante è costituito da un
enzima,
Non viene misurato
marcatore, ma la
confronti di un
specifico (ovvero
prodotto formato).
direttamente il
sua attività nei
suo substrato
la quantità di
L’attività enzimatica, come pure
l’affinità fra Ab e Ag, può variare a
seguito della coniugazione fra
enzima e anticorpo (o antigene).
Vantaggi:
- minor costo,
- assenza
di
rischi
derivati
dall’esposizione a radiazioni,
- maggior praticità e versatilità.
ANTICORPO
Molecola di natura glicoproteica con struttura periferica
esattamente complementare a quella dell’antigene che ne ha
provocato la formazione. Questa prerogativa provoca il legame e
la formazione dell’IMMUNOCOMPLESSO
ANTIGENE
Entità estranea che, penetrata nell’organismo di un vertebrato,
provoca la reazione di esso e la formazione di anticorpi. L’Ag
deve essere eterologo ma riconoscibile dall’organismo, deve
essere dotato di complessità molecolare ed elevato peso
molecolare; l’Ag perfetto è una glicoproteina
REAZIONE ANTIGENE-ANTICORPO: IMMUNOCOMPLESSO
Legami di tipo debole, non covalenti. Per es. forze di Van Der
Waals, di Coulomb, legami idrogeno ecc. reazione dinamica e
reversibile tra un anticorpo e un antigene per dare origine al complesso
antigene-anticorpo. E’ caratterizzata da una costante di equilibrio definita
Ab più utilizzati IgG (150000 pm, 250 Å)
Da che cosa dipende l’immunogenicità
di una sostanza?
1 - estraneità: il sistema immunitario è in grado di discriminare il “self” dal “non
self”, di conseguenza, le molecole estranee ad un determinato organismo hanno
capacità immunogena;
2 - peso molecolare: più è elevato il peso molecolare della molecola in esame e
maggiore sarà la possibilità di avere una risposta immunogenica;
3 - complessità chimica e strutturale delle molecole: l’eterogenicità chimica apporta
immunogenicità. Ad esempio omopolimeri anche adeguatamente grandi hanno
immunogenicità bassa se confrontata con polimeri, contenenti aminoacidi diversi,
dello stesso peso molecolare. D’altra parte, gli antigeni proteici risultano tanto più
immunogenici quanto più sono complessi i loro livelli di organizzazione molecolare
(struttura terziaria e quaternaria);
4 - specie animale: le proprietà immunogene di un antigene variano a seconda
della specie animale utilizzata per la produzione di anticorpi;
5 – degradabilità: macromolecole insolubili sono più immunogene di quelle più
piccole e solubili, poiché vengono più facilmente fagocitate ed elaborate dal
sistema macrofagico.
La costante di associazione K è definita dalla
concentrazione di epitopo libero necessario perché
venga raggiunto il 50% di saturazione dei siti
anticorpali ed è una misura dell’affinità intrinseca o
della stabilità del legame Ag-Ab.
L’affinità di un anticorpo per un dato antigene
determina sia il limite di rilevabilità o sensibilita (che
migliora con l’aumentare dell’affinità), sia la specificità
(che cresce all’aumentare della differenza tra il valore
della costante di affinità di un Ab verso l’Ag specifico e
quello relativo ad un Ag non specifico)
L’ANTIGENE MARCATO può essere identico
all’antigene che deve essere misurato nel campione
(o possedere una capacità legante simile). Esso,
tuttavia, contiene anche uno o più atomi di un
particolare isotopo radioattivo.
Non è necessaria una identica attività biologica
dell’antigene marcato e non marcato.
La validità di un dosaggio RIA dipende da un
identico comportamento immunologico
dell’antigene nel campione in esame con l’antigene
degli standard di riferimento
RIA che utilizzano nella reazione l’antigene marcato.
1. DOSAGGIO ALL’EQUILIBRIO
Incubazione simultanea di antigene, antigene marcato, e anticorpo
La forma più comune
2. DOSAGGIO PER COMPETIZIONE DI LEGAME
L’antigene marcato (Ag*) forma i complessi con l’anticorpo (Ab).
Quindi viene aggiunto l’antigene non marcato (Ag) ai complessi Ag*-Ab,
che spiazza l’antigene marcato (Ag*) dai complessi formati.
3. DOSAGGIO SEQUENZIALE
Si mette a reagire l’antigene non marcato (il campione in esame) con
l’anticorpo. Poiché questa reazione avviene in eccesso di anticorpo
saranno disponibili ancora siti leganti anticorpali. Si aggiunge quindi
l’antigene marcato, che andrà a saturare i restanti siti anticorpali liberi.
Per alcuni composti questo metodo offre una maggiore sensibilità, ma
risente della riduzione del range di concentrazione che può essere
misurato.
Tecniche di dosaggio RIA – schema operativo
di lavoro
1.Ricostituzione dei reagenti •Soluzioni
•Eventuale pretrattamento campioni
2.Addizione dei reattivi
3.Incubazione
•Volumi da 10μL a 1mL
•Temperatura 4° - 45°C
•Tempo 0.5 – 72 ore
4.Separazione dell’Ag libero dal complesso Ag-Ab
•Adsorbimento in fase solida
•Insolubilizzazione dell’immunocomplesso
5.Conteggio
•Scintillazione solida - radiazioni γ (elettromagnetiche)
•Scintillazione liquida - radiazioni β (corpuscolate)
6.Calcolo dei risultati
•Curva di taratura
I PIU’ IMPORTANTI METODI DI SEPARAZIONE
1. La precipitazione non specifica dei complessi antigeneanticorpo con sali e solventi (solfato di ammonio, etanolo,
polietileneglicol-PEG).
2. L’immunoprecipitazione dei complessi solubili antigeneanticorpo (tecnica del doppio anticorpo).
3. L’adsorbimento dell’antigene su fase solida (es. provette
sensibilizzate con l’anticorpo).
4. L’adsorbimento non specifico dell’antigene (es. carbone,
carbone-destrano).