Università degli
Studi di Ferrara
S.S.I.S. VIII CICLO
Classe A060
PERCORSO DIDATTICO:
Didattica di Chimica
Destinatari: Alunni 4° anno liceo scientifico
Anno Accademico 2006-2007
Ferri Violetta
Specializzanda: Violetta Ferri
Cognitivi
• Conoscere gli elementi propri della disciplina
• Saper esaminare e spiegare situazioni, fatti e fenomeni
• Saper formulare ipotesi e verificarle
• Comprendere e usare il linguaggio specifico delle scienze
Metacognitivi
• Riflettere sulle conoscenze necessarie per svolgere il compito
• Ripercorrere in modo ordinato il percorso svolto prendendo consapevolezza dei
meccanismi di apprendimento e delle strategie utilizzate
Comportamentali
• Acquisire e sviluppare le capacità di lavorare in gruppo
• Adottare un comportamento consono all’ambiente
Ferri Violetta
Conoscenze
Definire gli idrocarburi
Descrivere i tipi di ibridizzazione del carbonio
Distinguere gli idrocarburi in base al legame presente (singolo, doppio, triplo)
Spiegare che cosa si intende per isomeri di struttura di un alcano
Spiegare che cosa si intende per isomeria cis-trans degli alcheni
Illustrare l’utilizzo degli idrocarburi
Descrivere la struttura del benzene
Abilità
• Assegnare il nome IUPAC di un idrocarburo data la sua formula
• Scrivere la formula di struttura di un idrocarburo dato il nome IUPAC
• Riconoscere se due composti sono isomeri
Ferri Violetta
Lezione dialogica e frontale in cui verranno presentati i nuovi concetti.
Costruzione e manipolazione dei modellini delle molecole più semplici
Diagnostica: verrà svolta sotto forma dialogica in classe per riprendere i concetti propedeutici
all’argomento dell’unità didattica.
Formativa: nel corso dello svolgimento dell’unità didattica verrà controllato se
effettivamente sono state acquisite le conoscenze presentate attraverso accertamenti orali.
Sommativa: verrà eseguita al termine dell’unità didattica per valutare il raggiungimento degli
obiettivi preposti tramite una verifica scritta e il completamento di una mappa concettuale.
Il petrolio
Gli idrocarburi: l’ambiente e la salute
Ferri Violetta
Lo studente dovrebbe conoscere i seguenti argomenti:
Configurazione elettronica
Legame chimico (Strutture di Lewis)
Orbitali (atomici, molecolari)
Ibridizzazione
Teoria VSEPR
Ore frontali: 4
• Il petrolio: storia, lavorazione e applicazioni (1h)
• Idrocarburi saturi lineari e ciclici (1h)
• Idrocarburi insaturi (1h)
• Idrocarburi aromatici (1h)
Ore verifica: 2
Ferri Violetta
Idrocarburi
Alifatici
Aromatici
Saturi
Alcani
Ferri Violetta
Insaturi
Alcheni
Alchini
Ora posso
orientarmi!
Introduzione
Sono composti binari, costituiti SOLO da
Idrogeno
Carbonio
Possono presentare:
• Semplici -C - C-
• Doppi
• lineari
• ramificate
-C = C• cicliche
• Tripli
Ferri Violetta
-C C-
• con anelli aromatici
Un po’ di storia …..
Storia del Petrolio
Petrus =roccia e oleum=olio
Liquido infiammabile e denso,
di colore scuro composto da idrocarburi
Nell’antichità
• Produzione medicinali e bitume
(Mesopotamia).
Citazioni della bibbia (Genesi ~1500aC)
Petralia Sicilia (centro termale)
“Fuoco greco”
Bizantini (~500-600 dC)
• Uso bellico
“Fuoco perenne”
Iliade di Omero
Ferri Violetta
Collegamento
Storia
Un po’ di storia …..
In tempi recenti ….
• Fino all’800 il petrolio non aveva grande valore commerciale
• 1853 Bissel (uso della perforazione) – 1859 Edwing Drake
(Pennsylvania)
• 1859 inizia “la grande corsa al petrolio” (John Rockeller)
• 1900-1915 diffusione del motore a scoppio: auto, navi, aerei, motrici ferroviarie.
200.000 veicoli a motore)
(es. USA 1910:
Il petrolio assume una notevole importanza economica e strategica-militare
• 1912 flotta britannica viene dotata di motori a nafta (navi più veloci)
• 1914 forze britanniche invadono l’Iraq – tedeschi si “allearono” con i Turchi
• Guerra tedesca dei sottomarini 1917 USA 1918 fine della guerra
• 1928 Francia, UK, USA si spartiscono le concessioni petrolifere Medio Oriente
• Germania attacca la Russia i giacimenti nel Caucaso
• Giappone invade la Cina e poi l’Indocina (1941)USA, Francia Olanda decisero l’embargo petrolifero
Giappone attacca Pearl Harbour
•USA entra in guerra Germania e Giappone vengono sconfitti
Collegamento
Storia
Ferri Violetta
Usi del petrolio
•Energia elettrica (1%)
Fonte di energia
•Riscaldamento (15%)
•Trasporto (69%)
Sfrutta la reazione di
combustione degli
idrocarburi.
85 %
Usi del petrolio
15 %
Produzione di manufatti
Fibre sintetiche
Gomme sintetiche:
Materiali plastici
Fertilizzanti per l’agricoltura
Cere e paraffine
( nylon, poliestere ect..)
(pneumatici, stivali, calzature ect...)
(interruttori, barche, granuli per
giocattoli, tapparelle ect..)
(insetticidi, diserbanti ect..)
(candele, cosmetici, medicamenti,
cartoni da imballaggio)
Ferri Violetta
Idrocarburi alifatici e aromatici
94-99%
A) Composizione
Composti solforati, azotati e ossigenati
1-6 %
B) Formazione
Decomposizione di materiale
organico sottoposto ad elevate
temperature e pressioni.
C) Estrazione
Trasporto
Ferri Violetta
•Petroliere
•Oleodotti
D) Distillazione frazionata del petrolio
Idrocarburi gassosi
•Piombo tetraetile
•Benzene e aromatici
•Metanolo e MTBE
Raffinata e additivata
(numero di ottani)
C1-C4: T<50° C
Metano
Vediamo gli
idrocarburi dal
Benzine (ottani)
punto X
di vista
C -C
50°<T<150° C
chimico!
5
Benzina verde
12
Kerosene
Carburante
Solvente
Combustibile
C9-C16
150°<T<300° C
Forno
Serbatoio
di petrolio grezzo
Gasolio da riscaldamento,
diesel
C12-C25
300°<T<350° C
Olio e paraffine
C20-C70
T > 350° C
Residuo e catrame
(asfalti)
Ferri Violetta
Grassi
Lubrificanti
Cere
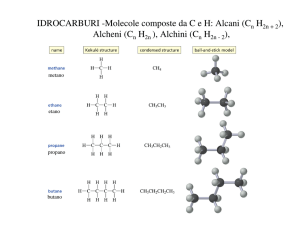
ALCANI - introduzione
CnH2n+2 (n ≥1)
• C ha ibridazione sp3 ed è legato a 4 atomi mediante legami sigma.
•La famiglia degli alcani costituisce una serie omologa
n° atomi di C Nome
1
2
3
4
5
6
7
8
9
10
11
12
Formula molecolare
Metano
Etano
Propano
Butano
Pentano
Esano
Eptano
Ottano
Nonano
Decano
Undecano
Dodecano
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22
C11H24
C12H26
Formula di struttura condensata
CH4
CH3CH3
+ metilene (CH2)
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH3(CH2)4CH3
CH3(CH2)5CH3
CH3(CH2)6CH3
CH3(CH2)7CH3
CH3(CH2)8CH3
CH3(CH2)9CH3
CH3(CH2)10CH3
Gas
Liquidi
C5-C16
Solidi
C17 - Cn
•Tf e Teb aumentano con il numero di C
Ferri Violetta
Perché il C
forma 4
legami?
ALCANI - configurazione
1s
2s
2px
2py
2pz
px
px
pz
pz
py
py
H
C
H
Ferri Violetta
109.5°
H
H
ALCANI - ibridizzazione
Cosa succede sul carbonio?
1s
2s
2px 2py 2pz
Promozione di e-
1s
Ibridizzazione
sp3 sp3 sp3 sp3
Orbitali ibridi
y
Uhm…
Vediamo
perchè
in
il dettaglio
metano è
tetraedrico?
l’atomo di
carbonio …
x
109.5o
z
Ferri Violetta
ALCANI - Conformazione
etano
H
H
C2H6
Legame σ
H
H
La rotazione intorno
all’asse C-C è libera.
H
H
stellata
eclissata
H
HH
H
H
HH
H
H
H
H
H
H
HH
H
Ferri Violetta
H
H
H
H
H
H
H
H
ALCANI – isomeri di struttura
Consideriamo il BUTANO che ha formula molecolare C4H10
Formula di struttura Modello ball and sticks
n-butano
CH2
H3C
CH3
CH2
Teb= 0°C
ISOMERI DI STRUTTURA.
CH3
isobutano
H3C
CH
CH3
Teb= -12°C
Gli alcani a catena lineare sono chiamati normali (n-).
Gli altri sono detti ramificati
Ferri Violetta
differenti proprietà
chimiche e fisiche
ALCANI - Nomenclatura
Per dare il nome ai composti organici esistono delle regole fissate dallo IUPAC
• Alcani con n<4 nomi tradizionali
• Alcani con n>4 radice greca del n° di atomi di C + il suffisso -ano (pent- per cinque, es- per sei …)
5
3
CH2
6
H3C
CH2
4
CH2
1
2
CH2
CH3
esano
• Se l’alcano è ramificato allora la radice del nome è determinata dalla catena più lunga di atomi di C
• Negli alcani che fungono da sostituenti si sostituisce il suffisso -ano con il suffisso -il.
5
3
CH3
4
1
1
CH2
CH3
2
CH2
CH3
3
2
CH2
CH2
CH
CH3
3
4
CH2
CH2
1
2
CH
CH3
Ferri Violetta
CH3
2-metilpentano
Catena più lunga C5: pentano
CH
4-metilpentano
• I sostituenti devono avere il numero più piccolo
5
4
CH3
2-metilpentano
CH3
5
CH3
Sostituente metil metano
ALCANI - Nomenclatura
• I sostituenti vanno elencati in ordine alfabetico usando i prefissi di-, tri-, etc. per indicare la presenza di
sostituenti uguali
4
CH3
3
1
3
CH
H3C
2
4
CH3
CH3
CH
2,3-dimetilbutano
CH3
CH2
1
2
CH3
C
CH3
CH3
2,2-dimetilbutano
Vediamo un altro esempio:
CH3
9
8
7
CH3
6
5
4
3
2
1
CH3CHCH2CH2CHCH2CH2CCH3
CH2CH3
5-etil-2,2,8-trimetilnonano
CH3
ordine alfabetico
Ferri Violetta
ALCANI - REAZIONI
Gli alcani si chiamano anche paraffine (parum affinis=poco affini) perché sono caratterizzati da una
bassa reattività. Comunque, in particolari condizioni possono reagire:
O2 Combustione
CH4(g) + 2 O2
→ CO2(g) + 2 H2O(g) + calore
Combustione totale
Cosa succede se O2 è
in difetto?
CH4(g) + 3/2 O2 → CO (g) + 2 H2O(g)
Combustione parziale
Scienze vita
CO - emoglobina
La combustione degli alcani è una reazione RedOx
Alogeni (Cl2, Br2) Sostituzione con meccanismo radicalico (catalizzato UV)
Ottengo alogenoderivati: CH2Cl2 (diclorometano), CHCl3 (cloroformio), ect.
Inquinamento
Ambientale
Ferri Violetta
CICLOALCANI
CnH2n (n ≥3)
Vediamo i cicloalcani più semplici:
H2C
CicloPropano C3H6
CH2
C
H2
Struttura planare
CicloButano C4H8
H2C
CH2
H2C
CH2
Reattività
H2C
CicloPentano C5H10
Geometria
Angoli
CH2
CH2
H2C
CH2
Struttura non planare
CH2
CicloEsano C6H12
H2C
CH2
H2C
CH2
CH2
Nomenclatura: segue le regole degli alcani
5
4
6
3
CH2CH3
1
2
CH3
CH3
Ferri Violetta
1,2-dimetil-1-etilcicloesano
ALCHENI
CnH2n (n ≥2)
• Idrocarburi insaturi
• Presentano almeno 2 C ibridati sp2 che formano 3 legami σ e 1 legame .
• La nomenclatura è simile a quella degli alcani:
Il nome di base dell’idrocarburo finisce in -ene
Il doppio legame è indicato dall’atomo di Carbonio a numerazione più bassa
Etene (Etilene)
C2H4
Propene (Propilene)
C3H6
1-Butene
C4H8
CH2
2-Butene
C4H8
CH3
2-Metil – 1-Butene
Ferri Violetta
CH2
CH2
CH2
C5H10
CH2
CH
CH
CH
C
CH3
CH3
CH2
CH3
CH
CH3
CH2
CH3
ALCHENI: ETILENE
Cosa succede sul carbonio?
Consideriamo il 2°livello:
2s
2px
2py
2pz
Promozione di e-
Ibridizzazione
2s+2px+2pz
2py
sp2 sp2
sp2
Orbitali ibridizati
120o
120o
Ferri Violetta
Trigonale planare
ALCHENI: ETILENE
Legame
Legame sigma
120o
Cosa implica il doppio legame?
NO!
Ferri Violetta
I 2 orbitali p devono essere “allineati” (paralleli) per dare il legame .
Questo impedisce la rotazione dei due gruppi CH2 l’uno rispetto all’altro.
ALCHENI - ISOMERIA
Consideriamo il composto 1,2-dicloroEtene che ha formula molecolare HClC=CHCl
H
H
H
C
Cl
Teb= 60°C
Tf = -80°C
Polare
C
Cl
Cl
C
Cl
Teb= 47°C
Tf = -50°C
Non polare
C
H
ISOMERI GEOMETRICI o ISOMERI CIS - TRANS
H
C
Cl
H
H
C
C
Cl
Cl
Isomero cis
C
H
Isomero trans
Cis-1,2-dicloroEtene
H
3
Consideriamo un altro esempio:
C
6
5
CH3CH2
Ferri Violetta
Cl
4
CH
CH3
H
Trans-1,2-dicloroEtene
1
4-metil- cis-2-esene
2
C
CH3
ALCHINI
CnH2n-2 (n ≥2)
• Idrocarburi insaturi
• Presentano almeno 2 C ibridati sp che formano 2 legami σ e 2 legame .
• La nomenclatura è simile a quella degli alcani:
Il nome di base dell’idrocarburo finisce in -ino
Il triplo legame è indicato dall’atomo di Carbonio a numerazione più bassa
Acetilene (Etino)
C2H2
Propino
C3H4
1-Butino
C4H6
2-Butino
C4H6
Ferri Violetta
CH
CH
CH
CH3
CH
C
C
CH3
CH2
C
C
CH3
CH3
ALCHINI
Cosa succede sul carbonio?
Consideriamo il 2°livello:
2s
2px
2py
2pz
Promozione di e-
Ibridizzazione
2s + 2px
180o
Ferri Violetta
2py
2pz
sp
sp
Orbitali ibridi
Molecola lineare
ALCHINI
Legame
Legame
Ferri Violetta
ALCHENI E ALCHINI - REAZIONI
Le principali reazioni di alcheni e alchini sono reazioni di addizione con rottura di legami che
sono più deboli dei legami s. Le più importanti sono:
Reazioni di addizione elettrofila (HCl, HBr, H2O, Br2)
CH2
CH
CH3
+ A B
CH2
CH
H–OH /H+
CH3
H–Cl /H+
A
B
H–Br /H+
CH2
CH
H
OH
CH2
CH
H
Cl
CH2
CH
H
Br
CH3
CH3
CH3
Reazioni di idrogenazione
CH2
CH
CH3
H2/Pt
CH2
CH
H
H
CH3
Chimica
alimentare
Ferri Violetta
ALCHENI E ALCHINI - REAZIONI
I sistemi insaturi danno reazioni industriali importanti: le polimerizzazioni
Alcheni: reazioni di polimerizzazione
n CH2
CH2
cat
Etilene
*
CH2
CH2
n
*
cat
CH
n CH2
CH3
PE
CH
Propilene
n CH
H
CH
CH
CH
n
*
PP
1954 Giulio Natta (Nobel 1963)
HCl
CH
CH
H
Cl
polimerizzazione
Cl
Clururo di vinile
Ferri Violetta
CH2
CH3
1935 - Gibson e Fawcett
Alchini:
1) addizione di HCl
2) polimerizzazione
*
*
CH
CH
H
Cl
*
n
PVC
1835 - H. Regnault
IMPIEGO E DIFFUSIONE DEGLI IDROCRBURI INSATURI
Alcheni e alchini
Isoprene
CH3
Polimeri
Terpeni
Vengono prodotti:
• da alcuni insetti
• da molte piante (componenti delle resine e degli oli essenziali)
Esempi:
Limonene
(aroma buccia d’arancio)
Squalene (squalo)
Mircene
(luppolo)
Alfa pinene
(conifere)
Licopene (frutti rossi e pomodori)
Scienze
vita
Ferri Violetta
AROMATICI
Aromatico
originariamente
oggigiorno
Sostanze profumate, ad esempio Benzaldeide (mandorla, pesche, ciliegie)
Benzene (carbon fossile)
Classe di composti con un insieme di proprietà (reattività e stabilità) simili a quelle del
benzene che è il termine più importante della classe
Storia del benzene
• Fu isolato dal petrolio da Michael Faraday (1825) bicarburo di idrogeno.
• Fu sintetizzato per distillazione di acido benzoico e calce viva Mitscherlich (1833) benzino.
• Fu isolato dal catrame Mansfield (1845)
La formula molecolare del benzene (C6H6) rimase per molto tempo un rompicapo.
Le formule proposte non spiegavano la reattività che ipotizzavano simile a quella
degli alcheni e degli alchini.
La realtà sperimentale era ben diversa.
Ferri Violetta
BENZENE
Friedrich August Kekulé
nel 1865 scrisse la formula del benzene ad anello esagonale con
legami singoli e doppi alternati.
H
H
1.54 Å
6 C ibridati sp2:
Cicloesatriene
H
OSSERVAZIONE SPERIMENTALE
Tutti i legami hanno:
• uguale lunghezza
• valore a metà tra legame singolo e doppio (1.39 Å) .
1.34 Å
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
formule limite di Kekulé .
Ferri Violetta
Formule di risonanza
BENZENE
Ogni atomo di carbonio condivide con gli altri il
proprio elettrone spaiato in un sistema collettivo
(orbitale) delocalizzato esteso a tutti e sei gli atomi
H
H
H
H
H
H
H
H
H
H
Ferri Violetta
H
H
H
H
H
H
H
H
H
H
H
H
H
Aromaticità: un orbitale è esteso a più
atomi giacenti su un piano in cui vengono
condivisi 4n + 2 elettroni (n=intero)
H
IDROCARBURI AROMATICI
La nomenclatura dei derivati del benzene è simile a quella usata per i sistemi ciclici saturi.
In presenza di più sostituenti la loro posizione è indicata con i numeri:
Cl
Cl
1
NO2
6
4
2
5
4
3
Cl
Cl
3
5
6
1, 3-dicloro-2-nitrobenzene
1
NO2
2
1
CH=CH2
NO2
6
2
5
3
4
1-etenil-3-cloro-2-nitrobenzene
1-cloro-2-nitrobenzene
Per i benzeni disostituiti si possono usare i suffissi: orto (o-), meta (m-) e para (p-)
Cl
Y
orto
orto
meta
meta
Cl
Cl
Cl
para
Cl
Cl
1,2-diclorobenzene
o-diclorobenzene
Ferri Violetta
1,3-diclorobenzene
m-diclorobenzene
1,4-diclorobenzene
p-diclorobenzene
IDROCARBURI AROMATICI
Alcuni derivati del benzene hanno mantenuto i nomi tradizionali.
OH
Fenolo
idrossibenzene
CH3
Toluene
metilbenzene
COOH
Ac. Benzoico
CH
CH2
Stirene
Etenilbenzene
Gli anelli di benzene danno sistemi “condensati”:
Naftalene
Antracene
Fenantrene
Pirene
IPA
Idroc. policiclici aromatici
Fluorene
Ferri Violetta
Benzo[a]antracene
Benzo[a]pirene
IDROCARBURI AROMATICI
Gli aromatici non danno le stesse reazioni degli alcheni.
Gli aromatici danno reazioni di
SOSTITUZIONE ELETTROFILA.
Con questa reazione è possibile inserire sull’anello i seguenti gruppi
- NO2
-X
-SO3H
-R
Ferri Violetta
Nitrazione
Alogenazione
Solfonazione
Alchilazione di Friedel-Crafts
Idrocarburi: l’ambiente e la salute
Alcuni tipi di idrocarburi sono pericolosi per l’ambiente e la salute perché sono ALTAMENTE TOSSICI e/o
CANCEROGENI.
Tra i più pericolosi abbiamo:
Aria
combustione
naturali e artificiali
Benzene
IPA
lavorazione
e trasporto petrolio
Uomo
Aria che si respira
Dieta
(cottura cibi grigliati, affumicati
e vegetali a foglia larga)
Scienze vita (effetti benzene e IPA)
Ferri Violetta
Acque
Fuoriuscita del petrolio dalle petroliere, dalle
raffinerie, e dai punti di trivellazione del petrolio
in mare aperto.
Petrolio
produzione 106 ton giorno 107 ton annue finiscono
in mare
Effetti:
•Riduzione trasmissione
•Riduzione dell’ossigeno disciolto
•Soffocamento uccelli acquatici, alghe e licheni
•Moria di pesci per avvelenamento