UNIVERSITA’ POLITECNICA DELLE MARCHE
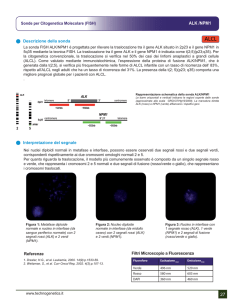
FACOLTÀ DI MEDICINA E CHIRURGIA
DIPARTIMENTO DI SCIENZE CLINICHE E MOLECOLARI
LABORATORIO DI PATOLOGIA SPERIMENTALE
____________________________________________________________
Dottorato di Ricerca in
Scienze della Sicurezza e della Tutela della Salute negli Ambienti di Lavoro
X CICLO
RUOLO DELLA PROTEINA SAM68 NELLA REGOLAZIONE
DEGLI EVENTI BIOLOGICI IN CELLULE NEOPLASTICHE
Dottorando:
Coordinatore:
Dott.ssa Giulia Borghetti
Prof. Antonio Procopio
Tutor:
Prof.ssa Francesca Fazioli
Triennio 2009-2011
1
INDICE
1.INTRODUZIONE
1.1. RBSs (RNA binding proteins) nelle malattie genetiche umane………………………….4
1.1.1 Patologie associate ad una perdita di funzione delle RBPs …..………………………….7
1.1.2. Patologie associate ad un guadagno di funzione del metabolismo dell’RNA..……… 8
1.1.3. Coinvolgimento delle RBPs nelle patologie neoplastiche………………………………10
1.2. Sam68…………………………………………………………………………………… .11
1.2.1. Storia ed Origine……………………………………………………………………………11
1.2.2 Struttura del gene…………………………………………………………………………….12
1.2.3. Struttura della proteina…………………………………………………………………….13
1.3. Ruolo di Sam68 nei processi cellulari…………………………………………………….15
1.3.1. Ruolo di Sam68 nel signalling cellulare…………………………………………………16
1.3.2. Ruolo di Sam68 nella trascrizione………………………………………………………..17
1.3.3. Ruolo di Sam68 nello splicing alternativo…….……………………………………… 18
1.3.4.Ruolo di Sam68 nella risposta allo stress genotossico………………………………...23
1.4. Ruolo di Sam68 nei processi fisiologici…………………………………………………..24
1.5. Sam68 nelle neoplasie umane……………………………………………………………..25
1.6. Il linfoma anaplastico a grandi cellule…………………………………………………….27
1.7. Il recettore tirosin-chinasi ALK…………………………………………………………...30
1.8. Ruolo di ALK nelle neoplasie umane……………………………………………………..35
1.9. L‟oncogene NPM/ALK…………………………………………………………………...36
1.10. Aspetti molecolari delle proprietà trasformanti di NPM/ALK……..……………………38
1.11. Il mesotelioma maligno della pleura……………………………………………………..41
2. SCOPO DEL LAVORO..................................................................................................................45
3. MATERIALI E METODI...............................................................................................................46
3.1. Vettori utilizzati....................................................................................................................46
3.2. Linee cellulari.......................................................................................................................51
3.3. Colture cellulari....................................................................................................................53
3.4. Pre-trattamento delle cellule................................................................................................53
3.5. Transfezione....……………………………………………………………….……………54
3.6. Infezione……………………………………………………………………………..…….55
3.7. Citofluorimetria a flusso (FACS) ........................................................................................55
3.8. Lisati cellulari......................................................................................................................56
3.9. Dosaggio delle proteine........................................................................................................57
3.10. Immunoprecipitazione........................................................................................................58
3.11. Elettroforesi su gel di poliacrilammide..............................................................................58
2
3.12. Western blot………………………………………………………………………………59
3.13. Anticorpi utilizzati………………………………………………………………………..60
3.14. Purificazione della proteina di fusione GST-PAKCRIB…………………………………61
3.15. Saggio di interazione proteica in vitro……………………………………………………….62
3.16. Saggio di interferenza dell‟RNA con plasmidi...………………………………………..62
3.17. Saggio di proliferazione, vitalità e chemio sensibilità……………………………………63
3.18. Saggi di migrazione………………………………………………………………………64
3.19. Immunofluorescenza……………………………………………………………………..65
3.20.Real Time PCR ………………………………………………………………………….. 66
4. RISULTATI……………………………………………………………………………………….67
4.1. Fosforilazione di Sam68 in cellule esprimenti ALK…..……………………………….. 67
4.2. Effetti del silenziamento di Sam68 sulla migrazione e sulla proliferazione…................68
4.3. Effetti del silemento di Sam68 sull‟azione dei chemioterapici……………………...73
4.4. Ruolo di p60src sull‟attivazione di Sam68………………………………………………...75
4.5. Associazione Sam68/Vav1………….…………………………………………………….76
4.6. Fosforilazione in vivo di Vav1……………………………………………………………78
4.7. Attivazione di Rac1……………………………………………………………………….80
4.8. Effetti biologici del silenziamento di Vav1………………………………………………82
4.9. Sam68 e mesotelioma……………………………………………………………………..83
4.9.1.Effetti del silenziamento di Sam68 su cellule MM-5…………………………………83
4.9.2. Localizzazione di Sam68 nelle cellule MM-5 dopo trattamento con cisplatino...….85
4.9.3 Effetti del silenziamento di Sam68 sull‟espressione delle isoforme di CD44…...….85
5. DISCUSSIONE.................................................................................................................................87
6. BIBLIOGRAFIA............................................................................................................................95
3
1. INTRODUZIONE
1.1. RBPs (RNA Binding Proteins) nelle malattie genetiche umane.
Le RNA binding proteins sono componenti chiave nel metabolismo dell‟RNA
regolandone ogni passaggio, dalla biogenesi, alla maturazione, alla stabilità, alla
localizzazione cellulare fino alla traduzione e allo splicing alternativo ed infine alla
degradazione (Figura 1).
Le RBPs sono in grado di formare specifici e dinamici complessi detti
ribonucleoproteine (RNP) sia con RNA codificanti che non (Glisovic, T. et al.,
2008). Inoltre studi condotti sull‟assemblaggio di questi complessi in differenti
specie supportano ormai l‟ipotesi che trascritti relativi a proteine con funzioni simili
siano legati dalle stesse RBP. (Keene, J.D. 2007). Modificazioni post-traduzionali
atte a modificare la loro capacità di legare l‟RNA o altre molecole, permettono a
queste proteine di funzionare come sensori o adattatori, rappresentando un valido
meccanismo con cui la cellula cambia velocemente profilo di espressione in risposta
a stimoli extracellulari.
L‟uomo possiede più di 500 RBPs, ognuna con una specifica affinità per il
proprio bersaglio molecolare, ma ciascuna caratterizzata dalla presenza di un
dominio legante l‟RNA (RNA Binding Domain), in singola o multipla copia (Lunde,
B.M. et al., 2007). Esistono svariate tipologie di RBD, ma tra i più comuni possono
essere annoverati (Figura 2):
RRM (RNA recognition motif): composto da 80-90 aminoacidi con una
disposizione modulare contenente due sequenze consenso ed alcuni residui
aromatici
estrememente
β1α1β2β3α2β4;
conservati
impacchettati
in
una
struttura
più del 50% delle RBPs (tra cui, ad esempio, la proteina legante
la poly(a), PABP) possiedono questo domini.
KH (K omology domain): è un dominio estremamente conservato
nell‟evoluzione, inizialmente identificato come sequenza ripetuta nelle
ribonucleoproteine hnRNP K e composto da 70-100 residui aminoacidici che
formano una struttura β1α1α2β2β3 (tipo I) o β1α1β2α2α3β3 (tipo II).
4
PAZ (Piwi/Argonaute/Zwille domain): si trova in proteine coinvolte nel
biogenesi dei miRNA, come Dicer o Argo, e il suo legame con l‟RNA è
stabilizzato da residui idrofobici.
Figura 1. Ruolo delle RBP nelle cellule eucariote. (a) Pathway del mRNA: il pre-mRNA è trascritto
dalla RNA polimerasi II e processato in mRNA maturo tramite la rimozione degli introni durante lo
splicing, la poliadenilaziione in 3’ e l’aggiunta di un un residuo di 7-metilguanosina in
corrispondenza dell’estremità 5’; il legame di specifiche RBP all’mRNA è fondamentale per il
corretto svolgimento di questi processi di maturazione. Il complesso mRNA-proteine esce dal nucleo
attraverso dei pori sulla membrana nucleare (NPC) e nel citoplasma viene riconosciuto da altre
proteine, tra cui la PABP, una proteina che riconosce la coda poli(a) degli mRNA e il fattore della
traduzione eIF4E, il quale lega il residuo di 7-metilguanosina; questi eventi permettono la
stabilizzazione e la traduzione dell’mRNA messaggero in proteina. Se sono presenti codoni di stop
prematuri, le RBP non permettono l’assemblggio del ribosoma evitando la traduzione di proteine
mutate e potenzialmente dannose. (b) Pathway dei miRNA. La biogenesi dei miRNA parte dalla
trascrizione da parte della RNApol II di microRNA primari (pri-miRNA) che vengono processati dal
complesso Drosha in micro-RNA precursori (pre-miRNA), i quali, a loro volta, sono esportati nel
citoplasma e processati dall’enzima Dicer in miRNA maturi a singolo filamento, in grado di formare
il complesso ribonucleoproteico RISC ed appaiarsi a specifici mRNA-target impedendone la
traduzione.
5
Figura 2. Struttura ottenuta tramite cristallografia dei più comuni domini in grado di legare
l’RNA. Le α-eliche sono disegnate in giallo, i β-foglietti in verde e i loop in blu
Considerando che le RBPs fanno parte di un elaborato network che regola
ogni aspetto del metabolismo dell‟RNA, qualsiasi evento che comprometta la loro
capacità associativa con gli RNAs bersaglio e/o con altri interattori cellulari può
avere conseguenze sull‟espressione genica nonché sull‟attivazione di pathways
cellulari, ed eventualmente risultare in un fenotipo patologico. Curiosamente le
patologie neurodegenerative sono le principali manifestazioni cliniche di difetti
strutturali e/o funzionali delle RBPs, probabilmente a causa dell‟alta frequenza con
cui si manifesta nelle cellule neuronali lo splicing alternativo, uno dei meccanismi di
maturazione dell‟RNA sotto il controllo di queste proteine (Gabut, M. et al., 2008).
In aggiunta è stato dimostrato che cambiamenti morfo-funzionali di queste proteine
possono contribuire alla patogenesi di altre malattie umane, tra cui principalmente
atrofie muscolari e neoplasie (Figura 3).
Figura 3. Il coinvolgimento delle RBP nelle patologie umane. L’aberrante espressione delle RBP
(in verde) è stato verificata in molte patologie umane (in arancione) tra cio malattie
neurodegenerative, atrofie muscolari e neoplasie. Il loro coinvolgimento in patologie specifiche (in
blu) può essere diretto (linea intera) o indiretto (linea tratteggiata).
6
1.1.1.Patologie associate ad una perdita di funzione delle RBPs
Sindrome dell’ X fragile: è la più comune forma ereditaria di ritardo mentale
(Garber, K.B. et al., 2008) ed è causata da una mutazione del gene FMR1.
Normalmente questo gene contiene varie ripetizioni del codone CGG in numero
variabile tra 6 e 53; negli individui affetti dalla sindrome, le ripetizioni della tripletta
CGG sono generalmente superiori a 230. Questo grado di espansione provoca la
metilazione delle citosine presenti anche livello del promotore, con conseguente
silenziamento dell'espressione. La metilazione del locus FMR1, che è situato nella
banda cromosomica Xq27.3, provoca, a quel livello, costrizione e fragilità del
cromosoma X, fenomeno che dà il nome alla sindrome. La proteina trascritta dal
gene, la FMRP, è una RBP espressa soprattutto nei testicoli e nel cervello, i tessuti
più colpiti dalla sindrome. L‟ FMRP si associa ad RNA messaggeri che codificano
per proteine neuronali, regolandone alcuni aspetti essenziali, quali la stabilità, il
trasporto lungo i dendriti e la traduzione. Sebbene alti livelli di espressione della
proteina, in vari modelli sperimentali, inducano una repressione della traduzione sia
in vitro che in vivo (Laggerbauer, B. et al., 2001, Li, Z. et al., 2001, Mazroui, R. et
al., 2002), il meccanismo con cui l‟FMRP regola la traduzione di mRNAs neurospecifici non è stato ancora chiarito. L‟identificazione e la caratterizzazione dei suoi
bersagli molecolari potrebbe fornire indizi chiave per la comprensione della
patogenesi di questa malattia ereditaria.
Sindrome neurologica paraneoplastica: Le sindromi paraneoplastiche
neurologiche rappresentano l‟effetto collaterale di una reazione del sistema
immunitario ad un tumore primario o ad una metastasi, in cui la risposta immunitaria
danneggia strutture del sistema nervoso centrale (cervello, cervelletto), periferico
(nervi) oppure le sinapsi. I sintomi sono variabili e spesso poco specifici, tanto da
essere facilmente interpretabili con altre patologie molto più frequenti, come ad
esempio le difficoltà di memoria e la depressione associata all'encefalite limbica
oppure i disturbi di sensibilità associati ad una neuropatia sensitiva. Insorgono spesso
in modo graduale e nel tempo possono essere di intensità variabile. Spesso una PNS
si manifesta prima del tumore stesso ed in tali pazienti possono essere riscontrati
specifici auto-anticorpi, importanti per la diagnosi e la terapia del tumore. In due
7
specifiche situazioni cliniche, si è dimostrato che gli auto-anticorpi prodotti sono
diretti contro RBPs e più precisamente:
nella neuropatia sensitiva paraneoplastica con o senza encefaomielite, che
può accompagnare carcinoma polmonare a piccole cellule, il carcinoma
alla prostata o il neuroblastoma. I sintomi consistono nella neuropatia
sensitiva dolorosa, con perdita di tutti i tipi di sensibilità. La
degenerazione cerebellare e le anomalie del tronco encefalico sono
variabili. L'encefalite limbica insorge con ansia e depressione,
comportando amnesia, agitazione, confusione, allucinazione e anomalie
comportamentali. Spesso tali pazienti presentano, nel siero e nel liquor,
auto-anticorpi diretti contro la proteina Hu, il cui ruolo riconosciuto è
quello di stabilizzare molti mRNAs che trascrivono per proteine rilevanti
per molte funzioni neuronali, quali il differenziamento e la plasticità
sinaptica (Bolognani, F. et al., 2008);
nell‟atassia paraneoplastica opsoclono-mioclono (POMA, Paraneoplastic
Opsoclonus- Myoclonus Ataxia) che può presentarsi in pazienti affetti da
carcinoma alla mammella, al polmone o neoplasie delle cellule del sangue
nei quali possono essere rilevati auto-anticorpi diretti contro Nova, una
RBP che regola lo splicing alternativo di svariati mRNAs coinvolti nella
trasmissione sinaptica inibitoria. (Ule, J. et al., 2003).
Atrofia muscolare spinale: Si tratta di una patologia delle cellule nervose
delle corna anteriori del midollo spinale, da cui si diramano i motoneuroni. Nella sua
forma più comune, l'atrofia muscolare spinale è una malattia autosomica recessiva,
causata da delezioni o mutazione dei geni SMN1 e SMN2, con conseguente perdita di
funzione delle proteine corrispondenti, coinvolte nell‟assemblaggio dello splisosoma
e nella localizzazione degli mRNAs, e quindi fondamentali per lo sviluppo e la
sopravvivenza dei α-neuroni della corda spinale (Carrel, T.L. et al., 2006).
1.1.2.Patologie associate ad un guadagno di funzione del metabolismo dell’RNA
Distrofia miotonica: è una malattia genetica neuromuscolare degenerativa a
carattere autosomico dominante, dovuta all‟amplificazione della tripletta CUG nel
8
gene DMPK (nella distrofia miotonica di tipo 1 - DM1) o della sequenza ripetuta
CCTG nel gene ZNF9 (nella distrofia miotonica di tipo 2 - DM2). Normalmente le
sequenze sopraindicate sono coinvolte nel legame con proteine necessarie per il
processamento nucleare dell‟RNA. Attualmente si ritiene che, sia nella DM-1 che
nella DM-2, l‟amplificazione delle sequenze osservate svolga un ruolo patogenetico
primario poiché determinerebbe un reclutamento abnorme di proteine coinvolte nel
metabolismo dell‟RNA, sottraendole ad altri trascritti ed inibendo in questo modo
importanti funzioni cellulari (Kanadia, R.N. et al., 2006).
Sindrome del tremore e atassia legata all’X fragile: si tratta di una
patologia neurodegenerativa progressiva caratterizzata da tremore intenzionale ad
esordio tardivo e andatura atassica. Sebbene siano stati descritti sia pazienti maschi
che femmine, colpisce prevalentemente i maschi di età superiore ai 50 anni. La
trasmissione è dominante; la sindrome è causata da una moderata amplificazione (da
50 fino a 200 volte) del codone CGG del gene FMR1. Anche in questo caso l‟mRNA
del FMR1 mutato non viene tradotto, ma l‟espansione moderata delle triplette porta
al legame e quindi al sequestro di proteine (come l‟hnRNPA2) coinvolte nel
processamento dell‟RNA ed alla formazione di foci intranucleolari in neuroni ed
astrociti, con conseguente progressiva neurodegenerazione (Iwahashi, C.K et al.,
2006).
Distrofia muscolare oculofaringea: è caratterizzata da ptosi palpebrale e
disfagia, associate talvolta ad altri segni a carico della muscolatura cranica e degli
arti. I primi casi furono descritti nella popolazione francese del Canada, ma è stato
successivamente dimostrato che la malattia è ubiquitaria. La malattia si manifesta
attorno alla quarta-sesta decade di vita con ptosi ingravescente, generalmente
accompagnata da contrazione compensatoria dei muscoli della fronte, che determina
una postura anomala del collo. La disfagia compare precocemente e si accompagna a
rigurgito nasale, con gravi episodi di aspirazione ab ingestis. La diagnosi si basa,
oltre che sulla distribuzione della debolezza muscolare, sul riscontro, all'esame
istologico, di inclusioni nel nucleo dei miociti. La diagnosi molecolare si basa sul
riscontro dell' espansione di una sequenza instabile di triplette GCG nel gene
PABPN1, localizzato sul cromosoma 14q, che codifica per la proteina legante la
9
poly(A) di tipo N1, coinvolta nella regolazione della poliadenilazione degli mRNAs
nascenti. Sebbene la patogenesi della malattia non è ancora ben definita, si ritiene
che l‟espansione descritta del gene PABPN1 determini un accumulo abnorme della
proteina corrispondente nel nucleo delle fibre muscolari, con conseguente
malfunzionamento (Brais, B. et al., 1998).
1.1.3.Coinvolgimento delle RBPs nelle patologie neoplastiche
Un numero sempre maggiore di studi mette in evidenza un possibile ruolo
delle RPBs nella regolazione della proliferazione e della migrazione cellulare,
rendendo plausibile l‟ipotesi che una loro disfunzione possa essere associata alla
trasformazione neoplastica. A sostegno di ciò, riarrangiamenti cromosomici che
coinvolgono geni che codificano per le proteine appartenenti alla famiglia dei fattori
di trascrizione TET sono stati descritti in associazione ad alcune tipologie di
sarcoma, quali il sarcoma di Ewing di origine familiare e il liposarcoma mixoide
(Riggi, N. et al., 2007).
Recenti studi hanno messo in evidenza una lista sempre più ampia di RBPs la
cui espressione è alterata nei tumori umani; in particolare la proteina eIF4E, fattore
di trascrizione la cui attività è regolata dalla pathway PI3K-Akt-mTOR, si comporta
come proto-oncogene, determinando trasformazione neoplastica in seguito ad iperespressione (Sonenberg, N. et al., 2007).
Inoltre, elevati livelli di SF2/ASF sono correlati a disregolazione dello
splicing degli mRNAs, tra cui quelli relativi ad oncosoppressori come la proteina
Bridging Integrator 1 (Karni, R. et al., 2007).
Tra le numerose RPBs, le proteine della famiglia STAR (Signal Transduction
and Activation of RNA) sono, tuttavia, quelle la cui espressione è più frequentemente
alterata nelle neoplasie umane, almeno sulla base degli studi finora condotti. Questo
gruppo di proteine possiede infatti domini multifunzionali che gli permettono di
interagire con molteplici pathway cellulari, rappresentando un valido meccanismo
tramite cui la cellula risponde più prontamente agli stimoli extra-cellulari senza
dover attendere l‟espressione proteica derivante da una trascrizione de novo. (Sette,
C. 2010). Tuttavia sono necessari ulteriori studi sulla correlazione tra un‟espressione
aberrante di queste proteine e lo sviluppo di neoplasie. ed è proprio su questo
10
argomento, cioè sul ruolo di uno dei membri della famiglia STAR, la proteina
Sam68, nella trasformazione neoplastica, che si è concentrata la mia attività di
ricerca in questi tre anni di dottorato.
1.2. Sam68.
1.2.1. Storia e Origini.
Alla famiglia delle proteine STAR appartengono molte proteine di organismi
diversi, quali GRP33 dell‟Artemia Salina (Cru-Alvarez, M. et al., 1987), GLD1 di
C.elegans (Jan, E. et al., 1999), HOW di Drosophila (Zaffran, S. et al., 1997) e QKI
(Mezquita, J. et al., 1998), SLM1 e 2 (Venables, J.P et al., 1999), KHDRBS2 (Wang,
L. et al., 2002) , Sam50 (DiFruscio, M. et al., 1998) e SF1(Arning, S. et al., 1996)
nell‟uomo. Questa famiglia di proteine estremamente conservate è caratterizzata
dalla presenza in ognuna di esse di un dominio strutturale capace di legare l‟RNA, il
dominio GSG (GRP33/SAM68/GLD-1), che deve il suo nome alle prime tre proteine
in cui è stato descritto. Oltre il dominio GSG, le proteine STAR presentano nella loro
struttura regioni responsabili di interazioni proteina-proteina e residui aminoacidici
bersaglio di modificazioni post-traduzionali. L‟interazione delle proteine STAR con
trasduttori intracellulari differenti nonché le diverse modificazioni post-traduzionali
ne regolano la localizzazione intracellulare e l‟affinità di legame per l‟RNA bersaglio
(Vernet, C. and Artzt, K. 1997).
Tra le proteine STAR fino ad oggi caratterizzate la proteina Sam68 (Srcassociated substrate during mitosis) è quella negli ultimi anni è stata oggetto di
maggiori studi in virtù del suo ruolo in molti processi cellulari, nonché in svariate
patologie, tra cui le neoplasie umane
Sam68 fu identificata nel 1990 nei laboratori di Tony Pawson come una
proteine di 68KDa che subiva fosforilazione in tirosina in seguito a trasfezione
cellulare con l‟oncogene v-src (Ellis, C. et al., 1990). In questo lavoro iniziale gli
autori sono stati in grado di dimostrare l‟associazione di Sam68 con Ras-GAP. La
sua purificazione fu però ottenuta da cellule NIH3T3 v-src-trasformate dal team di
McCornick tramite cromatografia da affinità; lo stesso gruppo riuscì a clonarne il
cDNA, a dimostrare la sua capacità di legare gli acidi nucleici e a caratterizzarne il
11
dominio di legame SH2 (Wong, G. et al., 1992). Due anni più tardi gruppi differenti
dimostrarono che Sam68 conteneva domini SH3 (Fumagalli, S. et al., 1994; Richard,
S. et al., 1995; Taylor, S.J. et al., 1995; Vogel, L.B. et al., 1995) e che era un
substrato di src durante la mitosi (Fumagalli, S. et al., 1994; Taylor, S.J. et al., 1995).
Solo nel 1995 fu ottenuta la sequenza murina di Sam68, omologa al 95% con quella
umana (Richard, S. et al., 1995). Il 21 Maggio 2002 la commissione per la
nomenclatura della HUGO (Human Genoma Organization) ha stabilito i nomi
KHDRBS1 e khdrbs1(KH Domain containing, RNA Binding, Signal transduction
associated 1) rispettivamente per la proteina Sam68 umana e per l‟omologa murina.
Tuttavia, per semplicità, nella comunità scientifica si è soliti chiamare questa
proteina con il suo nome originario.
1.2.2. Struttura del gene.
Figura4. Struttura del gene umano codificante per Sam68. Il gene codificante per Sam68 è
composta da 9 esoni e 8 sequenze introniche. Nella figura sono indicate le lunghezze in paia di basi
(bp) relative a ciascuno sequenza.
Ad oggi sono stati clonati sia il gene umano codificante per Sam68, che
quello di altri mammiferi quali topo e ratto (Numero di accesso GenBank:
NM_130405) e del pollo (Numero di accesso GenBank:Ayo57837). Sono stati inotre
clonati e sequenziati anche geni codificanti per proteine omologhe a quella umana
espresse in D.melanogaster (DiFruscio, M. et al., 1998) e in Torpedo Californica
(Fung, E.T. et al., 1998). Le sequenze codificanti per i domini funzionali risultano
molte conservate in tutte le specie. Nonostante non sia stato pubblicato nessun lavoro
sulla struttura genomica, avendo a disposizione l‟intera sequenza del gene umano e
murino, è possibile dedurre la struttura genica e la sequenza del trascritto utilizzando
programmi come BLAST.
12
Nell‟uomo il gene codificante per Sam68 è localizzato sul cromosoma 1 in
posizione p32 ed è composto da 9 esoni alternati a 8 sequenze introniche, per una
lunghezza totale di 30834 paia di basi. (Figura 4).
Il gene murino è strutturalmente molto simile a quello umano, ed è
caratterizzato dallo stesso numro di esoni e introni.
1.2.3 Struttura della proteina
Come tutte le proteine STAR, Sam68 presenta il dominio GSG, responsabile
del legame con l‟RNA, composto dal dominio KH (una regione di circa 200
aminoacidi omologa alla ribonucleoproteina eteronucleare K), fiancheggiato da
sequenze N e C-terminali di 80 e 30 aminoacidi rispettivamente (Figura 5). La
sequenza GXXXGXXG del dominio KH, presente nei batteri, negli archea ed in tutti
gli eucarioti, risulta essere quella maggiormente conservata (Vernet, C e Artzt, K.
1997). Grazie a questo dominio la proteina è in grado di legare l‟RNA, con
particolare affinità per le sequenza omopolimeriche, come le poly(U) e le poly(A)
(Chen, T. et al., 1997) .
Figura 5. Struttura della proteina Sam68. La molecola è composta da: dominio GSG formato dal
dominio KH fiancheggiato dalla sequenza NK (sequenza N-terminale di KH) e CK (sequenza Cterminale di KH); sei motivi consenso ricchi in prolona (P0-P5); box RGG; regioni ricche in residui
di tirosina (YY) e una sequenza di localizzazione nucleare (NLS). Sono indicate le relative posizioni
aminoacidiche.
Nella proteina Sam68 sono inoltre presenti sei regioni ricche in prolina (P0P5), tre delle quali localizzate in posizione N-terminale e due in posizione Cterminale rispetto al dominio GSG; queste regioni consentono a Sam68 di poter
interagire con domini SH3 e WW di altre proteine. Esperimenti di delezione e
mutagenesi di questa RBP hanno dimostrato che le regioni P0, P3, P4, e P5 sono
13
responsabili dell‟interazione con il dominio SH3 di src (Derry, J.J. et al., 2000).
Questa associazione è fondamentale affinché questa chinasi fosforili in tirosina
Sam68. I dominio P1, P3 e P4 associano con il dominio SH3 della subunità p85 della
PI3K (Taylor, S.J. et al., 1995), mentre il dominio SH3 della proteina Sik/BRK
nonché quelli delle proteine Itk, Tec e BTK mostrano un‟affinità maggiore per la
regione P3 (Andreotti, A.H. et al., 1997). La proteina PLCγ-1 interagisce con le
regioni P3 e P4. (Maa, M.C. et al., 1994), mentre il dominio SH3 carbossi-terminale
della proteina Vav1 si associa esclusivamente con la regione P0 (Lazer, G. et al.,
2007). È stata inoltre dimostrata l‟interazione diretta di Sam68 con i domini SH3 di
PRMT2 (Espejo, A. et al., 2002), di Grb-2, di Grap (Trub, T. et al., 19) e di Nck
(Lawe, D.C. et al., 1997). Le regioni ricche in prolina possono inoltre associarsi ai
domini WW delle proteine FBP21 e FBP30 (Bedford, M.T et al., 1998). La
metilazione dei residui di arginina di Sam68 inibisce le interazioni con i domini SH3
ma non con quelli WW. Visto che le proteine FBP21 e FBP30 sono caratterizzate da
localizzazione nucleare, questa modificazione post-traduzionale potrebbe far si che
Sam68 prenda parte maggiormente a processi nucleari a scapito di quelli
citoplasmatici (Arning, S. et al., 1996).
La regione carbossi-terminale di tutte le proteine STAR è caratterizzata dalla
presenza di residui di tirosina che possono essere fosforilati da molte chinasi, oltre
alla già citata p60src, tra cui: p59fyn (Richard, S. et al., 1995), p56lck (Vogel, L.B. et
al., 1995), ZAP-70 (Lang, V. et al., 1997) e Sik/BRK (Derry, J.J et al., 2000). Questa
modificazione post-traduzionale permette a Sam68 di poter interagire con i domini
SH2 di proteine tra cui: la subunità p85 della PI3K (Taylor, S.J. et al., 1995), PLCγ-1
(Maa, M.C et al., 1994), Sik/BRK (Derry, J.J. et al., 2000), Grb-2, Grap (Trub, T. et
al., 1997), Itk/Tec/BTK (Andreotti, A.H. et al., 1997), Nck (Lawe, D.C. et al., 1997)
e RasGAP (Richard, S. et al., 1995). La fosforilazione in tirosina, inoltre, diminuisce
drasticamente l‟affinità di Sam68 per l‟RNA.
È interessante notare che l‟interazione di Sam68 con domini SH3 di altre
proteine ne impedisce il legame con l‟RNA; è quindi probabile che l‟associazione di
questa proteina con altre molecole adattatrici la faccia dissociare dai suoi RNA
target.
Le RGG box, regioni ricche in arginina e glicina, fiancheggiano le sequenza
ricche in prolina e costituiscono potenziali siti di metilazione, reazione catalizzata
14
dall‟enzima PRMT1(Protein-arginine N-methyltransferase). La metilazione di
residui di arginina non è un meccanismo di regolazione rapido come la fosforilazione
in tirosina, è irreversibile e non influenza l‟affinità per l‟RNA come quest‟ultima. Di
conseguenza esso rappresenta, probabilmente, un processo di maturazione richiesto
per il corretto funzionamento e per la traslocazione nucleare della proteina
sintetizzata de novo (Gary, J.D et al., 1998; Cote, J. et al., 2003).
Sam68 possiede un segnale di localizzazione nucleare (NLS, Nuclear
Localization Signal) di 24 aminoacidi situato nella regione carbossi-terminale del
polipeptide che le consente di localizzarsi a livello nucleare (Ishidate, T. et al., 1997);
è bene precisare che sebbene questa proteina sia principalmente localizzata nel
nucleo, osservazioni sperimentali condotte su neuroni, fibroblasti, adipociti e
spermatociti infettati da virus, indicano la sua presenza anche a livello citoplasmatico
(McBride, A. E. et al., 1998; Paronetto M. P. et al., 2006; Ben Fredj N. et al., 2006;
Lazer G. et al., 2007).
Le proprietà biochimiche di Sam68 sono influenzate da altre modificazioni
post-traduzionali oltre quelle già citate: l‟acetilazione aumenta la sua affinità per
l‟RNA (Babic, I. et al., 2004), mentre la sumolazione catalizzata dell‟enzima SUMO
E3 ligasi promuovea la sua capacità di reprimere la trascrizione (Babic, I. et al.,
2006).
1.3. Ruolo di Sam68 nei processi cellulari.
Sam68 prende parte a numerosi processi cellulari. Questa RBP è coinvolta in
molteplici fasi del metabolismo dell‟RNA, come la trascrizione, lo splicing
alternativo e la traduzione di mRNA bersaglio; inoltre, agendo come proteina
adattatrice, potenzia le vie di segnale stimolate dalle chinasi della famiglia di Src
(Paronetto, M.P. et al., 2003) ed interagisce con varie proteine coinvolte nella
trasduzione del segnale attivata dai recettori per i fattori di crescita (Lukong, K.E.
and Richard, S., 2003); Sam68 promuove l‟adesione e la motilità cellulare (Huot,
M.E. et al., 2009b) ed è coinvolta nella risposta allo stress genotossico (Busà, R. et
al., 2010).
15
1.3.1. Ruolo di Sam68 nel signalling cellulare.
Nei linfociti T la stimolazione del recettore TCR e la conseguente attivazione
delle chinasi della famiglia src p56lck e p59fyn porta all‟aumento della fosforilazione
in tirosina di Sam68 promuovendone l‟interazione con varie molecole coinvolte nella
trasduzione del segnale del TCR, tra cui PI3K, PLCγ-1 e di Grb-2; anche l‟Itk, è in
grado di interagire tramite il suo dominio SH3 con Sam68 e di fosforilarla (Najib, S.,
et al, 2005).
Nei monociti e nei linfociti, Sam68 è coinvolta nella trasduzione del segnale
di un altro recettore di membrana, l‟Ob-R, il recettore della leptina (SanchezMargalet, V. et al., 2003). Ugualmente ad altri recettori per le citochine, questa
proteina di membrana manca di un‟attività tirosin-chinasica intrinseca, ma è in grado
di attivare la pathway delle JAK/STAT promuovendo fosforilazione di molte
proteine, tra cui Sam68 (Najib, S. et al., 2005).
Nelle cellule di epatoma di ratto transfettate con il recettore umano per
l‟insulina (HTC-IR), la stimolazione con questo ormone promuove la fosforilazione
in tirosina di Sam68; questo effetto è dose-dipendente, rapido e reversibile (SanchezMargalet, V e Najib, S. 1999); la proteina fosforilata può essere reclutata da
differenti complessi attivati dalla cascata di trasduzione del recettore dell‟insulina;
negli adipociti Sam68, quando fosforilata in tirosina, è in grado di formare un
complesso ternario con la PI3K e con IRS-1 e di reclutare tramite il suo dominio SH2
la proteina Ras-GAP, in grado di attivare il pathway di Ras; inoltre nelle cellule
HTC-IR Sam68 è associato costitutivamente a Grb2 ed in seguito a stimolazione con
insulina essa è in grado di reclutare la proteina GAP nel complesso Grb2-SOS-Ras,
con conseguente aumento dell‟attività GTPasica e di scambio GDP/GTP
fondamentale per l‟attività di Ras (Najib, S. e Sanchez-Margalet, V. 2002).
Numerosi studi svolti negli ultimi anni hanno evidenziato il ruolo di questa
proteina nelle pathways di trasduzione del segnale, spesso alterati, delle cellule
neoplastiche. Paronetto e collaboratori hanno dimostrato che l‟assemblaggio del
complesso ternario Sam68/PLCγ/Fyn è stimolato dall‟espressione di una forma
troncata del RTK (RTK, Receptor Tyrosine Kinase) c-KIT, espresso in maniera
aberrante in un sottotipo di cancro alla prostata (PCa). L‟espressione di questo
recettore correla con un aumento della fosforilazione in tirosina di Sam68 (Paronetto,
16
M.P. et al., 2004). Nelle cellule di cancro alla mammella, in seguito a stimolazione
con EGF, la chinasi BRK promuove la fosforilazione di Sam68, diminuendone
l‟affinità per l‟RNA e promuovendo una sua rilocalizzazione transiente nel
citoplasma (Lukong, K.E. et al., 2005); è importante sottolineare che in queste cellule
la BRK e Sam68 sono iper-espresse e promuovono entrambe la proliferazione e
l‟invasività cellulare (Ostander, J.H. et al., 2010; Song, L. et al., 2010).
Infine, Sam68 è coinvolta nella regolazione della migrazione cellulare: il
silenziamento di Sam68 nelle cellule Hela è associato ad una drastica diminuzione
delle capacità migratorie di queste cellule (Huot, M.E. et al., 2009b), mentre
fibroblasti
embrionali
murini
Sam68-/-
sono
caratterizzati
da
difetti
nell‟organizzazione del citoscheletro di actina (Huot, M.E et al., 2009a).
1.3.2. Ruolo di Sam68 nella trascrizione.
Numerosi studi indicano Sam68 come l‟anello di congiunzione tra la
trasduzione del segnale e la trascrizione genica.
Questa proteina è in grado di inibire la trascrizione mediata dal cofattore della
trascrizione CBP, legandosi ad esso e impedendo il legame con molecole che ne
promuovono l‟attività (Hong, W. et al., 2002). CBP controlla la trascrizione di geni
codificanti per proteine che regolano il ciclo cellulare, come la ciclina D1 e la ciclina
E; in linea con queste osservazioni, l‟ iperespressione di Sam68 nelle cellule NIH3T3 è associata ad una repressione della trascrizione di queste cicline (Taylor, S.J. et
al., 2004). Recenti studi hanno dimostrato che la di repressione della trascrizione del
gene della ciclina D1 (CCND1) può avvenire anche con un meccanismo che
coinvolge il fattore di splicing SF2/ASF. Questa RBP favorisce la SUMOilazione di
Sam68 catalizzata dell‟enzima PIAS1; in seguito a questa modificazione Sam68 è in
grado di legare l‟enzima istone de-acetilasi, inibendo in questo modo la trascrizione a
partire dal promotore di CCND1 (Pelisch, F. et al., 2010).
Nelle cellule di cancro alla prostata PCa, Sam68 è iperespressa ed interagisce
con il recettore degli androgeni AR aumentandone la capacità trascrizionale. Anche
la ciclina D1 è in grado di legare l‟AR, ma il suo effetto è contrario rispetto a quello
di Sam68: Questa RBP promuove, quindi, l‟attività del recettore AR sia tramite
17
un‟interazione diretta sia indirettamente reprimendo la trascrizione del gene per la
ciclinaD1 (Rajan,P. et al., 2008) (Figura 6).
Figura 6. Modello schematico del ruolo di Sam68 nella regolazione della trascrizione.
Repressione della trascrizione dei geni target di CBP:Sam68 interagisce con CBP, competendo con
fattori necessari per la trascrizione e promuovendoo il legame di fattori repressori della trascrizione
(TF); Sam68 interagisce direttamente con il recettore per gli androgeni AR promuovendo la
trascrizione dei geni target (es:PSA); il complesso PIAS1-SF2/ASF modifica Sam68 per
SUMOilazione determinandone il legame con la istone de-acetilasi (HDAC) e la conseguente
repressione della trascrizione del gene codificante la ciclina D1.
1.3.3. Ruolo di Sam68 nello splicing alternativo
Lo splicing alternativo è un processo che, tramite un diverso arrangiamento
degli esoni, permette a molti geni umani di trascrivere RNA messaggeri maturi
differenti a partire da un unico precursore; questo particolare meccanismo di
maturazione dei trascritti è stato una conquista chiave nell‟evoluzione degli
organismi superiori in quanto rappresenta un raffinato meccanismo di generazione
della diversità. Alla scelta di quali esoni variabili includere nell‟mRNA maturo
partecipano, oltre al canonico apparato dello spliceosoma, molti altri fattori, come ad
esempio le proteine SR e le ribonucleoproteine hnRNP, che contribuiscono quindi al
complesso meccanismo di regolazione dello splicing alternativo (Black,D.L. 2003).
18
Grossman e collaboratori furono i primi a suggerire un possibile ruolo di Sam68
nello splicing alternativo; questi ricercatori osservarono che Sam68 era in grado di
legare un tratto ricco in pirimidine localizzato vicino ad un sito di splicing del premRNA della β-tropomiosina insieme alla proteina U2AF65, coinvolta nel processa
mento di questo messaggero (Grossman, J.S. et al., 1998); ma la vera conferma del
coinvolgimento di Sam68 in questo meccanismo arrivò solamente qualche anno
dopo, quando ne fu dimostrato il ruolo diretto nel processamento del pre-mRNA di
CD44. Questa glicoproteina transmembrana è coinvolta nell‟adesione, nella
proliferazione e nella migrazione cellulare. Questa capacità di CD44 di intervenire in
diversi processi cellulari risiede nel meccanismo di processamento alternativo del
suo pre-mRNA, che può essere processato in circa 20 mRNA alternativi. Il gene
CD44 è, infatti, composto da dieci esoni costitutivi , presenti cioè in tutte le
isoforme, e dieci esoni variabili, posti tra gli esoni costitutivi c5 e c6 (Figura 7),
codificanti per domini localizzati nella regione extracellulare della proteina. Di
conseguenza queste isoforme proteiche sono caratterizzate da differente affinità per
la matrice extracellulare nonché da una diversa abilità di interagire con fattori di
crescita e di rendere la cellula pronta a rispondere a stimoli extracellulari (Cheng, C.
and Sharp, P.A., 2006). In particolare l‟espressione delle isoforme contenenti l‟esone
variabile 5 (CD44v5) conferisce alle cellule capacità migratorie ed è riscontrabile
durante il movimento delle cellule T e durante la fase invasiva di molti tumori
(Matter, N. et al., 2002). Sam68, quando fosforilata in serina e treonina in seguito ad
attivazione della pathway Ras/MAPK, promuove l‟inclusione dell‟esone variabile v5
del mRNA maturo di CD44 (Matter, N. et al., 2002). Studi successivi hanno
dimostrato che la fosforilazione in serina e treonina, oltre ad aumentare l‟affinità di
Sam68 per l‟RNA, ne promuove il legame con la proteina di rimodellamento della
cromatina Brm e con ribonucleoproteina U5; la formazione di questo complesso sul
pre-mRNA di CD44 rallenta la RNA polimerasi II, consentendo l‟inclusione di esoni
alternativi (Batschè, E. et al., 2006). Infine, l‟abolizione dell‟espressione di Sam68
nelle cellule Hela riduce l‟inclusone anche di altri esoni variabili di CD44 (Cheng, C.
and Sharp, P.A., 2006).
19
Figura 7. Splicing alternativo del gene CD44. Il gene di CD44 è composto da 10 esoni costitutivi (in
arancione) e 10 esoni variabili (in blu), soggetti a eventi di splicing alternativo. Sam68, quando
fosforilato dalle chinasi della famiglia MAP, promuove l’inclusione dell’esone 5 nell’mRNA maturo
di CD44.
Il complesso Bmr/Sam68 regola inoltre lo splicing dell‟mRNA policistronico
del papilloma virus ed anche in questo caso l‟attività di Sam68 è regolata dalla sua
fosforilazione da parte delle MAPK (Rosemnberger,S. et al., 2010).
La ciclina D1 è un proto-oncogene che codifica per due isoforme, la variante
D1a, full-lenght, ed una variante più corta, la ciclina D1b, che viene trascritta in
seguito alla mancata eliminazione dell‟introne 4 dal pre-mRNA, evento che porta
alla prematura terminazione della traduzione (Figura 8); la variante breve è
caratterizzata da un‟attività trasformante maggiore rispetto all‟isoforma full-lenght,
sebbene non se ne conoscano le ragioni (Knudsen, K.E 2006).
Nelle linea cellulare di carcinoma prostatico PCa, Sam68, quando fosforilata
dalle chinasi MAP, promuove l‟espressione dell‟isoforma D1b legando una sequenza
all‟interno dell‟introne 4 del pre-mRNA ed impedendone l‟excisione. In linea con
queste osservazioni lo splicing alternativo della ciclina D1 è stimolato
dall‟espressione di una forma oncogenica di Ras, mentre l‟over-espressione della
tirosin-chinasi Fyn, appartenente alla famiglia src, abolisce completamente
l‟espressione della variante D1b. La fosforilazione in tirosina, come già
precedentemente sottolineato, diminuisce l‟affinità di Sam68 per l‟RNA, impedendo
il legame si questa proteina con l‟introne 4, e permettendo alle ribonucleoproteine
dello spliceosoma di legarsi al pre-mRNA e procedere nell‟eliminazione dell‟introne
(Paronetto, M.P et al., 2010).
20
Figura 8. Splicing alternativo del gene codificante per la ciclina D1. Quando fosforilata dalle
MAPK, Sam68 si lega al pre-mRNA in corrispondenza dell’introne 4, promuovendo l’interruzione
prematura della traduzione e la conseguente codifica della variante D1b, con attività trasformante; la
fosforilazione in tirosina di questa RBP è, al contrario, correlata con una diminuzione della sua
affinità per l’RNA; ciò permette l’espressione dell’isoforma canonica full-lenght D1a.
Il gene BCL-X codifica per due isoforme con effetti sulla sopravvivenza
cellulare diametralmente opposti. L‟esone 2 di questo gene contiene infatti due siti di
splicing in 5‟ alternativi; la scelta di quello prossimale porta alla traduzione della
proteina Bcl-XL , cioè l‟isoforma di maggior dimensione e con proprietà antiapoptotiche, mentre la scelta del sito distale porta alla codifica della variante breve,
Bcl-XS, una proteina con proprietà pro-apoptotiche (Figura 9).
Nelle cellule HEK293 l‟iper-espressione di Sam68 promuove lo splicing della
variante pro-apoptotica Bcl-XS (Paronetto, M.P., et al., 2007). Questo studio
suggerirebbe quindi che l‟up-regolazione di Sam68 danneggi la sopravvivenza
cellulare;questa osservazione è però smentita dal fatto che nelle linee cellulari
derivanti da carcinoma prostatico sia Sam68 si Bcl-XL sono espresse ad alti livelli.
(Mercatante, D.R et al., 2002, Busa, R. et al., 2007). D‟altro canto, la completa
abolizione di questa RBP nelle cellule PCa causa una marcata diminuzione dei livelli
di espressione di Bcl-XL (Busà, R. et al., 2007); questi risultati apparentemente in
conflitto potrebbero essere spiegati dall‟osservazione che la fosforilazione in tirosina
di Sam68 mediata delle chinasi della famiglia Src, estremamente attive in queste
cellule, promuove lo splicing dell‟isoforma Bcl-XL. (Paronetto, M.P. et al., 2007).
21
Figura 9. Sam68 regola lo splicing del gene BclX. Sam68 è necessario per lo splicing dell’isoforma
BclXs; d’altronde, quando fosforilata in tirosina, l’affinità di questa RBP per l’RNA diminuisce e
viene tradotta la variante BclXl.
Sam68 è coinvolto anche in splicing di messaggeri che codificano per
proteine coinvolte nel differenziamento cellulare. Chawla ed il suo gruppo hanno
dimostrato che questa proteina è necessario per il differenziamento delle cellule
neuronali, in quanto regola lo splicing di molti mRNA aventi un ruolo chiave nella
neurogenesi (Chawla, G. et al., 2009) ed il cui alterato processamento potrebbe
essere alla base dei difetti nella coordinazione motoria osservati nei topi Sam68-/(Lukong, K.E. and Richard, S. 2008).
L‟attività di Sam68 non è rilevante solamente nei processi fisiologici, ma è
coinvolta anche nella patogenesi di malattie neurodegenerative; in pazienti affetti da
atrofia spinale muscolare, Sam68 promuove lo splicing alternativo del gene SMN2
con conseguente espressione di una proteina non funzionale (Pedrotti, S. and Sette,
C., 2010). Nelle cellule di pazienti affetti da sindrome del tremore e atassia legata
all‟X fragile , Sam68 è sequestrata in aggregati di RNA, agendo come centro di
reclutamento per altre molecole coinvolte nella maturazione dell‟RNA; questo
meccanismo potrebbe essere la causa dei difetti nella maturazione degli mRNA che
caratterizzano la patogenesi di questa malattia (Sellier, C. et al., 2010).
22
1.3.4. Ruolo di Sam68 nella risposta allo stress genotossico
Le cellule hanno sviluppato meccanismi di difesa per far fronte a svariate
tipologie di stress che perturbano la loro omeostasi, come lo stress ossidativo e lo
shock al calore o contro agenti che possono danneggiare l‟integrità del genoma,
come i raggi ultravioletti e agenti alchilanti. A seconda della natura e della durata
dello stress, la cellula adotta meccanismi differenti per limitare e riparare i danni,
come l‟arresto del ciclo cellulare e l‟attivazione di meccanismi di riparo del DNA; se
tuttavia, tutto ciò non è sufficiente, se il danno è troppo esteso, le cellule attivano il
programma di morte. La risposta cellulare allo stress genotossico è estremamente
complessa, ma molto studiata date le forti implicazioni cliniche nella chemioterapia;
molti farmaci chemioterapici inducono infatti la rottura della doppia elica del DNA
direttamente o indirettamente, alterando l‟attività di enzimi coinvolti nella
processazione del DNA, come le topoisomerasi. Sebbene in seguito al trattamento
con questi farmaci, la maggior parte delle cellule va incontro ad apoptosi, alcune
cellule neoplastiche adottano meccanismi di risposta allo stress, i quali le rendono
resistenti alla chemioterapia. Recenti studi dimostrano che lo stress genotossico
induce in queste cellule modificazioni nel profilo di espressione dovute a
cambiamenti nello splicing alternativo (Biamonti, G. and Caceres, J.F., 2009).
Il silenziamento di Sam68 nelle cellule LNCaP, cellule androgeno-responsive
derivate da carcinoma prostatico, è stato associato ad una maggiore sensibilizzazione
all‟apoptosi indotta da cisplatino e ectoposide. Inoltre è stato dimostrato che il
trattamento con mitoxantrone, un inibitore della topoisomerasi II, determina nella
linea cellulare di carcinoma prostatatico PC3, una rilocalizzazione di Sam68, che da
una diffusa distribuzione nucleoplasmatica, passa ad una distribuzione in aree ben
distinte dall‟apparenza granulare, presenti sia a livello nucleare che citoplasmatico. È
stata avanzata l‟ipotesi che tali granuli nucleari e citoplasmatici indotti dallo stress
genotossico rappresentino foci trascrizionalmente attive.. Questa ipotesi è avvalorata
dalla presenza di altre RBP coinvolte nello splicing alternativo, come TIA -1, hnRNP
A1, e ASF/SF2 e all‟RNA polimerasi II in forma attiva; si può quindi dedurre che
questi granuli costituiscono delle foci trascrizionalmente attive (Figura 10).
Infine la rilocalizzazione di Sam68 indotta dal mitoxantrone correla con
l‟aumento dell‟espressione dell‟isoforma CD44v5; è quindi probabile che la
23
compartimentalizzazione di Sam68 e degli altri fattori di splicing in queste foci
permetta alla cellula di ridirezionare gli eventi di splicing alternativo, aumentando la
traduzione di quelle isoforme proteiche che aumentano la sopravvivenza cellulare e
la risposta al danno al DNA. (Busà, R. et al., 2010).
Figura 10. La rilocalizzazione di Sam68 è un evento fondamentale nella risposta allo stress
genotossico. Le cellule PC3 sono state trattate per 24h con mitoxantrone 5µM e sottoposte ad analisi
confocale utilizzando anticorpi specifci per Sam68 (colorazione rossa) e per altre proteine coinvolte
nello splicing e nella trascrizione delle RNA (colore verde); in particolare (a) anti- hnRNP A1; (b)
anti-TIA-1; (c)anti- ASF/SF2; (d) H5 antl’RNApol II fosforilata
1.4. Ruolo di Sam68 nei processi fisiologici
Lo sviluppo di un modello murino knockout per Sam68 ha permesso di
identificare i processi fisiologici in cui questa proteina è coinvolta. Questo modello è
caratterizzato da un‟alta mortalità subito dopo la nascita dovuta a cause ancora
sconosciute; tuttavia, gli animali che sopravvivono al periodo perinatale mostrano,
contro ogni aspettativa, una durata della vita normale. I topi Sam68-/- non mostrano
un aumento della frequenza di tumori o di malattie autoimmunitarie e di altra causa.
Gli animali giovani mostrano una massa ossea del tutto simile a quella dei loro
coetanei wild type, e la conservano anche durante la vecchiaia (dopo i 12 mesi di
età), non andando incontro all‟osteoporosi fisiologica indotta dall‟età; la perdita di
24
densità ossea dovuta all‟età è sempre accompagnata ad un aumento della
differenziazione della linea mesenchimale nella linea adipocitaria a scapito di quella
osteoblatica; il differente metabolismo osseo dei topi Sam68-/- è presumibilmente
imputabile al fatto che le cellule mesenchimali di questi animali si differenziano
quasi esclusivamente in osteoblasti, mentre la differenziazione in adipociti è
gravemente compromessa, a prescindere dall‟età dell‟animale (Richard, S. et al.,
2005).
Sam68 è coinvolta anche nel differenziamento delle cellule del sistema
nervoso: infatti, come già accennato nel paragrafo 1.3.3, in seguito ad abolizione
dell‟espressione si Sam68, le cellule progenitrici neuronali non sono più in grado di
differenziarsi. I topi Sam68-/- mostrano, difetti nella coordinazione motoria ma non
nella neurogenesi; è possibile quindi che i difetti che caratterizzano in vitro questo
processo siano causati da una perdita di funzioni cellulari generali, come il controllo
del ciclo cellulare; un‟altra ipotesi è quella che in vivo Sam68 sia sostituita nel suo
ruolo da altre proteine, come Slm-1 e Slm-2, appartenenti alla sua stessa famiglia
(Chawla, G. et al., 2009).
Infine, le femmine di topo Sam68-/- non sviluppano organi sessuali completi:
lo sviluppo dellla ghiandola mammaria e dell‟utero risultano incompleti negli
animali di 6 settimane, con un recupero solo parziale alla dodicesima settimana di età
(Richard, S. et al., 2008); inoltre le femmine Sam68-/- sono caratterizzate da una
riduzione del numero dei follicoli ovarici sviluppati, da un alterato ciclo mestruale e
da una fertilità ridotta rispetto alle femmine wild type; parallelamente nei maschi
Sam68-/- la fertilità cala drasticamente, in quanto Sam68 regola la trascrizione, lo
splicing, e la stabilità di molti mRNA fondamentali nella spermatogenesi (Paronetto,
M.P., et al., 2009).
1.5. Sam68 nelle neoplasie umane.
Fin da quando Sam68 fu caratterizzata come substrato della chinasi Src, è
stato sempre stato ipotizzato un suo ruolo nella trasformazione neoplastica
(Fumagalli, et al., 1994).
Gli studi iniziali identificarono Sam68 come un oncosoppressore: l‟overespressione di Sam68 in cellule NIH3T3 causa l‟arresto del ciclo cellulare in G1 e
25
l‟induzione dell‟apoptosi (Taylor, S.J. et al., 2004), mentre l‟abolizione della sua
espressione in queste cellule è associata ad una crescita ancoraggio-indipendente
nonché alla capacità di formare metastasi quando iniettate nei topi nudi. La
reintroduzione di Sam68 in queste cellule, tuttavia, non reverte il fenotipo,
suggerendo che la trasformazione cellulare sia sostenuta anche da altri fattori (Liu,
K. et al., 2000);
Tuttavia, studi più recenti suggeriscono per questa proteina il ruolo di protooncogene. Infatti, nei topi Sam68-/- non si osserva un aumento della frequenza di
sviluppo di neoplasie in vivo rispetto ai topi wild type, come accadrebbe se Sam68
fosse un oncosoppressore. Inoltre, analisi immunoistochimiche indicano che Sam68 è
over-espressa nei tessuti dei pazienti affetti da tumore alla prostata (Busà, R. et al.,
2007), alla mammella (Song, L. et al., 201) e da carcinoma renale (Zhang, Z. et al.,
2009).
L‟attivazione costitutiva di Src nelle cellule di PCa dovuta all‟espressione del
recettore troncato c-Kit stimola la fosforilazione di Sam68 sia in vivo che in vitro
(Paronetto, M.P. et al., 2004); l‟espressione di questa RBP è, inoltre, fondamentale
per la proliferazione nonché per la resistenza ai farmaci chemioterapici (Busà, R. et
al., 2007; Busà, R. et al., 2010) contribuendo così alla sopravvivenza delle cellule di
tumore alla prostata; fondamentale è la sua abilità di modulare gli eventi di splicing
di geni come CD44, BclX e CiclinaD favorendo l‟espressione di isoforme che
favoriscono la proliferazione, la migrazione e la resistenza all‟apoptosi. Infine,
Sam68 favorisce l‟espressione del recettore per l‟androgeno (AR) e la sua attività
trascrizionale, molto importante nell‟oncogenesi prostatica.
Nelle linee cellulari di cancro alla mammella la deplezione di Sam68 provoca
un aumento dell‟espressione di p21 e p27, inibitori delle chinasi ciclina-dipendenti,
riduce la fosforilazione della proteina Rb e della proteina Akt, con conseguente
attivazione dei fattori di trascrizione della famiglia FOXO e arresto del ciclo
cellulare (Song, L. et al., 2010). Questi risultati sono in linea con quelli ottenuti in
vivo: nei topi l‟aploinsufficienza di Sam68 nelle cellule della mammella ritarda
l‟insorgenza
di
tumori
alla
ghiandola
mammaria
indotti
dall‟espressione
dell‟oncogene del polioma virus PyMT e riduce la disseminazione delle metastasi in
vivo (Richard, S. et al., 2008).
26
L‟aumento dell‟espressione di Sam68 correla con una cattiva prognosi sia nel
carcinome alla mammella (Song, L. et al., 2010) che in quello renale (Zhang, Z. et
al., 2009); in entrambi i casi, inoltre la localizzazione citoplasmatica di questa
proteina rappresenta un fattore indipendente di prognosi negativa. È possibile che nel
citoplasma delle cellule tumorali in stadio avanzato Sam68, interagendo con proteine
coinvolte nella traduzione e con i polisomi (Paronetto, M.P. et al., 2009) contribuisca
non solo allo splicing ma anche alla traduzione di geni coinvolti nella trasformazione
neoplastica.
Anche l‟interazione altre proteine citoplasmatiche risulta estremamente
importante ai fini delle sue proprietà trasformanti: RET/PTC2 e RETMEN2B, due
oncogeni implicati nella patogenesi di tumori alla tiroide stimolano la fosforilazione
di Sam68 anche se non si è ancora indagato a fondo sulla rilevanza di questo evento
(Gorla, L. et al., 2006). Approcci proteomici individuano inoltre Sam68 come una
delle proteine associate al dominio SH3 carbossi terminale di Vav1, una GNEF
(Guanine nucleotide Exchange Factors) di Rac. Mutazioni del dominio SH3 di
Vav1 che ne impediscono il legame con Sam68 aboliscono anche il potenziale
trasformante Di Vav1, mentre la co-espressione di queste due proteine nei fibroblasti
NIH-3T3 promuove la trasformazione (Lazer, G. et al., 2007).
La leucemia mieloide acuta è una neoplasia caratterizzata da traslocazioni
cromosomiche che portano all‟espressione di proteine di fusione oncogeniche, come
MLL-EEN, (So, C.W. et al., 1997). Questa proteina chimerica possiede un dominio
SH3 necessario per le sue capacità trasformanti, in grado di legare quattro regioni
ricche in prolina di Sam68; la soppressione dell‟espressione di Sam68 abolisce la
trasformazione mediata dall‟oncogene MLL-EEN, confermando il ruolo critico della
RBP nella via di trasduzione di questo oncogene. (Cheung, N. et al., 2007).
1.6. Il linfoma anaplastico a grandi cellule.
Il linfoma anaplastico a grandi cellule (ALCL, Anaplastic Large Cell
Lymphoma) è un tipo di linfoma non Hodgkin‟s (NHL), definito per la prima volta
nel 1985 come linfoma pleiomorfico a cellule grandi e caratterizzato da una
morfologia anaplastica, frequente infiltrazione dei seni linfoidali e forte espressione
dell‟antigene Ki-1, oggi più diffusamente conosciuto come antigene CD30 (Stein, H.
27
et al., 1985). A causa della loro inusuale modalità di crescita, in passato gli ALCL
sono stati spesso erroneamente diagnosticati e scambiati per carcinomi metastatici,
istiocitosi maligne o melanomi. Di fatto, l‟espressione dell‟antigene CD30 non è una
caratteristica strettamente distintiva degli ALCL, dato che può essere presente in
altre forme neoplastiche, incluse patologie sia di tipo NHL, sia di tipo Hodgkin‟s e in
casi di carcinoma embrionale (Chiarle, R. et al., 1999). A complicare ulteriormente la
diagnosi di ALCL, è l‟ esistenza di diverse varianti; oltre al sottotipo predominante,
sono state, infatti, identificate varianti più rare di tipo pleiomorfico, monomorfico, a
piccole cellule, varianti correlate a patologia Hodgkin‟s-simile, varianti linfoistiocitiche dove un gran numero di istiociti sono frammisti a cellule tumorali e
forme con quadro istologico sarcomatoide ricco di cellule giganti e neutrofile (Kadin,
M. E., 1997; Chan, J. K. 1998; Kinney, M. C., and Kadin, M. E., 1999; Skinnider, B.
F. et al., 1999) (Figura 11).
A
B
A
A
C
A
D
E
Figura11 . Varianti istologiche degli ALCLs ALK-positivi.A Colorazione ematossilina-eosina di sezioni
di linfonodo in paraffina. (A) Variante pleiomorfica: le cellule sono displastiche, con nuclei a bordi
frastagliati e abbondante citoplasma eosinofilo. Tra le varianti pleomorfiche sono comprese forme
rare come la sarcomatosa che qui non è mostrata a causa della sua rarità; (B) Variante
monomorfica: le cellule hanno dimensioni medie, poco differenti tra loro e nuclei sottili; (C)
Variante “a piccole cellule”: è caratterizzata dalla predominanza di piccoli linfociti irregolari, e
qualche cellula tumorale di grandi dimensioni; (D) Variante linfoistiocitica: è costituita da piccoli
linfociti, istiociti plasmacitoidi e poche cellule tumorali di maggiori dimensioni; (E) Variante
Hodgkin’s-simile: le cellule hanno l’aspetto di cellule di Reed-Sternberg con grandi nucleoli.
A
28
Anche le manifestazioni cliniche sono notevolmente eterogenee e possono
includere presentazioni sistemiche nodali o extra-nodali oppure presentazioni
primarie e cutanee. Gli ALCL si possono, inoltre, manifestare secondariamente in
pazienti con positività per il virus HIV o in seguito ad altri disturbi linfoproliferativi
(Morris, S. W. et al., 2001).
Il fenotipo degli ALCL è prevalentemente di tipo T o nullo e, più raramente,
di tipo B (Gascoyne, R. D. et al., 1999). Deve essere comunque sottolineato che la
maggior parte degli studiosi non considera le forme a cellule B come ALCL; infatti,
entrambe le classificazioni REAL (Revised European American Lymphome) e WHO
(World Health Organisation) escludono i casi a fenotipo B dagli ALCL, collocandoli
in una categoria distinta e definita come linfoma diffuso a grandi cellule B (Harris,
N. L. et al., 1994).
L‟ALCL è un tumore relativamente infrequente; esso infatti rappresenta meno
del 5% dei NHL ed il 10-20% delle forme ad alto grado di aggressività nei pazienti
adulti (Kadin, M. E. and Morris, S. W., 1998), mentre mostra un picco di incidenza
nell‟infanzia, dove rappresenta circa il 40% dei linfomi non Hodgkin‟s diagnosticati
nei pazienti pediatrici (Sandlund, J. T. et al., 1994).
Alla fine degli anni ottanta, poco dopo l‟iniziale definizione dell‟ALCL,
un‟alterazione citogenetica, e più precisamente la traslocazione cromosomica
t(2;5)(p23;q35), è stata descritta nel 45% dei casi (Kaneko, Y. et al., 1989; LeBeau,
M. M. et al.,1989; Rimokh, R. et al., 1989; Bitter, M. A. et al., 1990; Mason, D. Y. et
al., 1990). Successivamente, nel 1994, il gruppo di Morris S. W. ha identificato i geni
coinvolti in questa traslocazione cromosomica e più precisamente
il gene che
codifica per la nucleofosmina (NPM) (presente sul locus 5q35) ed un nuovo gene
(localizzato nel locus 2p23) codificante per un recettore ad attività tirosin-chinasica,
per questo originariamente denominato chinasi del linfoma anaplastico (ALK,
Anaplastic Lymphoma Kinase) (Morris, S. W. et al., 1994). La caratterizzazione
molecolare di questa traslocazione è stata particolarmente rilevante in campo
diagnostico, portando alla definizione di una nuova entità tumorale nell‟ambito
dell‟eterogeneo gruppo degli ALCLs, in base alla presenza dell‟espressione aberrante
del gene ALK e denominata “linfoma ALK positivo” (Benharroch, D. et al., 1998), o
più informalmente “ALKoma”.
29
In base agli studi effettuati su un numero ampio di pazienti affetti da ALCL, è
risultato che i linfomi ALK-positivi hanno generalmente una prognosi migliore
rispetto a quelli ALK-negativi (Sandlund, J. T. et al., 1994; Shiota, M. et al., 1995;
Nakamura, S. et al., 1997), sebbene bisogna tener conto che questa differenza risente
anche della più giovane età della popolazione colpita da linfomi ALK-positivi.
Oltre alla proteina di fusione NPM/ALK, riscontrata con una frequenza pari
al 70-80% dei casi di ALKoma (Jaffe, E. S. et al., 2001), altri riarrangiamenti
cromosomici sono stati descritti negli ALCL ALK-positivi, suggerendo meccanismi
multipli dell'attivazione di ALK nella linfomagenesi.
Le proteine di fusione di ALK descritte negli ALCL ALK-positivi,
condividono alcune caratteristiche comuni. Innanzitutto sono tutte proteine
ampiamente espresse nelle cellule ematopoietiche; di conseguenza il promotore che
ne controlla la trascrizione determina inevitabilmente l‟espressione aberrante della
porzione citoplasmatica di ALK ad esse fusa. In secondo luogo, la loro
localizzazione cellulare influenza profondamente quella del prodotto di fusione.
Infine, generalmente esse presentano domini di oligomerizzazione, che possono
essere alla base dell‟attivazione costitutiva di ALK e quindi delle proprietà
oncogeniche della proteina chimerica. (Fujimoto, J. et al., 1996; Rosenwald, A. et al.,
1999; Puldorf, K. et al., 1999; Ma, Z. et al., 2000; Touriol, C. et al., 2000; Trinei, M.
et al., 2000; Tort, F. et al., 2001).
1.7. Il recettore tirosin-chinasi ALK.
Il gene che codifica per l‟intera proteina ALK è stato clonato nel 1997
contemporaneamente da due gruppi di ricerca (Iwahara, T. et al., 1997; Morris, S.W.
et al., 1997). In base ad omologie di sequenza, il recettore ALK è stato collocato
nella famiglia dei recettori per l‟insulina, della quale fanno parte anche il recettore
tirosin chinasi di tipo leucocitario (LTK, Leucocyte Tyrosine Kinase), il recettore per
il fattore di crescita insulinico di tipo I (IGFR-1), i recettori TRK per la neurotrofica,
MET e cROS (Fantl, J. et al., 1993; Huff, J. L. et al., 1993; Gaudino, G. et al., 1994;
Barbacid, G., 1995). Nell‟uomo il gene composto da 6226bp (Genebank accession
number U66559) codifica per una proteina di 177 kDa, ma modificazioni posttrascrizionali, quali la N-glicosilazione, determinano un aumento delle dimensioni
30
fino a 200 kDa (Morris, S. W. et al., 1994; Pulford, K. Et al., 1997; Lamant, L. et al.,
2000).
Il recettore ALK , che appare estremamente conservato tra le varie specie, è
rappresentato da una singola catena polipeptidica di 1620 aa nell‟uomo, 1.621 aa nel
topo e 1.701 aa nel moscerino della frutta (Iwahara,T. et al., 1997; Morris et al.,
1997; Loren, C.E. et al., 2001). Come tutti i recettori tirosin-chinasici, è costituito da
una porzione extracellulare, un dominio transmembrana ed una regione
citoplasmatica in cui risiede l‟attività catalitica.
Nella proteina umana (Figura 12) la regione extracellulare di 1030 aa
contiene 26 aminoacidi idrofobici all‟estremità amino-terminale che costituiscono il
peptide segnale. Il sito di legame per i ligandi endogeni finora scoperti, cioè la
pleiotropina (PTN) e midkine (MK), si trova tra i residui 391-401 (Stoica, G.E. et al.,
2001; Stoica, G.E. et al., 2002). La regione extracellulare possiede anche sedici siti
consenso per la N-glicosilazione (Asn-X-Ser/Thr), mentre i ventisei residui di
cisteina, presenti all‟interno di due raggruppamenti tra i residui 425-487 e 987-1021,
sono probabilmente responsabili della specificità di legame del ligando (Iwahara,T.
et al., 1997; Morris et al., 1997).
1
391
480
1030 1122
1620
-COOH
NH226
401
635
1058
1376
Dominio extracellulare
Regione MAM
Dominio di legame al ligando
Regione ricca in glicina
Dominio LDL-A
Dominio transmembrana
Dominio tirosin-chinasico
Figura 11. Rappresentazione schematica del recettore ALK umano con i suoi i
domini principali. La numerazione (in base alla pubblicazione di Morris, S. W. et
al., 1997) si riferisce ai residui aminoacidici.
31
La regione extracellulare contiene anche un dominio LDL-A (Daly, N. L. et
al., 1995; Fass, D. et al., 1997) la cui funzione è ancora sconosciuta, fiancheggiato da
due domini MAM che potrebbero essere coinvolti nell‟interazione cellula/cellula
(Beckmann, G. and Bork, P., 1993; Yang, H. L. et al., 2007) e una regione ricca in
glicine.
Il dominio transmembrana composto da 28 aa è seguito da una regione
juxtamembrana di 64 aa che contiene il sito di legame (residui 1093-1096) per
l‟interazione fosfotirosina-dipendente con il dominio SH2 del substrato-1 del
recettore per l‟insulina (IRS-1, Insulin Receptor Substrate 1).
Il dominio catalitico di ALK consiste di 254 aa, tra i quali sono presenti tre
residui tirosinici (e più precisamente i residui 1278-1282-1283) nell‟ambito del loop
di attivazione. Analogamente agli altri membri della famiglia dei recettori
dell‟insulina, questi resudui tirosinici rappresentano i siti principali di regolazione del
loop di attivazione. Passando dallo stato di non fosforilazione a quello fosforilato,
questi tre siti precludono o consentono l‟accesso dell‟ATP alla sua tasca di legame.
Studi iniziali sull‟espressione dell mRNA umano di ALK hanno evidenziato
la presenza di due trascritti delle dimensioni di 6,5 e 8 Kb, sia in cellule di
rabdomiosarcoma, sia a livello dell‟innervazione enterica e del cervello; è stata
inoltre dimostrata la sola presenza della forma di 6,0 kb nei testicoli, nella placenta e
nel fegato fetale (Morris S. W. et al., 1994). Studi successivi hanno confermato la
presenza dell‟mRNA di ALK nel cervello e nel midollo spinale del topo (Iwahara,T.
et al., 1997; Morris et al., 1997). Studi di ibridazione in situ condotti dagli stessi
autori su topi embrionali hanno confermato che la presenza dell‟mRNA di ALK è
principalmente ristretta a regioni specifiche del cervello in via di sviluppo (il talamo,
l‟ipotalamo, il mesencefalo, il bulbo olfattorio), così come del sistema nervoso
periferico (la radice dorsale e i gangli e il plesso mioenterico). Nel topo l‟espressione
del gene ALK inizia approssimativamente all‟undicesimo giorno di vita embrionale e
persiste, ma a livelli drasticamente inferiori, per tutto il periodo neonatale ed adulto
(Iwahara, T. et al., 1997).
Studi immunocitochimici condotti sull‟uomo adulto hanno rilevato la
presenza di ALK solo in poche cellule neuronali disperse, nei periciti e nelle cellule
endoteliali del cervello, supportando così l‟ipotesi della ristretta distribuzione di
ALK in condizioni fisiologiche (Pulford, K. et al., 1997; Falini, B. et al., 1999).
32
Il quadro di espressione di questo RTK ne suggerisce quindi un probabile
ruolo nello sviluppo e nel mantenimento del sistema nervoso centrale (Iwahara, T. et
al., 1997; Morris, S. W. et al., 1994; Pulford, K. Et al., 1997; Loren, C. E. et al.,
2001; Vernersson, E. et al., 2006); questa ipotesi è confermata, inoltre, da
esperimenti condotti su modelli animali, quali Drosophila melanogaster e
caenorabditis elegans: dove ALK è fondamentale per la formazione delle sinapsi e
del sistema nervoso. I topi knockout per ALK, al contrario, presentano uno sviluppo
e una longevità paragonabile ai topi di tipo selvatico (Englund, C. et al., 2003;
Bazigou, E. et al., 2007; Pulford, K. et al, 2004)
Inizialmente la proteina pleiotropina (PTN) e la proteina “midkine” (MK)
sono state indicate quali possibili ligandi di ALK nell‟uomo(Stoica, G. E. et al.,
2001; Stoica, G. E. et al., 2002); tuttavia, dopo dieci anni, la rilevanza fisiologica di
questa coppia recettore/ligando non è stata ancora dimostrata in maniera
convincente: la fosforilazione di ALK tramite stimolazione con PTN é infatti assente
in molti sistemi cellulari (Motegi, A. et al., 2004; Moog-Lutz, C. et al., 2005;
Miyake, I. et al., 2002). Perez-Pinera e collaboratori, nel 2007, hanno proposto un
nuovo modello in cui, nelle cellule stimolate con PTN, la fosforilazione di ALK è
mediata da legame di PTN con il recettore RPTP /. Quando PTN si lega ad RPTP
/., ne provoca la dimerizzazione con conseguente perdita dell‟attività tirosinfosfatasica. A sua volta, l‟inattivazione di RPTP / determina l‟ aumento dei livelli
di fosforilazione di tutti i substrati ad esso associati (Meng, K. et al., 2000; Kawachi,
H. et al., 2001; Pariser, H. et al., 2005a; Pariser, H. et al., 2005b; Pariser, H. et
al.,2005c; Tamura, H. et al., 2006).
Tuttavia, Le conoscenze sulle proprietà biologiche di ALK, nonché sui
meccanismi molecolari sottostanti, sono piuttosto limitate a causa dell‟ incertezza
sulla vera natura del ligando. Per ovviare a questo problema sono stati ideati modelli
molecolari di ALK che ne consentono l‟analisi in condizioni ligando-inducibili. In
particolare, sono stati sviluppati due sistemi modello sfruttando uno stratagemma
sperimentale simile, ovvero la creazione di un recettore chimerico formato dal
dominio intracellulare di ALK fuso ad un dominio extracellulare “dimerizzabile”
sotto stimolazione specifica e, quindi, capace di innescare il processo di trasduzione
ALK-specifico.
La chimera ideata dal gruppo di ricerca del Dr. Souttou è stata ottenuta per
33
sostituzione del dominio extracellulare di ALK con il frammento cristallizzabile
(regione Fc) della immunoglobulina 2b murina. In condizioni sperimentali non
riducenti, le cisteine presenti nel dominio Fc tendono a formare ponti disolfuro: ciò
induce dimerizzazione e oligomerizzazione delle chimere con conseguente
transfosforilazione dei domini intracellulari di ALK e, quindi, attivazione del
recettore. Utilizzando questo modello molecolare è stata dimostrata la capacità di
ALK di indurre, in seguito ad attivazione, la crescita di neuriti nella linea cellulare
PC12, a supporto del probabile ruolo di questo recettore nello sviluppo e
mantenimento del sistema nervoso. Lo stesso sistema è stato inoltre utilizzato per
l‟iniziale caratterizzazione degli effettori intracellulari che intervengono nella
trasduzione di questo segnale ALK-mediato. Una via di segnalazione critica nella
mediazione della differenziazione delle cellule PC12 è stata identificata nella cascata
delle MAPK (Souttou, B. et al., 2001), risultato successivamente confermato da altri
autori.
In questo Laboratorio è stata, invece, generata una chimera EGFR/ALK, nella
quale i domini extracellulari e transmembrana del recettore ALK sono stati sostituiti
con le corrispondenti regioni del recettore per il fattore di crescita epidermico
(EGFR). La validità di questo sistema modello è stata ampiamente dimostrata: analisi
biochimiche e immuno-istochimiche hanno, infatti, rivelato che nelle cellule NIH3T3 la chimera EGFR/ALK è correttamente espressa in superficie, dove è in grado di
interagire con l‟EGF e trasdurre all‟interno della cellula un segnale EGF-mediato, ma
ALK-specifico. Utilizzando questo sistema modello molecolare è stata dimostrata la
capacità di ALK di promuovere mitogenesi nelle cellule fibroblastiche murine NIH3T3 (Piccinini G. et al., 2002) e in cellule ematopoietiche murine 32D (Bacchiocchi
R. et al., 2005). L‟analisi dei processi molecolari ALK-mediati in condizioni di
controllata attivazione mediante stimolazione con EGF in questi sistemi cellulari ha
messo in evidenza lo specifico reclutamento, nonché attivazione, dei trasduttori
intracellulari quali la fosfolipasi C-, la fosfatidil-inositolo-3-chinasi(PI3K)
(Piccinini, G. et al., 2002), c-src e l‟isoforma alfa della diacil-glicerolo chinasi
(DGK) (Bacchiocchi R. et al., 2005).
34
1.8. Ruolo di ALK nelle neoplasie umane
L‟attenzione scientifica per il recettore ALK deriva dall‟alta percentuale di
casi di ALCL caratterizzati dall‟espressione di sue varianti oncogenicamente attive;
più recentemente è stata dimostrato il coinvolgimento di questo recettore nella
patogenesi di altri tumori, facendo di ALK uno dei pochi esempi di RTKs implicato
nell‟oncogenesi di neoplasie di origine sia ematopoietica che non (Pulford, K. et al.,
2004). L‟espressione aberrante di ALK è stata descritta in un piccolo sottogruppo di
casi di NHL di tipo B (Reichard, K.K. et al., 2007) nonché in alcuni casi di linfoma
diffuso a grandi cellule B (DLBCL, Diffuse Large B-cell Lymphoma) caratterizzati
dall‟espressione delle proteine chimeriche Clatrhin/ALK, SEC31A/ALK e meno
frequentemente la stessa NPM/ALK (VanRoosbroeck, K. et al., 2010).
Altre proteine di fusione di ALK sono state descritte anche in neoplasie di
origine non-ematopietica, come i tumori miofibroblastici infiammatori (IMTs)
(Puldorf, K. et al., 2004), carcinomi dell‟esofago a cellule squamose (Jazii, F.R., et
al., 2006; Du, X.L., et al., 2002), carcinomi renali (Debelenko L. et al., 2010) e
tumori polmonari non a piccole cellule (NSCLC, Non Small Cell Lung Cancer); nel
2007, infatti, Soda e collaboratori hanno descritto per primi un nuovo
riarrangiamneto cromosomico che coinvolge il cromosoma 2 e determina la
formazione di un gene chimerico codificante per una proteina di fusione formata
dalla porzione ammino-terminale della proteina EML4 e dalla regione intracellulare
del recettore ALK nella porzione carbossi terminale, espressa da circa il 6% dei casi
di NSCLC (Soda, M. et al., 2007); più recentemente sono stati descritti anche altri
riarrangiamenti cromosomici che coinvolgono il gene codificante per la proteina
KIF5B (Wong, D.W et al., 2011). I casi di NSCLC ALK+ condividono alcune
caratteristiche comuni, a prescindere dalla traslocazione descritta: insorgono in
pazienti giovani e non fumatori e la presenza di questi riarrangiamenti esclude altre
anomalie genetiche, come mutazioni di K-Ras o dell‟EGFR (Paez, J.C. eta l., 2004).
L‟espressione della proteina di fusione EML4/ALK è stata descritta anche nel
2,5% di casi di cancro alla mammella; dati analoghi sono emersi da studi condotti sul
cancro al colon (Lin, E. et al., 2009).
35
Negli ultimi anni stati caratterizzanti meccanismi diversi dal riarrangiamento
cromosomico che portano all‟attivazione aberrante dell‟attività chinasica di ALK, tra
cui mutazioni e amplificazione (Ardini, E. et al, 2010).
In linea con queste osservazioni, l‟amplificazione genica di ALK è stata
descritta in diverse linee cellulari di neuroblastoma (Miyake I., et al., 2002)
glioblastoma (Powers, C., et al., 2002) e melanoma (Cessna, M.H., et al., 2002;
Pillay, K., et al., 2002; Li, X.Q., et al., 2004; Dirks, W.G., 2002). Una correlazione
diretta tra l‟iper-espressione della forma selvatica di ALK e la trasformazione
cellulare è stata riportata da più autori (Weber, D. et al., 2000; Stoica, G. E. et al.,
2001; Piccinini, G. et al., 2002) ed è stata riscontrata anche in carcinomi alla
mammella (Perez-Pinera, P., et al., 2007). Studi più recenti hanno, inoltre, dimostrato
che mutazioni puntiformi del gene ALK sono alla base di molti casi di
neuroblastoma sia ereditario che sporadico (Mossè, Y.P., et al., 2008); queste
mutazioni che inducono l‟attivazione costitutiva del recettore correlano con un
fenotipo trasformante, mentre l‟inibizione genetica o farmacologica di ALK provoca
una diminuzione nella crescita tumorale (George, R.E. et al., 2008; Mosse Y.P. et al.,
2008; McDermott, U. et al., 2008). Nei pazienti affetti da neuroblastoma, l'iperespressione di ALK, sia nella forma wild-type che in quelle mutate, correla con una
prognosi infausta (Passoni, L., et al., 2009).
1.9. L’oncogene NPM/ALK
Come già accennato precedentemente, la traslocazione t(2;5)(p23;q35) è una
delle più frequenti negli ALCL. Strategie di clonaggio posizionale hanno evidenziato
che la traslocazione interrompe, sul cromosoma 5, il locus codificante per la
nucleofosmina (NPM), mentre sul cromosoma 2 interrompe il locus codificante per il
recettore tirosin-chinasi ALK (Morris, S. W. et al., 1994). La rottura cromosomica
all‟interno della sequenza genomica di ALK cade all‟interno di un introne di 1935
bp, localizzato tra gli esoni che codificano per il dominio transmembrana e quello
juxtamembrana del recettore. La rottura del gene NPM invece, è all‟altezza
dell‟introne 4 di NPM (Ladanyi, M. and Cavalchire, G., 1996; Chan, P.K. et al.,
1997; Luthura, R. et al., 1998). Questo riarrangiamento cromosomico ha come
risultato l‟espressione di una proteina di fusione di 80kDa che contiene i primi 117
36
aminoacidi della porzione amino-terminale di NPM uniti ai residui 1058-1620 della
porzione intracitoplasmatica di ALK, inclusa la regione catalitica che risulta
costitutivamente attiva (Morris, S. W. et al., 1994; Fujimoto, J. et al., 1996) (Figura
12).
Il gene di fusione reciproco ALK-NPM non è trascritto a livelli apprezzabili
e quindi non contribuisce alla patogenesi degli ALCL (Morris, S. W., 1994; Beylot
Berry, M. et al., 1998; Cordell, J. L. et al., 1999).
117
1058
294
NPM
NPM
1620
ALK
117
1058
294
1620
ALK
NP
NPM/ALK
1
117
680
N
P
NPM/ALK
1
117
680
Figura 12. Rappresentazione schematica della traslocazione t(2;5)(p23;q35). La numerazione
(stabilita da Morris, S. W. et al., 1994 e 1997) si riferisce al numerodei residui aminoacidici delle
rispettive proteine.
Normalmente ALK non è espresso a livello del sistema ematopietico;
pertanto, la traslocazione t(2;5)(p23;q35), determinando la trascrizione del gene ALK
sotto la guida del forte promotore di NPM, risulta nell‟espressione anomala e
nell‟attivazione costitutiva di ALK nelle cellule ematopoietiche. Si ritiene che
l‟attivazione costitutiva di ALK nella molecola di fusione sia dovuta alla formazione
di omodimeri, in virtù del dominio di oligomerizzazione presente nella porzione
amino-terminale di NPM.
La proteina NPM/ALK è un potente oncogene, infatti la sua espressione è
sufficiente per trasformare diversi tipi cellulari in vitro, inclusi fibroblasti di topo e di
ratto come le cellule NIH3T3, Fr3T3 e Rat-1 e cellule ematopietiche come le linee
mielidi 32D e Ba/F3 ( Fujimoto, J. et al., 1996; Bai, R. Y. et al., 1998; Bischof, D. et
al., 1997; Mason, D. Y. et al., 1998; Bacchiocchi R. et al., 2005). Il suo potenziale
oncogenico è principalmente dovuto all‟attività enzimatica costitutiva di ALK:
infatti, in vitro, p80NPM/ALK presenta una forte attività chinasica assolutamente
necessaria per indurre il fenotipo neoplastico.
37
Successivamente, il potenziale trasformante di NPM/ALK è stato confermato
in vivo attraverso il trasferimento di cellule midollari NPM/ALK–infettate in topi
irradiati letalmente (Kuefer, M. U., et al., 1997). In questo modello sperimentale,
l‟espressione di NPM/ALK determina lo sviluppo di linfomi negli animali, a diretto
sostegno di un ruolo diretto dell‟attivazione di ALK nella linfomagenesi. Tuttavia,
l‟analisi genotipica dei tumori formatisi in questi animali ha dimostrato una
derivazione B e quindi chiaramente differenti dai linfomi umani che sono
classicamente di tipo T o nullo (Falini, B., 2001). Un modello murino più appropriato
è stato recentemente ottenuto attraverso la generazione di topi transgenici nei quali
l‟espressione di NPM/ALK è stata selettivamente indirizzata sui linfociti T.
Nonostante quest‟ultimo modello rappresenti la prima evidenza diretta delle
proprietà oncogeniche di NPM/ALK sui linfociti T in vivo, lo sviluppo di modelli
sperimentali più appropriati nei quali analizzare la linfomagenesi ALK–mediata è
necessaria.
Lo sviluppo di linfomi NPM/ALK positivi è, inoltre, strettamente dipendente
dalla risposta immunitaria individuale: è stata, infatti, recentemente dimostrata nel
siero dei pazienti affetti da ALCL, la presenza di anticorpi circolanti con specificità
per NPM/ALK (Puldorf, K. et al., 2004; Borish, B. et al., 2003). Inoltre, nel
repertorio dei linfociti circolanti di soggetti sani, è stata evidenziata la presenza di
cellule T citotossiche funzionali (CTLs, Cytotoxic T Lymphocytes) anti-ALK,
suggerendo che tale molecola si comporta da potente antigene tumorale.
Effettivamente, cellule derivate da ALCL e HLA compatibili e linee cellulari di
neuroblastoma possono essere lisate efficacemente in vitro da CTL specifiche. Tale
dato apre la possibilità allo sviluppo di nuove strategie terapeutiche per i tumori
esprimenti ALK basate sulla definizione di protocolli immunoterapici (Passoni, L. et
al., 2002).
1.10. Aspetti molecolari delle proprietà trasformanti di NPM/ALK.
Nonostante siano stati effettuati numerosi studi in questa direzione, i
meccanismi patogenetici che sottendono alla trasformazione NPM/ALK-mediata
sono ancora poco definiti. Similmente alle altre proteine tirosin-chinasi, sia normali
38
che oncogeniche, NPM/ALK attiva varie e differenti cascate di segnalazione che
sono strettamente connesse e sovrapposte.
Attualmente, sono state identificate diverse molecole segnale che sono
reclutate e/o attivate da ALK, tra cui la molecola adattatrice Grb2 (Fujimoto J. et al.,
1996; Bai R. Y. et al., 1998; Piccinini G. et al., 2002), Shc (Fujimoto J. et al., 1996;
Bai R. Y. et al., 1998), IRS-1 (Fujimoto J. et al., 1996; Bai R. Y. et al., 1998), PLC–
(Bai R. Y. et al., 2000; Piccinini G. et al., 2002), PI3-K (Bai R. Y. et al, 2000;
Slupianek A. et al., 2001; Piccinini G. et al., 2002) e p60src (Cussac D. et al., 2004;
Bacchiocchi R. et al., 2005), sebbene solo per alcune di esse sia stato effettivamente
dimostrato un ruolo essenziale nella mediazione del potenziale trasformante di ALK.
In particolare, vari studi hanno fornito solide evidenze sperimentali
sull‟importanza sia della PI3-K che della PLC– per le proprietà oncogeniche di
NPM/ALK, attraverso una loro specifica regolazione di segnali mitogenici e/o antiapoptotici (Bai R. Y. et al., 1998; Bai R. Y. et al., 2000; Slupianek A. et al., 2001).
Al contrario, sebbene sia Shc che IRS-1 siano effettivamente reclutati da
ALK su specifici residui tirosinici fosforilati tramite i loro domini SH2, essi non
sembrano svolgere una funzione essenziale nella trasduzione dei segnali
trasformanti. Infatti, molecole di NPM/ALK mutate nei rispettivi siti di tirosina
mantengono intatta la capacità di indurre trasformazione di cellule fibroblastiche
murine NIH-3T3 (Fujimoto J. et al., 1996).
Altri effettori fondamentali per le proprietà trasformanti di NPM/ALK sono
rappresentati dalle molecole Stat3 (Stat, Signal Transducer and Activator of
Transcription 3) e Stat5. Il ruolo di Stat3 è stato analizzato dettagliatamente sia in
vitro (Zamo A. et al., 2002) che in vivo (Chiarle R. et al., 2005). NPM/ALK è in
grado di fosforilare direttamente Stat3 od indirettamente, previa attivazione di JAK3
(JAK, Janus Kinase) (Zamo A. et al., 2002; Amin H. M. et al., 2003; Marzec M. et
al., 2005). In linee cellulari umane derivate da ALCL, Stat3 regola positivamente la
trascrizione di geni coinvolti nel ciclo cellulare e geni codificanti per proteine a
funzione anti-apoptotica, come la ciclina D3, MCL1 (MCL, Myeloid Cell Leukemia),
BCL-XL e survivina (Zamo A. et al., 2002;
Piva R. et al., 2006). Inoltre, il
silenziamento genico di Stat3 mediante l‟uso di oligonucleotidi anti-senso risulta
nell‟annullamento della trasformazione delle cellule, determinando sia una
39
diminuizione delle capacità proliferative che da un‟aumentata sensibilizzazione
all‟apoptosi (Ruchaz H. et al., 2003).
Il meccanismi di azione di Stat5B
nella mediazione delle proprietà
oncogeniche di NPM/ALK richiede, invece, l‟attivazione di JAK2. L‟inibizione di
questa molecola determina una drastica riduzione della trasformazione NPM/ALKmediata sia in vitro che in vivo, risultando in un significativo aumento dell‟apoptosi
cellulare (Ruchaz H. et al., 2003). Al contrario, Stat5A agisce nelle ALCL come
soppressore tumorale ed infatti, in queste cellule tumorali, risulta epigeneticamente
silenziato; quando ri-espresso determina, a sua volta, un‟inibizione dell‟espressione
di NPM/ALK (Zhang Q. et al., 2007).
L‟importanza della proteina p60src è stata recentemente analizzata in una serie
di linee cellulari umane derivate da ALCL ed NPM/ALK positive e dimostrata
attraverso gli effetti osservati sulla proliferazione cellulare in seguito alla sua
specifica inibizione ottenuta mediante silenziamento genico o trattamento delle
cellule con inibitori farmacologici (Cussac D. et al., 2004; Bacchiocchi R. et al.,
2005). Tali dati sono stati ulteriormente consolidati in questo Laboratorio utilizzando
come sistema modello le cellule NIH-3T3 esprimenti la chimera ligando-attivabile
EGFR/ALK. Va , inoltre, aggiunto che in questo sistema cellulare è stata dimostrato
un ruolo dell‟-DGK nella segnalazione ALK-mediata, attraverso un meccanismo
che richiede sia associazione che attivazione da parte di p60src (Bacchiocchi R. et al.,
2005). In cellule NPM/ALK positive è stata descritta la fosforilazione mediata dalle
chinasi della famiglia Src del fattore di scambio per nucleotidi guaninici (GNEFs,
Guanine nucleotide Exchange Factors) Vav1 che a sua volta modula l‟attivazione
della RhoGTPasi Cdc42, proteina coinvolta nella regolazione della forma cellulare e
fondamentale per processi quali migrazione, crescita e sopravvivenza cellulare
(Ambrogio, C. et al., 2008).
Ovviamente ulteriori studi sono resi necessari per la caratterizzazione dei
meccanismi
molecolari
coinvolti
nella
trasformazione
cellulare
mediata
dall‟oncogene NPM/ALK e per l‟identificazione di pathway di segnalazione
addizionali che risultino operative nelle neoplasie ALK-positive.
40
1.11 Il mesotelioma maligno della pleura
Il mesotelioma maligno è una forma tumorale relativamente rara e molto
aggressiva che origina per lo più dalle cellule della sierosa pleurica la sottile
membrana che riveste e protegge i polmoni (mesotelioma pleurico) può originare
anche dal peritoneo o, più raramente, della sierosa pericardica, ovarica o della tonaca
vaginale del testicolo (Carbone, M., et al., 2002).
Il Mesotelioma Maligno della
Pleura (MMP) è fra tutti il più frequente.
Tale neoplasia ha focalizzato l‟attenzione di clinici e ricercatori per la forte
associazione con l‟esposizione all‟asbesto (amianto) e le conseguenti importanti
implicazioni di natura medico-legale. Inoltre, il mesotelioma rappresenta una
neoplasia caratterizzata da elevata
mortalità data l‟alta resistenza a qualsiasi
trattamento terapeutico.
Generalmente, la popolazione più colpita è quella compresa tra la quinta e la
settima decade di vita, con un‟età media pari a 53 anni. L‟Unione Europea, con la
direttiva 83/477/ EC, articolo 17 del 19 settembre 1983, ha suggerito l‟istituzione in
ogni stato membro della Comunità, di un registro dei casi verificati di asbestosi e
mesotelioma. Ciò ha consentito, negli anni successivi, un‟attenta analisi dei tassi di
incidenza di mesotelioma in tutta Europa, fornendo così degli indicatori indiretti di
esposizione lavorativa ed ambientale all‟asbesto.
I rischi per la salute sono direttamente legati alla quantità, al tipo di fibre
inalate, alla loro stabilità chimica, ed ad una predisposizione personale a sviluppare
la malattia.
Anche
indagini
a
livello
mondiale
hanno
confermato
l‟incidenza
dell‟esposizione all‟asbesto nel 70-80% dei casi di mesotelioma . Dalle analisi
statistiche effettuate, è emerso che dopo 15 anni dall‟inizio dell‟esposizione il 6% dei
lavoratori esposti in età superiore ai 35 anni muore di mesotelioma. L‟esposizione
inoltre non è da considerarsi esclusivamente di natura occupazionale ma è anche
ambientale e spesso familiare, quest‟ultima si realizza generalmente attraversi gli
abiti del lavoratore contaminati dalle fibre di asbesto.
La cancerogenesi dell‟asbesto inizia con l‟inalazione delle fibre di cui gran
parte, circa il 70%, viene eliminata con l‟espettorato o con le feci mentre il rimanente
30% attraversa l‟endotelio penetrando nei tessuti interstiziali. Le fibre tendono ad
41
accumularsi prevalentemente a livello del terzo inferiore del polmone in posizione
contigua alla pleura viscerale.
Ovviamente quando le fibre vengono inalate si scatena un meccanismo di
difesa con attivazione dei macrofagi alveolari. L‟attivazione di questi porta alla
produzione di citochine ed alla alterata regolazione di alcuni proto-onocogeni, tra cui
PDGFB con proliferazione delle cellule mesoteliali.
Altri fattori di rischio implicati nell‟insorgenza della neoplasia sono:
l‟esposizione al diossido di torio (thorotrast) ed alla zeolite, le infezioni polmonari
croniche (possibile ruolo del virus simian 40, SV40), la tubercolosi polmonare e le
irradiazioni.
Il Mesotelioma Maligno della Pleura origina dal mesotelio della pleura con
una tendenza a ricoprire la superficie del polmone avvolgendolo completamente e
spesso invadendo anche le cavità mediastiniche. Tale neoplasia si presenta come una
lesione diffusa che coinvolge ampiamente gli spazi pleurici e si associa, in genere, ad
un cospicuo versamento e alla invasione diretta delle strutture toraciche ed il
mediastino.
Nei casi di malattia avanzata, può arrivare ad interessare anche la cavità
pleurica controlaterale oppure il peritoneo attraverso il diaframma, è spesso presente
l‟invasione della superficie del parenchima polmonare sottostante.
Circa nella metà dei casi è possibile riscontrare, tardivamente, metastasi a
distanza. Queste metastasi avvengono per via linfatica o per via ematica con
localizzazione più frequenti a livello dei linfonodi loco-regionali.
Il MMP è di notevole problematicità sul piano diagnostico, data l‟elevata
variabilità istologica, difficile la determinazione dell‟estensione della malattia e della
sua stadiazione, difficile sul piano terapeutico. La sopravvivenza media varia tra i 12
ed i 15 mesi dall‟inizio della sintomatologia e tra gli 8 ed i 10 mesi dalla diagnosi.
Allo stato attuale più del 75% dei pazienti muore entro l‟anno e praticamente
nessuno sopravvive a 5 anni, tutto ciò a causa del ritardo con cui viene effettuata la
diagnosi.
Il trattamento combinato con chemioterapia, radioterapia o chirurgia.
andrebbe iniziato il più precocemente possibile evitando di affrontare la malattia in
uno stadio avanzato con pazienti in condizioni generali compromesse.
42
Attualmente tali modalità di trattamento non hanno dimostrato un
significativo miglioramento di sopravvivenza, è stata osservata una scarsa sensibilità
ai chemioterapici, che nella maggior parte dei casi non sono in grado di determinare
altro che risposte parziali o marginali.
Moltissimi chemioterapici sono stati testati nella terapia per il Mesotelioma
Maligno della Pleura. L‟efficacia della chemioterapia è difficile da valutare in quanto
gli studi sono pochi e molto disomogenei tra loro; i chemioterapici vengono infatti
usati sia da soli, che in associazione tra loro ed insieme ad altre terapie per differenti
stadi di malattia. Gli agenti chemioterapici più efficaci sono risultati Doxorubicina,
Ciclofosfamide e Cisplatino con una percentuale di risposta del 20-30%. In altri
studi, discreti risultati sono stati ottenuti con la combinazione di cisplatino e
gemcitabina (48% di risposta parziale) (Nowak, A.K., et al., 2002). In generale i
regimi polichemioterapici sono risultati più efficaci rispetto alla terapia con un
singolo farmaco (23% contro 12%). Un‟esame condotto suggerisce che il Cisplatino
è il chemioterapico più efficace usato come singolo agente e che l‟associazione
Cisplatino-Doxorubicina è il regime più attivo.
Più recentemente, nuovi agenti hanno dimostrato la loro efficacia nel
trattamento del MPM. Tra di essi il pemetrexate (Alimta), un antifolato con un‟ampia
attività antitumorale; dati clinici preliminari mostrano risultati incoraggianti
dall‟associazione dell‟Alimta e del Cisplatino con un tasso di risposta in studi di fase
I e II fino al 45% (Scagliotti, G.V., et al., 2003). Per ridurre la tossicità ed aumentare
l‟efficacia del pemetrexate, è necessaria l‟aggiunta di acido folico e vitamina B12.
Alla luce di questi dati, la combinazione Cisplatino-Alimta è divenuta la terapia
standard per i pazienti con MPM (Garcia-Carbonero, R., et al., 2006). Anche l‟
imatinib (Gleevec) e il gefitinibe (Iressa), rispettivamente inibitori del PDGF e del
EGF sono attivi sul MPM; tuttavia studi iniziali su questi farmaci, non hanno dato
risultati convincenti (Nowak, A.K., et al., 2002). La chemioterapia viene utilizzata
anche come trattamento intra-toracico, riducendo la tossicità sistemica e permettendo
di rilasciare il farmaco direttamente nella sede del tumore, dove invece il
chemioterapico sistemico arriva solo in minima parte.
Come in precedenza detto l‟impiego di un singolo agente non sembra dare
risultati soddisfacenti a causa della particolare resistenza delle cellule di MM nei
confronti dei farmaci antineoplastici.
43
Gli scarsi risultati ottenuti con la chemioterapia nel MMP possono essere
imputabili a diffferenti cause.
Una prima spiegazione riguarda il sito di comparsa della malattia, la cavità
pleurica, che risulta difficilmente raggiungibile con terapie sistemiche.
Altra causa è imputabile alle caratteristiche molecolari delle cellule tumorali
che presentano un‟elevata resistenza all‟azione citotossica dei farmaci chemioterapici
questa può essere dovuta ad alterazioni del codice genetico della cellula tumorale che
inibiscono l‟azione del chemioterapico (resistenza intrinseca).
Esiste però un altro tipo di resistenza, cosiddetta indotta o acquisita, che
emerge sotto la pressione selettiva dovuta all‟utilizzo dei farmaci antitumorali.
Recenti studi dimostrano che lo stress genotossico induce in queste cellule
modificazioni nel profilo di espressione dovute a cambiamenti nello splicing
alternativo di alcune proteine (Biamonti, G. and Caceres, J.F., 2009).
44
2. SCOPO DEL LAVORO.
Durante la trasformazione neoplastica, le cellule tumorali vanno incontro a
cambiamenti nell‟espressione genica che promuovono la motilità, la capacità
proliferativa cellulare e la resistenza all‟apoptosi. Un numero sempre crescente di
evidenze sperimentali indica che l‟attivazione delle proteine della famiglia STAR
mediata da stimoli extracellulari è importante nel promuovere lo splicing alternativo
di alcuni geni durante la tumorigenesi e la formazione di metastasi. Tra questi,
Sam68 è uno dei membri più studiati e negli anni più recenti sono stati fatti enormi
progressi per rivelare la correlazione esistente tra la proprietà di questa proteina di
legare l‟RNA e la sua capacità di regolare vari processi cellulari, tra cui la
trasduzione del segnale, la progressione del ciclo cellulare e la tumori genesi. Questa
proteina possiede, inoltre, domini multifunzionali che gli permettono di interagire
con molte altre proteine, entrando a far parte di molteplici pathway cellulari.
Sulla base di quanto discusso nella parte introduttiva, con il presente lavoro
ho voluto analizzare il ruolo della proteina Sam68 nella trasformazione mediata da
ALK. La caratterizzazione delle molecole segnale reclutate da questo recettore in
seguito ad attivazione è, infatti, di estrema importanza per definire gli effettori
intracellulari critici per le sue proprietà trasformanti.
Inoltre, visti i risultati ottenuti sulle cellule derivanti da ALCL, ho ritenuto
interessante indagare il ruolo di questa proteina anche in cellule derivanti da
mesotelioma maligno della pleura, essendo questa una neoplasia occupazionale
estremamente aggressiva e chemioresistente.
45
3. MATERIALI E METODI.
3.1. Vettori utilizzati.
LTR–EGFR/ALK: il vettore di espressione contenente la molecola
ricombinante EGFR/ALK è stato preparato partendo da una versione modificata del
plasmide LTR–EGFR 5M, in cui un frammento XhoI–MluI, contenente l'intero
codice di lettura dell'EGFR umano (Ullrich, A. et al.,1984), è clonato sotto il
controllo trascrizionale del promotore retrovirale Moloney–MuLV–LTR (indicato
come 5' LTR e 3' LTR), che assicura livelli molto elevati di espressione del gene
nella cellula ospite.
La modificazione era rappresentata dall‟inserimento nella sequenza
dell‟EGFR di due siti di restrizione unici per ClaI e SalI, rispettivamente all‟inizio e
alla fine della regione transmembrana: tali modificazioni sono state eseguite in modo
da non alterare la sequenza aminoacidica codificante per il recettore (Lonardo, F. et
al., 1990). Al fine di ottenere il recettore chimerico EGFR/ALK, l'intera porzione
intracellulare di ALK è stata amplificata mediante reazione a catena della polimerasi
(PCR) usando come templato il cDNA di NPM-ALK clonato in pcDNA3
(gentilmente fornito dal Prof. P. G. Pelicci, Istituto Europeo di Oncologia, Milano,
Italia) e come inneschi appropriati oligonucleotidi disegnati in modo tale da
introdurre nella sequenza amplificata di ALK un sito di riconoscimento per l‟enzima
SalI alla sua estremità 5' ed un sito di riconoscimento per l‟ enzima MluI alla sua
estremità 3'. In seguito alla digestione enzimatica con SalI e MluI, il frammento
ottenuto di 1705 bp è stato clonato nel vettore LTR–EGFR 5M precedentemente
digerito con SalI e MluI. I cloni batterici ottenuti dalla trasformazione sono stati
controllati per la presenza dell'inserto clonato. Questa procedura di ricombinazione
generava, però, una modificazione nella sequenza di ALK in corrispondenza del
codone 1058. Di conseguenza, il frammento di 2.2 Kb BamHI-BamHI ottenuto da
questo vettore, é stato subclonato nel vettore fagico M13mp18 e quindi, sottoposto a
mutagenesi sito-specifica in modo da modificare il codone CTG (corrispondente ad
un residuo di istidina) in posizione 1058, in GTG (corrispondente ad un residuo di
46
valina) e quindi ripristinare l'esatta sequenza aminoacidica della porzione
intracellulare di ALK.
Ottenuta questa modificazione, tale frammento BamHI-BamHI é stato
riclonato nel suo vettore di origine. Il vettore di espressione risultante, denominato
LTR-EGFR/ALK (Figura 13), contiene l'informazione genetica per codificare una
proteina di 1245 aminoacidi (peso molecolare atteso 140 kDa) composta dai domini
extracellulare e transmembrana dell'EGFR fusi al dominio intracellulare di ALK
(Piccinini, G. et al., 2002).
Sal I
Figura 13. Rappresentazione schematica del vettore LTR–EGFR/ALK. I siti di restrizione SalI e
MluI sono stati utilizzati per la ricombinazione. Il frammento BamHI–BamHI, utilizzato per
ripristinare la corretta sequenza di ALK (eliminando il sito SalI) tramite mutagenesi sito–specifica, è
anche indicato.
Tale vettore presenta un determinante di resistenza per l‟ampicillina (AmpR),
che consente la selezione di ceppi batterici trasformati in presenza di tale antibiotico.
E', inoltre, presente nel vettore il marcatore Ecogpt. Il gene gpt di E. Coli codifica
per l‟enzima xantina-guanina-fosforibosil–trasferasi (XGPRT), omologo dell‟enzima
eucariotico ipoxantina-guanina-fosforibosil–trasferasi (HGPRT). L‟enzima HGPRT
catalizza la conversione delle basi puriniche ipoxantina e guanina nei corrispondenti
nucleotidi acido inosinico (IMP) e acido guanilico (GMP). Mentre HGPRT può
utilizzare come substrati solo l'ipoxantina e la guanina, l'enzima batterico XGPRT è
in grado di agire, efficientemente, anche sulla xantina, convertendola in acido
xantilico, precursore del GMP. In presenza di acido micofenolico, la sintesi ex novo
47
dei nucleotidi purinici si arresta, poiché tale sostanza blocca l‟attività dell‟IMP
deidrogenasi e, di conseguenza, la formazione di GMP. L‟enzima XGPRT è in grado
di complementare il difetto enzimatico delle cellule eucariotiche, conferendo in più
la capacità di utilizzare la xantina nella biosintesi del GMP.
Cellule trasformate con vettori contenenti il marcatore Ecogpt sono in grado
di
crescere
in un terreno
supplementato con ipoxantina, xantina, adenina e
l'inibitore acido micofenolico. La selezione delle cellule transfettate può essere resa
ancora più efficace aggiungendo, nel terreno, anche amminopterina, che blocca
specificatamente la via biosintetica endogena delle purine (Mullingan, R. C. e Berg,
P., 1981).
LTR–EGFR/ALK Y979F: per la preparazione del mutante Y979F il
frammento di 2.2 Kb BamHI-BamHI ottenuto dal vettore LTR-EGFR/ALK è stato
sub clonato nel vettore fagico M13mp18 e sottoposto a mutagenesi sito-specifica in
modo da modificare il cosone TAC (corrispondente al residuo di tirosina in posizione
979) in TCC (corrispondente ad un residuo di fenilalanina): per ottenere questa
singola
modificazione
è
stato
utilizzato
l‟oligonucleotide
5‟-Pho-
GGGCCCTGTATTCCGGATAATG-3‟. I cloni selezionati sono stati sequenziali in
entrambe le direzioni per verificare la presenza della mutazione indotta. Ottenuta
questa modificazione, il frammento BamHI-BamHI modificato è stato riclonato nel
vettore di origine.
M13mp18: è un vettore derivato dal fago M13 (Yanisch–Perron, C. et al.,
1985). Tale vettore contiene il promotore e parte della sequenza del gene per la galattossidasi (lacZ) (Figura 14). In mezzo a tale sequenza, che codifica per i primi
146 residui aminoacidici della -galattossidasi, è inserito il "polycloning site": tale
inserzione non altera il corretto codice di lettura della -galattossidasi, ma determina
la sintesi di un piccolo frammento aminoterminale privo di attività enzimatica.
Vettori di questo genere sono, generalmente, usati in cellule batteriche ospiti che
contengono
la sequenza per la restante porzione carbossi–terminale della -
galattossidasi. Sebbene entambi i frammenti, sintetizzati dal vettore e dalla cellula
ospite, siano enzimaticamente inattivi, essi possono associare dando luogo all'enzima
48
attivo. Questo tipo di complementazione può essere facilmente visualizzata se i
batteri sono cresciuti in presenza del substrato cromogenico 5-bromo-4-cloro-3-
indolil-β-galattoside (X-Gal).
Figura 14. Mappa di restrizione del vettore fagico M13mp18. La figura mostra i siti in cui diversi
enzimi di restrizione tagliano la forma replicativa a doppio filamento di M13mp18. Il “polycloning
site” contiene i siti per gli enzimi di restrizione EcoRI, SacI, KpnI, SmaI, XmaI, BamHI, XbaI, SalI,
AccI, HincII, PstI, SphI e HindIII
Tuttavia, l'inserimento di un frammento di DNA all'interno del "polycloning
site" del plasmide risulta nella produzione di un frammento aminoterminale della galattossidasi incapace di effettuare l'α–complementazione. Pertanto, i batteri
trasformati con i plasmidi ricombinanti formeranno delle colonie bianche, quando
cresciuti in un terreno contenente X–Gal, e quindi saranno facilmente identificabili.
PINCO-NPM/ALK: NPM/ALK è stato clonato nel vettore PINCO (Figura
15), un vettore retrovirale che esprime la proteina a fluorescenza verde (GFP, Green
Fluorescent Protein) e quindi consente una facile selezione delle cellule infettate.
49
Figura 15. Mappa di restrizione del vettore pinco.
pLL-H1Sam68 e pLL-H2Sam68: questi vettori lentivirali sono stati ottenuti
clonando nel sito di clonazione multipla (MCS: Multiple Cloning Site) una sequenza
esprimenti molecole di shRNA (shRNA, short harpin RNA) in grado di sopprimere
in maniera specifica l‟espressione di Sam68. Qui di seguito sono riportati i primer
utilizzati per il clonaggio.
h1Sam68-F: 5‟-TGAAAGATCCTCATGAATTATTCAAGAGATAATTCATGAG
GATCTTTCTTTTTTC-3‟
h1Sam68-R: 5‟-TCGAGAAAAAAGAAAGATCCTCATGAATTATCTCTTGAAT
AATTCATGAGGATCTTTCA-3‟
h2Sam68-F: 5‟-TGAAGAATCTTTCAGTCATATTCAAGAGATATGACTGAAA
GATTCTTCTTTTTTC-3‟
h2Sam68-R: 5‟-TCGAGAAAAAAGAAGAATCTTTCAGTCATATCTCTTGAAT
ATGACTGAAAGATTCTTCA-3‟
La cassetta di espressione CMV-EGFP, contenente il sito di clonazione multipla e la
sequenza codificante per la GFP (Green Fluorescent Protein) è posta sotto il
controllo del promotore U6 e permette l‟espressione simultanea sia della molecola
shRNA che del gene reporter, facilitando in questa maniera la selezione delle cellule
50
infettate. La cassetta è posta tra sequenze che ne consentono l‟integrazione casuale
all‟interno del genoma umano.
PGEX4T1–PAK-CRIB: il plasmide pGEX4T-1 (Figura 26) è stato utilizzato per il
clonaggio del dominio CRIB (CRIB, Cdc42/Rac Interactive Binding Region) della
proteina PAK (PAK, p21-activated kinase) nel sistema di fusione genica alla
glutatione–S–trasferasi (GST, Glutathione-S-Transferase). Tale dominio associa
esclusivamente con Rac- GTP.
In questo plasmide, l‟espressione delle proteine ricombinanti è sotto il
controllo del promotore Taq. Questo plasmide contiene inoltre l‟interno del gene lac
Iq che codifica un repressore che si lega con il promotore inibendo l‟espressione della
proteina
in
fusione
con
la
GST.
Dopo
induzione
con
isopropil--D-
tiogalattopiranoside (IPTG), il repressore viene inattivato e si ha la rapida produzione
della proteina di fusione. Nel plasmide sono anche presenti il gene che conferisce
resistenza all‟ampicillina in E.coli (AmpR) e l‟origine di replicazione batterica
(pBR322 ori)
pEXV-Val12Rac1-myc-tag: il cDNA di Val12Rac1, una versione attivata di
Rac1caratterizzata da una mutazione dell‟aa 12 da glicina a valina, è stato marcato al
5‟ tramite PCR con una sequenza codificante l‟epitopo myc MEQKLIEEDL e
subclonato all‟interno del sito EcoRI di pEXV, un vettore di espressione eucariotico.
In questo plasmide l‟espressione della proteina ricombinante è sotto il
controllo del promotore SV40. E‟ inoltre presente il gene che conferisce resistenza
all‟ampicillina in E.coli (AmpR).
3.2. Linee cellulari.
In questo lavoro sono state utilizzate diverse linee cellulari, le cui caratteristiche
sono qui di seguito riassunte.
NIH-EGFR/ALK: tali cellule sono state ottenute in seguito a transfezione
stabile della linea cellulare NIH-3T3, ottenuta da fibroblasti murini (Jainchill, J. L. et
al., 1969), con il vettore di espressione LTR-EGFR/ALK, precedentemente descritto.
51
Questa linea cellulare, già ampiamente caratterizzata, esprime in superficie due classi
di recettori, le cui costanti di affinità sono di 6.2-6.4 nM (siti a bassa affinità: circa
2.5 X 106/cellula) e 0.09-0.1 nM (siti ad alta affinità: circa 1.8 X 105/cellula)
rispettivamente. E‟ stato precedentemente dimostrato che queste cellule sono in
grado di rispondere mitogenicamente alla stimolazione con EGF con una trasduzione
ALK-specifica (Piccinini G. et al., 2002).
NIH-EGFR/ALK Y979F: tali cellule sono state ottenute in seguito a
trasfezione stabile della linea cellulare NIH-3T3 con il vettore di espressione LTREGFR/ALK Y979F precedentemente descritto. Per i nostri protocolli sperimentali è
stata selezionata una linea esprimente un numero di recettori /cellula paragonabile
alla linea NIH-EGFR/ALK e simile distribuizione di siti a bassa ed alta affinità. Tali
cellule sono già state caratterizzate per l‟attività chinasica in vitro della molecola
EGFR/ALK mutante espressa in superficie, che risulta assolutamente comparabile a
quella posseduta dalla chimera EGFR/ALK di tipo selvatico.
32D: è una linea cellulare murina mieloide spesso utilizzata come modello
sperimentale per saggi di trasformazione dato che la sua propagazione è strettamente
dipendente dalla presenza di interleuchina-3 (IL-3) nel mezzo di coltura (Pierce, J. H.
et al., 1988).
32D-NPM/ALK: tale linea cellulare, gentilemente fornita dalla Dott.ssa
Emanuela Colombo dell‟Istituto Europeo di Milano, è stata ottenuta infettando le
cellule 32D con il vettore pinco-NPM/ALK. In questo Laboratorio, è stato
precedentemente dimostrato che l‟espressione dell‟oncogene NPM/ALK in queste
cellule conferisce la capacità di propagazione in un mezzo privo di IL–3.
32D-EGFR/ALK: tale linea cellulare è stata ottenuta tramite transfezione
stabile delle cellule 32D con il vettore di espressione LTR-EGFR/ALK,
precedentemente descritto. La transfezione è stata effettuata per elettroporazione. In
questo laboratorio è stato precedentemente dimostrato che queste cellule sono in
grado di rispondere mitogenicamente alla stimolazione con EGF con una trasduzione
ALK-specifica.
Karpas 299: Si tratta di una linea cellulare umana ottenuta da un caso di
ALCL con traslocazione t(2;5)(p23;q35) e quindi esprimente la proteina oncogenica
NPM/ALK.
52
Karpas-CTR e Karpas-H2Sam68: tali linee cellulari sono state ottenute
infettando le Karpas 299 rispettivamente con il vettore lentivirale vuoto e con il
vettore lentivirale pLLH2Sam68 descritto precedentemente.
MM5: si tratta di cellule umane in coltura primaria ottenute da biopsia di
mesotelioma maligno della plaura. Le cellule sono state utilizzate per gli esperimenti
tra il passaggio 5 e il 15.
3.3. Colture cellulari.
Le cellule NIH-EGFR/ALK e NIH-EGFR/ALKY979F, cresciute in adesione,
sono state mantenute in D-MEM (Dulbecco’s Modified Eagle Medium),
supplementato con siero fetale bovino (FBS, Fetal Bovine Serum) al 10%, xantina
250 μg/ml, sali HAT e acido micofenolico 25 μg/ml. Le cellule MM5, anch‟esse in
adesione, e le linee cellulari Karpas 299, Karpas-CTR, Karpas-H2Sam68 e 32DNPM/ALK, cresciute in sospensione, sono mantenute in coltura con il terreno RPMI
(RPMI, Roswell Park Memorial Institute) supplementato con FBS al 10%. Le linee
cellulari 32D e 32D-EGFR/ALK sono state coltivate come le Karpas 299, salvo che
la loro propagazione avveniva in terreno RPMI al 10% di FBS supplementato con
10% di terreno condizionato ottenuto da cellule WEHI-3, ricco in IL-3. La crescita
delle cellule è avvenuta a 37°C, in atmosfera contenente il 5% di CO2.
3.4. Pre-trattamento delle cellule.
Prima di effettuare esperimenti di stimolazione con EGF, le colture cellulari
NIH-derivate cresciute a confluenza sono state opportunamente lavate con D-MEM e
quindi mantenute per 16 ore a 37°C, al 5% di CO2 in D-MEM privo di FBS
supplementato con 5 g/ml di trasferrina (Becton Dickinson, Bedford, MA) e 10-8 M
di selenio (condizione di “starvation”). Le linee cellulari Karpas 299, 32D, 32DNPM/ALK e 32D EGFR/ALK sono state mantenute a 37°C, al 5% di CO 2, per 18
ore in mezzo di coltura contenente 0.1% FBS e albumina di siero bovina (BSA,
Bovine Serum Albumin) 0.2 mg/ml o per 6 ore in mezzo di coltura contenente 2% di
BSA, a seconda dell‟esperimento da eseguire successivamente.
53
Quando indicato, le cellule sono state incubate con gli inibitori farmacologici R59949
10M o PP2 (4-amino-5-(4-chlorophenyl)-7-(t-butyl) pyrazolo[3,4-di] pyramidine
1M (entrambi Alexis Biochemicals, San Diego, CA) o con DMSO utilizzato come
controllo 30 minuti prima di effettuare il trattamento con l‟EGF.
3.5. Transfezione.
La transfezione è una tecnica attraverso la quale è possibile introdurre
sequenze di DNA esogeno all‟interno di cellule eucariotiche riceventi. A questo
scopo, sono state utilizzate tre metodiche differenti.
Nella metodica della precipitazione con calcio fosfato, utilizzata per
transfettare le cellule NIH- derivate, il DNA viene fornito sotto forma di
microprecipitato, aumentandone così l‟efficienza di assunzione
Nel nostro caso, 30 g del DNA da transfettare sono stati risospesi in 1 ml di
una soluzione contenente Tris 1mM, pH 7.5, EDTA 0.1 mM e CaCl2 2.5 M. Tale
soluzione è stata, in seguito, dispensata molto lentamente in un tubo di polipropilene
da 15 ml, nel quale era stato precedentemente posto 1 ml di 2X H2BS (NaCl 20 mM,
Hepes 50 mM e Na2PO4 1.5 mM) e nel quale veniva costantemente insufflata
dell‟aria. In questo modo il DNA precipita sotto forma di sali di fosfato di calcio. La
sospensione è stata versata sopra il monostrato cellulare in presenza di D-MEM
contenente 10% di FBS; le cellule sono state, quindi, incubate a 37°C al 5% di CO2.
Dopo un periodo di 18 ore, le cellule sono state lavate con PBS; quindi sono stati
aggiunti 10ml/piastra di D-MEM al 10% di FBS.
L‟elettroporazione, la metodica utilizzata per transfettare la linea cellulare
Karpas 299, consiste nell‟ applicazione temporanea di un campo elettrico pulsante
controllato ad un sistema biologico. Essa provoca la formazione temporanea di pori
nelle membrane cellulari che consente il trasferimento di DNA all‟interno della
cellula. Nel nostro caso, 2,5 g di DNA da trasfettare sono stati aggiunti a 300.000
cellule risospese in 65 l di buffer siPORT (Ambion, Austin, TX). Tale sospensione
è stata elettroporata in cuvette da 1 mm di diametro a 250 Volts per 960 µF tramite
uso di un Gene Pulser (Biorad) o, alternativamente, a 250 Volts per 400 sec
utilizzando un generatore ad onda quadra, l‟ECM 830 (Genetronics, San Diego, CA).
54
La sospensione è stata, quindi, versata su piastra contenente RPMI al 10% di FBS e
incubata a 37°C al 5% di CO2.
Il reagente di transfezione non liposomiale XtremeGENE 9DNA (Roche
Diagnostic) è stato utilizzato per transfettare le cellule MM5. 7x 104 cellule sono
state piastrate in ciascun pozzetto di una piastra da 6 in terreno privo di antibiotici . Il
giorno dopo le cellule sono state lavate con PBS, quindi sono stati aggiunti 1,5ml di
RPMI privo di FBS e antibiotici per pozzetto. 1g di DNA da transfettare è stato
risospeso in una soluzione contenente terreno privo di siero e il reagente
XtremeGENE 9DNA , seguendo dettagliatamente le istruzioni della ditta produttrice.
Tale soluzione è stata versata con una pipetta goccia a goccia sopra il monostrato
cellulare. Dopo 6 ore veniva aggiunto FBS alla concentrazione finale del 10%.
A prescindere dalla metodica utilizzata, dopo 48 ore dalla transfezione, le
cellule sono state utilizzate per i successivi esperimenti.
3.6. Infezione.
Le cellule 293T sono state co-trasfettate con i vettori pLL e i vettori di
packaging pMDLg/pRRE (codificanti le proteine virali gag/pol), pRSV-REV e
pMD.G (codificante per la proteina env) in modo da produrre particelle virali in
grado di infettare le cellule e integrare stabilmente la cassetta di espressione del
vettore pLL nel genoma. Dopo 36 ore il surnatante è stato raccolto e ultracentrifugato
per 1 ora e mezzo a 25000 rpm. Le particelle lentivirali sono state quindi risospese
in PBS, aliqotate e congelate a -80°C. Un‟aliquota è stata utilizzata per infettare le
cellule Karpas 299. L‟efficienza di infezione è stata calcolata analizzando
l‟espressione della GFP al citofluorimetro.
3.7. Citomefluorimetria a flusso (FACS).
La citofluorimetria permette di analizzare le caratteristiche fisiche e/o
chimiche di cellule sospese in un fluido. Nella cella di misura di un citofluorimetro le
cellule sono forzate ad allinearsi e ad attraversare singolarmente il fascio di luce del
sistema di eccitazione. L‟interazione del fascio di luce con la cellula dà luogo a tre
55
fenomeni diversi: “light scattering”, assorbimento e fluorescenza. Il “light scattering”
dipende dalla riflessione, rifrazione e diffrazione del fascio di luce che colpisce le
singole cellule, e fornisce informazioni riguardanti caratteristiche fisiche e
morfologiche delle stesse cellule. Il segnale legato alla diffrazione, il “Forward
scatter” (FSC), fornisce informazioni sul diametro delle cellule analizzate; il “Side
scatter” (SSC) è, invece, legato ai fenomeni di riflessione e rifrazione a loro volta
dipendenti dalla granulosità interna, dal rapporto nucleo citoplasma, dalla rugosità di
superficie oltre che dal diametro. La combinazione di FSC e SSC definisce il
citogramma, un diagramma di dispersione che risolve le popolazioni cellulari in base
alle caratteristiche fisiche. L‟altro parametro analizzato è la fluorescenza ottenuta
marcando molecole citosoliche e di superficie o organelli interni delle cellule con
opportuni fluorocromi. Poiché la GFP ha la peculiare caratteristica di assorbire la
luce nel campo del blu (λ=395) e riemetterla nel campo del verde (λ=509), le cellule
che esprimono la proteina,irradiate dai raggi UV, appaiono di un colore verde
fluorescente; l‟analisi della fluorescenza emessa dalle cellule esprimenti la GFP ha
permesso di calcolare l‟efficienza di infezione del vettore lentivirale (vedi paragrafo
3.6). Le cellule sono state lavate, centrifugate e risospese in una soluzione ipotonica.
I campioni sono stati analizzati al citofluorimetro FACScalibu® (BD, Milano, Italia)
con il programma CellQuest (BD, Milano, Italia).
Con il termine “sorting” si indica la capacità di particolari citofluorimetri di
raccogliere fisicamente le sottopopolazioni cellulari separandole dalla popolazione
eterogenea iniziale in base alla differenza in un determinato parametro. Sulla base
dell‟analisi della fluorescenza, le cellule GFP positive sono state separate dal resto
della popolazione (“sortate”) utilizzando il FACS-Aria (BD bioscience)
3.8. Lisati cellulari.
Questa parte sperimentale è sempre eseguita rigorosamente a freddo.
Immediatamente prima della lisi, le cellule sono state lavate due volte con PBS
freddo. La lisi delle cellule è stata effettuata con un tampone, la cui composizione è
di seguito descritta:
concentrazione finale:
Triton X-100
1%
56
Hepes pH 7.5
50 mM
NaCl
150 mM
Glicerolo
10%
MgCl2
1.5 mM
EGTA
5 mM
Per le cellule MM5 è stato utilizzando il buffer di lisi con la seguente composizione:
concentrazione finale:
Triton X-100
1%
Tris-HCl
10 mM
NaCl
150 mM
EDTA
2 mM
Al tampone di lisi sono sempre stati aggiunti, immediatamente prima
dell‟uso, gli inibitori specifici per le proteasi (fenilmetilsulfonil-fluoride, PMSF:
concentrazione finale 4 mM e aprotinina: concentrazione finale 50μg/ml), al fine di
impedire la degradazione delle proteine estratte e, se necessario, gli inibitori specifici
per le fosfatasi (sodio ortovanadato 10 mM e sodio pirofosfato 10 mM). I lisati sono
stati centrifugati a 4°C per 20 minuti a 14000 rpm in una microcentrifuga da banco
(Biofuge Pico Heraeus). Terminata la centrifugazione, il surnatante è stato recuperato
ed eventualmente mantenuto a –80 °C fino al momento dell'uso.
3.9. Dosaggio delle proteine.
La quantità di proteine totali contenute in ogni campione è stata misurata per
mezzo del dosaggio delle proteine secondo il metodo di Bradford (Bradford, M.,
1976) utilizzando il kit della Biorad (Hercules, CA). Il dosaggio è basato sull‟utilizzo
del colorante Comassie Brillant Blue G-250 in acido fosforico e metanolo. E‟ noto
che quando avviene il legame con la proteina, l‟assorbanza massima per una
soluzione acida di tale colorante si sposta da 465 a 595 nm. Per il dosaggio delle
proteine la lettura dell‟assorbanza viene effettuata a 595nm.
57
Ogni volta è stata preparata una curva di taratura con diverse diluizioni
contenenti da 1 a 8 µg di proteina standard BSA. La concentrazione di ogni
campione è stata calcolata in base all‟equazione della curva di taratura.
3.10. Immunoprecipitazione.
I lisati cellulari sono stati incubati a 4°C per 2 ore con l‟anticorpo desiderato.
I complessi antigene/anticorpo formatisi sono stati, quindi, purificati utilizzando 30
l di Gamma Bind G Sefarosio/campione. Gamma Bind G Sepharosio è una forma
ricombinante di proteina G di Streptococco, purificata da E.coli e legata
covalentemente ad una matrice solida di Sefarosio 4B.
L‟incubazione è stata
mantenuta per circa 45 minuti sempre a 4°C e in condizione di gentile agitazione.
Le proteine che non si erano adsorbite alla resina venivano ulteriormente
rimosse mediante ripetuti lavaggi a 4°C. Ogni lavaggio è stato effettuato utilizzando
1 ml/campione di buffer HNTG (Hepes 20 mM, NaCl 150 mM, Glicerolo 10%,
Triton 0.1 %) con pH identico a quello del tampone di lisi.
I complessi purificati sono stati separati per elettroforesi su gel di
poliacrilammide in SDS (vedi paragrafo 3.8.), eluendo la proteina mediante
l‟aggiunta di Laemmli buffer, composto da Tris-HCl 0.1 mM pH 6.8, glicerolo 30%,
SDS 5%, blu di bromofenolo 0.01%, e -ME 1 M.
3.11. Elettroforesi su gel di poliacrilammide.
L‟elettroforesi su gel di poliacrilammide in SDS (SDS-PAGE) è stata
eseguita in accordo con il metodo descritto da Laemmli (Laemmli, U.K., 1970),
utilizzando un apparato elettroforetico verticale (Gibco BRL). La separazione delle
proteine è avvenuta in presenza di SDS, detergente anionico con la proprietà di
circondare tutta la superficie proteica, omogeneizzandone la carica superficiale (che
comunque rimane negativa). Generalmente, i campioni sono stati separati per
elettroforesi in condizioni denaturanti; in questo modo le proteine sono dissociate
nella loro subunità polipeptidiche individuali.
Il gel verticale utilizzato in questo apparato è composto da una parte
superiore, detta “stacking gel”, al 3% di poliacrilamide e da una parte inferiore, detta
58
“separating gel”, contenente una % variabile di poliacrilammide a seconda della
separazione delle proteine che si desidera ottenere.
La separazione è avvenuta mediante elettroforesi, con il gel di
poliacrialmmide immerso nella soluzione“SDS-PAGE running buffer” e composto
da glicina 250 mM, Tris-HCl 25 mM e SDS 0.1 %. applicando una corrente costante
di 20 mA. Come riferimento, una miscela di polipeptidi a peso molecolare noto
(Rainbow Full Range, GE Healthcare) è stata fatta migrare nelle stesse condizioni.
Dopo separazione mediante elettroforesi, le proteine sono state rivelate tramite
Western blot (vedi paragrafo 3.11).
3.12. Western blot.
Dopo separazione su gel di poliacrilammide, le proteine sono state trasferite
su filtro di nitrocellulosa mediante eluizione elettroforetica, sfruttando, cioè, il
trasferimento sotto l‟azione di un campo elettrico. Il trasferimento è avvenuto in
apposita camera in un tampone di trasferimento composto da Tris-Base 3g/L; Glicina
14,4g/L e metanolo al 20%. L‟avvenuto trasferimento delle proteine dal gel è stato
verificato attraverso colorazione con Rosso Ponceau e successivamente il colorante è
stato eliminato per mezzo di alcuni lavaggi con TTBS 1X. il filtro di nitrocellulosa è
stato incubato per almeno 2 ore in un tampone di blocco (TBS al 5% di latte) e
successivamente incubato per almeno due ore a temperatura ambiente oppure a 4°C
over night con l‟anticorpo primario opportunamente diluito in TBS al 5% di latte
(tranne nel caso dell‟anti-fosfotirosina, diluita in TBS al 3% di latte) sotto gentile
agitazione meccanica. I filtri sono stati, quindi, lavati 3 volte in TTBS 1X allo scopo
di rimuovere l‟eccesso di anticorpo. A seconda dell‟anticorpo primario utilizzato, il
complesso antigene-anticorpo è stato visualizzato mediante incubazione con
anticorpi (anticorpo di pecora diretto contro il frammento Fc delle IgG murine o
anticorpo di asino diretto contro il frammento Fc di coniglio) coniugati alla
perossidasi di rafano Tali reagenti sono stati utilizzati ad una diluizione finale di
1:15000 in TBS 1X contenente L‟incubazione è stata condotta per 1 ora e dopo altri
tre lavaggi in TTBS 1X, i filtri sono stati incubati con l‟opportuna soluzione (ECL
Plus Western Blotting Detection System (Amersham) per rivelare il segnale
59
attraverso una reazione di chemioluminescenza. Le lastre sono state poi sviluppate
tramite immersione prima nel liquido di sviluppo e poi nel fissativo.
TBS (Tris Buffered Saline):
Tris-HCl pH 7.5
10 mM
NaCl
150 mM
TTBS (Tween Tris Buffered Saline):
Tris-HCl pH 7.5
10 mM
NaCl
150 mM
Tween 20
0.5%
3.13. Anticorpi utilizzati.
Anticorpo anti-Sam68:
l‟anticorpo
anti-Sam68 utilizzato
(Santa
Cruz
Biotechnology, Santa Cruz, CA) è un anticorpo policlonale prodotto nel coniglio e
diretto sia contro la proteina murina che quella umana.
Anticorpo anti-fosfotirosina: l‟anticorpo anti-fosfotirosina utilizzato (Upstate
Biotecnology, Lake Placid, N.Y.) è un anticorpo monoclonale IgG2bk, prodotto in
vitro dall‟ibridoma murino 4G10 e purificato cromatograficamente su colonna
contenente Proteina A-Sefarosio.
Anticorpo anti-Vav1: l‟anticorpo anti-Vav1 utilizzato (Upstate Biotecnology,
Lake Placid, N.Y.) è un anticorpo monoclonale murino che riconosce le p95vav e
p85vav sia umane che murine.
Anticorpo anti-actina: l‟anticorpo anti-actina utilizzato (Santa Cruz
Biotechnology, Santa Cruz, CA) è un anticorpo monoclonale murino diretto contro
l‟actina.
Anticorpo anti-p21: l‟anticorpo anti-p21 utilizzato (Santa Cruz Biotechnology,
Santa Cruz, CA) è un anticorpo policlonale diretto contro la p21 umana.
Anticorpo anti-Rac-1: l‟anticorpo anti-Rac-1 utilizzato (BD Biosciences
Transduction Laboratories, Lexington, KY) è una anticorpo monoclonale murino
IgG2b.
60
3.14. Purificazione della proteina di fusione GST-PAK-CRIB.
Ceppi di E Coli HB101 trasformati con il vettore plasmidico pGEX4T-1
contenente la sequenza relativa al dominio CRIB della proteina PAK umana, inserita
secondo il corretto modulo di lettura, a valle della sequenza della glutatione–S–
trasferasi (GST), sono stati fatti crescere per tutta la notte a 37°C in agitazione
meccanica, nel brodo di coltura Luria-Bertani supplementato di ampicillina alla
concentrazione finale di 50 μg/ml. La sospensione batterica è stata diluita 1:10 con
brodo di coltura di fresca preparazione e fatta crescere ancora a 37°C in agitazione
meccanica, fino ad una OD600= 0.6. Quindi, la coltura batterica è stata indotta con
IPTG alla concentrazione finale di 0,1 mM per un periodo di 2 ore. La sospensione
batterica è stata centrifugata per 10 minuti a 4°C a 7000 rpm in una centrifuga
Beckman J2–21; il pellet è stato, quindi, risospeso nel buffer di lisi, composto da
Tris-HCl, 50 mM pH 7.5, EDTA 1 mM, NaCl 100 mM, glicerolo 5%, Triton X-100
0,1%, DTT 1 mM.
Al buffer di lisi sono stati aggiunti gli inibitori delle proteasi PMSF
(concentrazione finale, 4 mM) e aprotinina (concentrazione finale, 50 μg/ml).
Quindi, la sospensione è stata sottoposta a sonicazione in ghiaccio per un
minuto ed infine centrifugata a 2500 g per 1 ora e 15 minuti a 4 °C. Il surnatante è
stato incubato con glutatione legato covalentemente ad una matrice solida
rappresentata dal Sefarosio-GSH (glutatione–Sefarosio), rispettando il rapporto 100
μl/10 ml di lisato. L'incubazione è avvenuta in condizioni di gentile agitazione per 1
ora a temperatura di 4°C. Al termine dell'incubazione, la matrice solida è stata
ripetutamente lavata con il buffer GST-FISH freddo, composto da glicerolo 50%,
Tris HCl, 50 mM pH 7.4, NaCl 100 mM, NP-40 1%, MgCl2 2 mM, DTT 1 mM. A
questo buffer sono stati addizionati gli inibitori delle proteasi (fenilmetilsulfonilfluoride, PMSF: concentrazione finale 4 mM e aprotinina: concentrazione finale 50
μg/ml) e gli inibitori specifici per le fosfatasi (sodio ortovanadato 10 mM e sodio
pirofosfato 10 mM).
Dopo i lavaggi la matrice solida è stata risospesa in 200l di GST-FISH
BUFFER, e mantenuta a -80°C fino all‟utilizzo in saggi di interazione proteica. Un
aliquota della resina coniugata con la proteina di fusione è sempre stata controllata
61
tramite colorazione con blu di Comassie , dopo opportuna separazione mediante
SDS-PAGE.
3.15. Saggio di interazione proteica in vitro.
Prima di essere lisate con 750-1000 l di buffer GST-FISH (per la
composizione vedi paragrafo 3.15), le cellule sono state lavate con PBS freddo. I
lisati, incubati in ghiaccio per 5 minuti, sono stati centrifugati per 5 minuti a 4°C a
13000 rpm. Il sovranatante è stato trasferito in nuove provette e incubato con 60 l di
resina coniugata con la proteina di fusione. L‟incubazione è avvenuta in condizioni
di gentile agitazione a 4°C per 45 minuti. Tutte le proteine che non avevano formano
complessi con la proteina di fusione sono stati rimossi con alcuni lavaggi con il
buffer GST-FISH freddo.
I complessi purificati
sono
stati separati per elettroforesi su gel di
poliacrilammide in SDS, eluendo la proteina mediante l‟aggiunta di Laemmli buffer,
composto da Tris-HCl 0.1 mM pH 6.8, glicerolo 30%, SDS 5%, blu di bromofenolo
0.01%, e -ME 1 M.
3.16. Saggio di interferenza dell’RNA con plasmidi.
Con la tecnica dell‟interferenza dell‟RNA (RNAi) si intende un processo di
inattivazione genica post–trascrizionale, altamente specifico, innescato da RNA a
doppia elica (dsRNA) omologo alla sequenza del gene da sopprimere.
Figura 16. Mappa del vettore pRS shRNA.
62
In questa tesi sperimentale ho effettuato diverse trasfezioni con vettori pRS
shRNA dell‟ OriGene (OriGene Techonologies, Inc., Rockville, MD). Questi vettori
esprimono piccole molecole di shRNA (shRNA, short harpin RNA) in grado di
ripiegarsi in una struttura a forcina. Tali vettori di espressione contengono ripetizioni
terminali lunghe 3‟ e 5‟ (LTR) dell‟ MMLV (MMLV, Moloney Murine Leukemia
Virus), il gene per la resistenza alla puromicina e una cassetta di espressione
codificante per l‟shRNA posta sotto il controllo del promotore del gene per l‟RNA
nucleare U6. Questa cassetta è composta da una sequenza di 29 nt specifica per il
gene bersaglio e dalla sequenza complementare e reversa ad essa, separate da 7 nt
codificanti per il loop; a concludere è presente una sequenza di terminazione
TTTTTT (Figura 16).
Per questa tesi sono stati utilizzati plasmidi in grado di silenziare
l‟espressione sia di Sam68 che di Vav1. In entrambi i casi la ditta ha fornito quattro
vettori shRNA contenenti quattro cassette di espressione differenti. La sequenza
ottimale per ottenere l‟interferenza del gene Vav1 (shRNA #1) è risultata la
seguente: TGTCCATTGAGAACCTGGACCAGTCTCTG, mentre la sequenza
ottimale per il l‟abolizione dell‟espressione della proteina Sam68 (shRNA #2) è
TTATGAGCAAAGTTGTTACTGATTTCTTG. Come controllo negativo sono stati
utilizzati due plasmidi, uno senza cassetta di espressione, l‟altro codificante per un
shRNA non in grado di silenziare alcun gene (scramble).
I plasmidi specifici per Sam68 sono stati transfettati in maniera transiente sia
nelle cellule Karpas 299 che nelle cellule MM5, mentre quelli in grado di interferire
con l‟espressione di Vav1 sono stati transfettati esclusivamente nelle Karpas 299
(vedi capitolo 3.5.).
3.17. Saggi di proliferazione, vitalità e chemiosensibilità.
Diversi saggi possono essere utilizzati per valutare l‟attività proliferativa delle
cellule. In particolare ho potuto valutare la proliferazione cellulare tramite la
costruzione di curve di crescita. Le cellule Karpas 299, Karpas CTR e Karpas
H2Sam68 sono state starvate e successivamente piastrate in fiasca ad una
concentrazione di 100.000 cellule/ml (volume iniziale 5ml). Il numero delle cellule è
stato valutato ogni giorno per una settimana tramite conta in trypan blu. Ogni due
63
giorni veniva aggiunto del terreno fresco per assicurare la sopravvivenza cellulare
(volume finale 15ml).
Per valutare la vitalità cellulare è stato utilizzato il saggio MTT. Il bromuro di
metiltiazolildifenil-tetrazolio (MTT) è un sale di tetrazolio che attraversa la
membrana plasmatica e viene convertito dalle deidrogenasi mitocondriali di cellule
metabolicamente attive in un composto insolubile di colore viola, il formazano. Le
cellule morte non sono in grado di effettuare tale conversione.
Per questo saggio, le cellule sono state incubate per 3 ore con MTT, previo
eventuale trattamenti con il cis- platino alla concentrazione desiderata (vedi risultati),
ed i cristalli di formazano solubilizzati attraverso l‟uso di una soluzione SDS 10%
dimetilformamide 50%. La produzione di formazano, indice di vitalità, è stata
quantificata mediante misurazione colorimetrica alla densità ottica di 540 nm.
3.18. Saggi di migrazione
Per valutare la migrazione cellulare sono stati eseguiti due saggi differenti, a
seconda delle caratteristiche delle cellule analizzate. Per valutare la migrazione delle
cellule in sospensione è stato utlizzato il metodo di Boyden che consiste in un
sistema dotato di due compartimenti dove è possibile indurre le cellule a migrare
atrraverso una membrana porosa da un compartimento superiore ad uno inferiore
seguendo un gradiente chemotattico. La larghezza dei pori viene scelta in base al tipo
cellulare in modo da non consentirne un passaggio passivo. Per i nostri esperimenti
sono state utilizzate delle transwell con inserti in policarbonato caratterizzati da pori
di 8 m di diametro da inserire in piastre da 24 pozzetti. Le cellule sono state
starvate e successivamente piastrate sulla superficie superiore dell‟inserto ad una
concentrazione di 1 x 106/ ml in terreno privo di antibiotico e siero. Le transwell
sono state poste nei pozzetti di una piastra da 24 per colture cellulari contenenti
RPMI come controllo o RPMI 10% di FBS per indurre la migrazione delle cellule.
Dopo quattro ore a 37°C sono state contate le cellule nel compartimento inferiore
della piastra, quelle cioè che avevano attraversare i pori dell‟inserto. Il risultato è
stato espresso come percentuale del controllo.
Per analizzare le capacità migratorie delle cellule in adesione è stato
effettuato il Wound/Healing test. Questo saggio è stato sviluppato per la valutazione
64
in vitro della migrazione cellulare e prevede la creazione di un solco, detto “scratch”,
su cellule aderenti sub-confluenti. Il monitoraggio dello scratch e del seguente
“riempimento/riparazione” viene fatto mediante microscopio a contrasto di fase
munito di fotocamera, immagini (ingrandimento 10X) sono state prese all‟inizio e ad
intervalli regolari scelti fra 12 e 36 ore. La comparazione delle immagini ottenute
permette di quantificare il grado di migrazione cellulare. Le cellule di mesotelioma
maligno MM-5 sono state seminate in piastre da 24 pozzetti alla concentrazione di
2x104 cellule/pozzetto in 500 μl di terreno completo e poste in incubatore per 24 ore
al fine di permettere l‟adesione delle cellule. Al termine delle 24 ore è stato
controllato al microscopio che la confluenza delle cellule sia del 70-80% e quindi si
sono praticati 2 scratchs ,orizzontalmente, vicini al centro del pozzetto utilizzando un
puntale da 10μl sterile; quindi il terreno viene rimosso e sostituito con del terreno
fresco. La migrazione è stata valutata in maniera qualitativa osservando se le cellule
avevano o meno migrato all‟interno del solco nell‟arco di tempo preso in esame (24 e
48 ore).
3.19. Immunofluorescenza
Tale tecnica permette la valutazione di antigeni su diversi preparati biologici
mediante l‟impiego di anticorpi specifici che vengono rilevati con anticorpi
secondari coniugati a fluoro cromi. Per la preparazione dei vetrini, questi erano
sterilizzati, lavati in etanolo e quindi lasciati asciugare completamente sotto il flusso
di una cappa aspirante e successivamente trattati con poli-lisina per facilitare
l‟adesione cellulare ed infine posti su ciascun pozzetto di piastre da 6 per colture
cellulari. Su di essi sono state piastrate 4x104 cellule in terreno al 10% FBS. Quando
le cellule hanno raggiunto una confluenza dell‟80% e/o dopo aver effettuato il
trattamento con l‟agente chemioterapico (vedi risultati) le cellule sono state lavate in
PBS 1X e fissate in paraformaldeide al 4% in PBS per 10 minuti. Seguivano quindi
tre lavaggi in PBS e la permeabilizzazione effettuata tramite trattamento per 10
minuti con PBS 1X contenente 0,05% di saponina + 0,5% di BSA. Dopo tre lavaggi
in PBS 1X i campioni sono stati incubati per 1 ora con l‟anticorpo primario diluito
nella soluzione di permeabilizzazione, lavati per 3 volte in PBS 1X e incubati per 45
minuti con l‟anticorpo anti secondario coniugato con il fluorocromo TEXAS-RED.
65
Dopo altri tre lavaggi le cellule sono state incubate per 5‟ con l‟Hoechst, un colorante
specifico per il nucleo. I vetrini sono stati osservati con il microscopio a fluorescenza
Nikon Eclipse 80i e le immagini analizzate con il software Adobe PhotoShop 7.0.
3.20. Real Time PCR.
La real time RT-PCR è una tecnica specifica, sensibile e riproducibile che
permette di quantificare i livelli di espressione di un qualsiasi templato misurando in
tempo reale l‟emissione di fluorescenza di un fluoroforo reporter. Il segnale di
fluorescenza aumenta in maniera direttamente proporzionale alla quantità di
amplicone che viene sintetizzato ad ogni ciclo. Il dato reale di quantificazione è
estrapolato dalla fase esponenziale di emissione di fluorescenza. Viene definito un
valore soglia, denominato CT (ciclo soglia), in corrispondenza del quale inizia la fase
esponenziale di emissione di fluorescenza, e che viene considerato per l‟analisi di
espressione. Ad elevati livelli di espressione corrisponderanno, quindi, valori di C T
bassi e viceversa, a bassi livelli di espressione corrisponderanno valori alti di CT.
L‟RNA totale è stato isolato dalle cellule secondo le istruzioni riportate nel kit
RNAeasy (Quiagen, Milano, Italia). Un microgrammo di RNA totale è stato, quindi,
retro-trascritto con il QuantiTect Reverse Transcription Kit (Qiagen, Milano), che
consente di eliminare la contaminante di DNA genomico Le reazioni di RT-PCR
sono state eseguite nel Chromo4 sequence detector (Bio-Rad, Milano, Italia).
I livelli di espressione dei trascritti sono stati valutati in real-time RT-PCR con
la metodica Syber Green, e sono stati normalizzati rispetto ai livelli di espressione
del GAPDH di ogni campione. Le coppie di primers utilizzate per l‟amplificazione
delle sequenze geniche sono le seguenti:
CD44std F: 5‟-ATCACCGACAGCACAGACAG-3‟
CD44std R: 5‟-GGTTGTGTTTGCTCCACCTT-3
CD44v5 F: 5‟-GAAACTGGAACCCAGAAGCA-3‟
CD44v5 R: 5‟-TGTGGGGTCTCTTCTTCCTC-3‟
CD44v6 F: 5‟-CCCAGAAGGAACAGTGGTTT-3‟
CD44v6 R: 5‟-CAGCTGTCCCTGTTGTCGAA-3‟
66
4. RISULTATI.
4.1. Attivazione di Sam68 in cellule esprimenti ALK.
Sam68 ha una struttura che le permette di interagire con trasduttori cellulari
in risposta all‟attivazione di molti recettori ad attività tirosin-chinasica, come si
verifica in seguito a stimolazione del recettore dell‟insulina (Sanchez-Margalet, V
and Najib, S. 1999) e nella trasduzione del segnale mediata da c-Kit (Paronetto, M.P.
et al., 2004). Inoltre, nei linfociti T la stimolazione del TCR porta all‟aumento dei
livelli di fosforilazione in tirosina di Sam68 (Najiib, S. et al., 2005).
Ho voluto, quindi, valutare la possibilità di un coinvolgimento di Sam68
nella trasduzione mediata dal recettore ALK.
A questo scopo ho inizialmente utilizzato la linea di fibroblasti murini NIH3T3 transfettate con una proteina chimerica EGFR/ALK (da qui in poi denominata
NIH-EGFR/ALK), precedentemente caratterizzata per le sue capacità di indurre in
varie linee cellulari risposte biologiche EGF-stimolabili, ma ALK-specifiche
(Piccini, G. et al 2002; Bacchiocchi, R. et al, 2005). Tale sistema permette di
analizzare, in assenza di un ligando scientificamente riconosciuto, l‟analisi dei
processi molecolari mediati da questo recettore in condizioni di attivazione
controllata (Piccinini, G. et al., 2002).
A questo scopo le cellule sono state coltivate in medium senza siero per circa
16 ore e successivamente stimolate con 100 ng/ml EGF per periodi di tempo
differenti prima di essere sottoposte a lisi. I lisati ottenuti sono stati quindi
immunoprecipitati con un anticorpo anti-Sam68 e successivamente divisi in due
aliquote, ognuna delle quali è stata separata per SDS-PAGE e quindi analizzata per
Western-Blot con anticorpo anti-pTyr, per valutare il livello di fosforilazione di
Sam68 o con anticorpo anti-Sam68 al fine di controllare che, da ogni lisato, fossero
stati effettivamente immunoprecipitati quantitativi simili. La stimolazione di ALK
provoca la fosforilazione in tirosina di Sam68 che raggiunge i massimi livelli dopo
circa 10 minuti dal trattamento delle cellule con EGF, come si evince dal risultato
mostrato in figura 17.
Simili esperimenti sono stati effettuati su cellule Karpas299, una linea umana
67
ottenuta da un caso di ALCL, esprimente la proteina oncogenica NPM/ALK. Nello
specifico, tali cellule sono state coltivate per 6 ore in un mezzo contenente 2% di
BSA prima di essere sottoposte a lisi e conseguente immunoprecipitazione. Come
mostrato in Figura 17 in tali cellule è possibile osservare una fosforilazione
costitutiva di Sam68.
Nel loro insieme questi risultati dimostrano una modulazione dello stato
fosforilativo sui residui tirosinici di Sam68 dipendente dalla attivazione di ALK e
quindi un suo possibile coinvolgimento nella trasduzione del segnale da esso
mediata.
NIH-EGFR/ALK
EGF:
Karpas
+
IP: α-Sam68
WB: α-ptyr
IP: α-Sam68
WB: α-Sam68
WB: α-pTyr
Figura 17: Livelli di fosforilazione in tirosina della proteina Sam68. Cellule NIH-EGFR/ALK e
cellule Karpas299 sono state starvate e successivamente coltivate in assenza (-) o in presenza di EGF
100 ng/ml per 10 minuti a 37°C. I lisati cellulari sono stati immunoprecipitati con l’anticorpo antiSam68; gli immunocomplessi sono stati separati per SDS-PAGE e analizzati per Western Blot
utilizzando un anticorpo anti-fosfotirosina (pannello superiore) o anti-Sam68 (pannello inferiore).
4.2. Effetti del silenziamento di Sam68 sulla migrazione e sulla
proliferazione.
Al fine di valutare l‟importanza di Sam68 per le proprietà trasformanti di
ALK, ho voluto analizzare gli effetti biologici conseguenti all‟inibizione
dell‟espressione di Sam68 nelle cellule Karpas299. Le cellule Karpas299 sono state,
quindi transfettate per elettroporazione con due diversi plasmidi RNA interferenti
(shRNA; Short Harpin RNA; vedi capitolo 3.14) o con un plasmide vuoto (scramble
shRNA), utilizzato come controllo negativo. 48 ore dopo la transfezione le cellule
sono state lisate e controllate per i livelli di espressione di Sam68 tramite analisi per
Western Blot. La transfezione con il shRNA-1 non interferisce significativamente
con la produzione endogena di Sam68, dato che i livelli di espressione sono
68
comparabili a quelli osservabili nelle cellule Karpas299 non transfettate
o
transfettate con il shRNA di controllo; per tale motivo tale reagente è stato scartato
dalle successive fasi sperimentali. Al contrario, seppur non in grado di abolirne
completamente l‟espressione, la transfezione con il shRNA-2 comporta una drastica
diminuzione di Sam68 (Figura 18A).
Karpas 299
Saggio di migrazione
B
Migratig cells (% of control)
A
100
80
60
40
20
0
Karpas299
Karpas C-
Karpas-sh2
Figura 18. Effetto del silenziamento di Sam68 con plasmidi shRNA sulla migrazione delle cellule
Karpas 299. 48 ore dopo la transfezione con shRNA-1, shRNA-2 o il vettore scramble (C-) le cellule
Karpas299 sono state lisate ed analizzate per il loro contenuto in Sam68 tramite Western Blot
utilizzando un anticorpo specifico (A) e contemporaneamente ne è stata valutata la capacità di
migrazione. Il risultato è espresso come percentuale di migrazione rispetto al controllo (valore della
migrazione delle cellule Karpas299 non transfettate, assunto come 100%) (B).
Tali cellule (Karpas299-Sh2) sono state quindi sottoposte a test di migrazione
attraverso membrane di policarbonato Transwell (diametro dei pori 8 m) in
comparazione alle cellule Karpas299 e Karpas299 transfettate con il shRNA
scramble di controllo. Come si può osservare dalla Figura 18 B, il silenziamento di
Sam68 correla con una fortissima inibizione della migrazione cellulare (inibizione
intorno al 75% rispetto ai controlli). Un effetto molto meno importante, seppur
significativo, del silenziamento di Sam68, è stato osservato con il test colorimetrico
MTT, che consente la valutazione della vitalità cellulare, correlabile al tasso di
proliferazione.
transfezione,
Più nello specifico, il test MTT, eseguito dopo 48 ore dalla
ha
evidenziato
nelle
cellule
Karpas299-Sh2
un
decremento
colorimetrico di circa il 20% quando paragonato a quello osservato nelle cellule
controllo (Figura 19).
69
Saggio MTT
OD (% of control)
100
80
60
40
20
0
Karpas299
Karpas C-
Karpas-sh2
Figura 19. Effetto del silenziamento di Sam68 sulla proliferazione delle cellule Karpas299. 48
ore dopo la transfezione con il plasmide shRNA-2 e il vettore scramble (C-), le cellule Karpas299
sono state sottoposte a saggio colorimetrico con MTT.
Per confermare ulteriormente questo dato, il silenziamento di Sam68 è stato
da me anche perseguito mediante infezione delle cellule Karpas299 con due vettori
lentivirali contenenti shRNA (pLLh1-Sam68 pLLh2-Sam68; vedi paragrafo 3.1) in
grado di integrarsi nel DNA genomico cellulare e trascrivere molecole di RNA
interferenti con il trascritto umano di Sam68 ed impedirne la traduzione e quindi
l‟espressione. Come controllo negativo, le cellule Karpas299 sono state anche
infettate con lo stesso construtto lentivirale privo di sequenze interferenti (pLL-C-).
Quarantotto ore dopo l‟infezione, le cellule sono state analizzate per citofluorometria
con lo scopo di
calcolare la percentuale delle cellule infettate in base alla
fluorescenza emessa dalla molecola GFP, contenuta nel construtto lentivirale. I
risultati sono riportati nella Figura 20A: la percentuale di cellule positive era del
21,7%, 49,5% e 73;5% per le cellule infettate con pLL-h1-Sam68, pLL-h2-Sam68 e
pLL-C- rispettivamente. L‟analisi per Western blot delle cellule infettate ha
evidenziato una significativa diminuizione dell‟espressione di Sam68 solamente
nelle cellule infettate con il costrutto pLL-h2-Sam68 (Figura 20 B). Tuttavia, dato
che l‟efficienza di infezione non si era rivelata ottimale, ho sottoposto le
Karpas299/pLL-C- (da qui in avanti denominate Karpas-CTR) e le Karpas-pLLh2Sam68 (da qui in avanti denominate Karpas-H2) a separazione tramite FACS-
70
sorting, una procedura che permette di selezionare solo le cellule fluorescenti e
quindi solo quelle che hanno incorporato il costrutto lentivirale. L‟analisi per
Western blot effettuata dopo FACS-sorting è mostrata in Figura 20 C: con tale
procedura sono riuscita ad ottenere una completa abolizione dell‟espressione di
Sam68 nelle cellule Karpas-H2.
A
B
Karpas 299
Sam68
β-actina
C
Karpas 299
Sam68
β-actin
Figura 20. Silenziamento di Sam68 mediante l’uso di vettori lenti virali nelle cellule Karpas 299
(A)Quarantotto ore dopo l’infezione, le cellule sono state analizzate per citofluorometria per
controllare l’efficienza d’infezione (B). e per Western Blot, per analizzare l’espressione della proteina
Sam68 (C).Dopo FACS-sorting, le cellule sono state lisate e quindi analizzate per Western Blot, per
analizzare l’espressione della proteina Sam68 (pannello superiore) e della β- actina utilizzata come
controllo interno dell’esperimento(pannello inferiore)
Sulle cellule ottenute dopo FACS-sorting, ho inoltre analizzato le curve di
crescita. I dati, riportiati in Figura 21, evidenziano una significativa diminuzione
della vitalità/proliferazione cellulare in seguito ad abolizione dell‟espressione di
Sam68, pari a circa il 35% (giorno 3-5), confermando il dato precedentemente
osservato sulle cellule Karpas-sh2 con il saggio colorimetrico MTT.
71
Curva di crescita
cells number x 10^5
60
50
40
30
Karpas299
20
Karpas-CTR
10
Karpas-H2
0
0
2
4
6
8
days of culture
Figura 21. Effetto del silenziamento di sam68 sulla crescita delle cellule. Le cellule Karpas299,
Karpas-CTR e Karpas-H2 sono state starvate e coltivate per gli intervalli di tempo indicati ad una
concentrazione iniziale 105 /ml. Le cellule sono state colorate con trypan blue e contate ogni giorno
per una settimana.
I livelli di espressione di p21/WAF1, una proteina in grado di arrestare il
ciclo cellulare legando i complessi CDK4/ciclinaD1 e CDK2/ciclina E (Harper, J.W.,
et al., 1993), risultano elevati nelle cellule Karpas-H2 se paragonati a quelli
riscontrati nelle cellule di controllo (Karpas299 e Karpas-CTR) (Figura 22).
Karpas299
WB: α-p21
WB: α-β actina
Figura 22. Espressione di p21 nelle cellule Karpas-H2. Le cellule Karpas 299, Karpas-CTR e
Karpas-H2 sono state lisate ed analizzate per la loro espressione di p21 tramite Western Blot
utilizzando un anticorpo specifico (pannello superiore). Nel pannello inferiore sono mostrati i livelli
della β- actina nei rispettivi lisati (pannello inferiore).
Anche la migrazione delle cellule Karpas-H2 è drasticamente inibita rispetto
alle cellule controllo. In tali esperimenti l‟inibizione osservata è di circa l‟85 %, in
72
linea con il totale silenziamento dell‟espressione di Sam68 raggiunto con il costrutto
lentivirale (Figura 23).
Migrating cells (% of control)
Saggio di migrazione
100
80
60
40
20
0
Karpas299
Karpas-CTR
Karpas-H2
Figura 23. Effetto del silenziamento di Sam68 ottenuta con un costrutto lentivirale sulla
migrazione delle cellule Karpas 299. La capacità di migrazione delle cellule Karpas 299, KarpasCTR e Karpas-H2 è stata valutata analizzando il loro passaggio attraverso membrane di
policarbonato Transwell. Il risultato è espresso come percentuale di migrazione rispetto al controllo
(valore della migrazione delle cellule Karpas299 non transfettate, assunto come 100%).
4.3.
Effetti
del
silenziamento
di
Sam68
sull’azione
dei
chemioterapici.
Il silenziamento di Sam68 nelle cellule LNCaP, cellule androgeno-responsive
derivate da carcinoma prostatico, è stato associato ad una maggiore sensibilizzazione
all‟apoptosi indotta da chemioterapici (Busà, R. et al., 2007). Per valutare se un
simile effetto è osservabile anche nei miei modelli sperimentali, le cellule KarpasCTR e Karpas-H2 sono state coltivate per 24 ore e 48 ore in assenza o in presenza di
cisplatino (concentrazioni finali di 10, 15 e 20 µM), prima di effettuare il test
colorimetrico con MTT. In figura 24, relativa al trattamento per 24 ore, si può
apprezzare l‟effetto citotossico dose-dipendente del cis-platino sulle cellule di
controllo. Dopo abolizione dell‟espressione di Sam68 si assiste, tuttavia, ad una
drastica sensibilizzazione delle cellule al chemioterapico. Tale risultato suggerisce
che questa proteina, la cui iper-espressione è stata osservata in diverse neoplasie
73
umane, possa essere coinvolta con un meccanismo di adattamento con cui le cellule
neoplastiche acquisiscano resistenza al trattamento con il chemioterapico.
A
SAGGIO DI CHEMIOSENSIBILITA'
100
80
60
Karpas-CTR
40
20
0
NT
10μM
15μM
20μM
B
OD (% of control)
100
80
60
Karpas-H2
40
20
0
NT
10μM
15μM
20μM
Figura 23. Figura 23. Sensibilità delle cellule Karpas299 al cis-platino dopo silenziamento di
Sam68.. Le cellule Karpas-CTR (A) e Karpas-H2 (B) sono state trattate per 24 ore con cisplatino alle
dosi indicate, prima di valutarne la vitalità tramite saggio colorimetrico MTT Il risultato è espresso
come percentuale rispetto al controllo (cellule NT, non trattate).
74
4.4. Ruolo di p60src sull’attivazione di Sam68.
Sam68 deve il suo nome al fatto di essere stata scoperta come substrato di
p60src durante la mitosi (Ellis, C. et al., 1990). L‟interazione diretta tra queste due
proteine è stata successivamente dimostrata in molti studi su sistemi cellulari diversi
(Wong, G. et al., 1992; Fumagalli, S. et al., 1994; Taylor, S. J. and Shalloway, D.
1994; Weng, L. et al., 1994). Nei linfociti T, la stimolazione del TCR e la
conseguente attivazione di p56lck e p59fyn, membri della famiglia src, è associabile
all‟aumento dei livelli di fosforilazione in tirosina di Sam68.
Nelle cellule di carcinoma prostatico è stato dimostrato come l‟espressione
della forma troncata del recettore c-Kit promuove una forte attivazione di p60src con
conseguente aumento della fosforilazione di Sam68. In base a queste osservazioni, è
stata suggerita la possibilità che la pathway p60src/Sam68 possa esser coinvolta nella
patogenesi di tale neoplasia (Paronetto, M.P. et al., 2004).
La tirosina 979, presente sulla sequenza della chimera EGFR/ALK
(corrispondente alla tirosina 418 di NPM/ALK, secondo la numerazione definita da
Morris, S. W. Et al., 1994) è stata da noi precedentemente identificata come il
residuo responsabile del reclutamento di p60src. Infatti, l‟espressione del mutante
EGFR/ALKY979F, nel quale la tirosina 979 è stata sostituita con fenilanalina in
cellule NIH-3T3 (da qui in avanti denominate NIH-EGFR/ALKY979F) è correlata a
perdita completa dell‟associazione p60src-EGFR/ALK, anche dopo attivazione
recettoriale. Inoltre tale mutazione, pur non determinando in vivo cambiamenti
apprezzabili dell‟attività chinasica di ALK, si associa ad una drastica diminuzione
della capacità di promuovere proliferazione in risposta all‟ EGF, a sostegno del ruolo
critico svolto da p60src nella trasduzione ALK-mediata (Cussac, D. et al., 2004;
Bacchiocchi, R et al., 2005).
Esperimenti analoghi a quelli descritti in Figura 17 sono stati da me effettuati
sulle cellule NIH-EGFR/ALKY979F, esprimenti in superficie un numero di recettori
comparabile a quello delle cellule NIH-EGFR/ALK.
Gli esperimenti condotti hanno dimostrato la completa assenza della
fosforilazione in tirosina di Sam68 nelle cellule NIH-EGFR/ALKY979F, anche dopo
stimolazione con EGF 100 ng/ml (Figura 24A).
75
Analoghi risultati sono stati ottenuti sulle cellule NIH-EGFR/ALK (dati non
mostrati) e Karpas299 (Figura 24B) in seguito a inibizione farmacologica selettiva di
p60src con il composto PP2.
A
B
NIH-EGFR/ALK Y979F
PP2:
+
EGF:
Karpas299
+
IP: α-Sam68
IP: α-Sam68
WB: α-pTyr
WB: α-pTyr
IP: α-Sam68
WB: α-Sam68
IP: α-Sam68
WB: α-Sam68
Figura 24: Ruolo di p60src nella fosforilazione di Sam68 mediata da ALK. Dopo la starvation le
cellule NIH EGFR/ALK Y979F sono state cultivate in assenza (-) o presenza (+) di EGF 100 ng/ml
per10 minuti a 37°C e sucessivamente lisate (A). Le cellule Karpas 299 sono state starvate e incubate
con DMSO come controllo (-) o con PP2 1 μM per 30 minuti (+) e successivamente lisate. (B) (A,B)
I lisati cellulari sono stati immunoprecipitati con l’anticorpo anti-Sam68; gli immunocomplessi sono
stati separati per SDS-PAGE e analizzati per Western Blot utilizzando un anticorpo anti-fosfotirosina
(pannello superiore) e anti Sam68 (pannello inferiore).
Questi risultati suggeriscono l‟esistenza di una via di trasduzione nella quale
l‟attivazione di ALK modulerebbe la fosforilazione di Sam68 attraverso meccanismo
p60src-dipendente.
4.5. Associazione Sam68/Vav1.
Sebbene Sam68 sia principalmente localizzata nel nucleo, osservazioni
sperimentali condotte su neuroni, fibroblasti e spermatociti infettati da virus,
indicano la sua presenza anche a livello citoplasmatico (McBride, A. E. et al., 1998;
Paronetto M. P. et al., 2006; Ben Fredj N. et al., 2006; Lazer G. et al., 2007). Un
lavoro più recente ha dimostrato la localizzazione di Sam68 in prossimità della
membrana plasmatica durante l‟invasione cellulare, in concomitanza della quale è
rapidamente fosforilata in tirosina ed utilizzata come molecola adattatrice per
modulare l‟attività di p60src, consentendo in questo modo una appropriata
76
segnalazione (Huo, M.-E.et al, 2009a). In base alle loro osservazioni sperimentali, gli
autori di questo lavoro suggeriscono la possibilità che la fosforilazione di Sam68
mediata da p60src sia necessaria per la sua importazione nel nucleo; tuttavia i dettagli
molecolari di come tale proteina sia poi effettivamente trasferita al nucleo rimangono
ancora assolutamente poco chiari.
Nella linea HEK293 (derivata da cellule renali di embrione umano) e nella
linea leucemica Jurkat T, è stata osservata l‟ associazione tra Sam68 e Vav1 in vivo
(Lazer G. et al., 2007). Vav1 è una proteina appartenente alla famiglia di fattori di
scambio di nucleotidi guanidinici (GNEFs; Guanine Nucleotide Exchange Factors)
per le molecole RhoA, Rac1 e Cdc42 (Han J et al., 1997; Crespo et al., 1997). Dopo
la nascita, la sua espressione è essenzialmente confinata alle cellule del sistema
ematopoietico, dove svolge un ruolo importante per la migrazione e la sopravvivenza
cellulare (Katzav S. et al., 1989); al contrario, le altre due isoforme conosciute, Vav2
e Vav3, presentano quadri di espressione più ubiquitari (Movilla N. et al., 1999;
Henske E. P. et al., 1995). In molte neoplasie umane, i profili di espressione delle
proteine Vav appaiono sovvertiti, soprattutto per quel che riguarda Vav1, espressa
ectopicamente, con alta frequenza, in varie tumori come nel carcinoma della
mammella (Lane J. et al., 2008), del polmone (Lazer G. et al., 2009) dello stomaco
(Fernandez-Zapico M. E. et al., 2005) e nei neuroblastomi (Hornestein I. et al.,
2003). L‟espressione ectopica delle molecole Vav1 nelle neoplasie umane fa
presuppore un suo ruolo nell‟acquisizione del fenotipo trasformato. La funzione
biologica espletata da Vav1 in contesti cellulari diversi dal sistema ematopoietico,
potrebbe, infatti, determinare uno squilibrio della normale segnalazione intracellulare
con conseguente deregolazione della proliferazione e della migrazione, come
sperimentalmente dimostrato dal fatto che l‟iper-espressione di Vav1 è in grado di
trasformare fibroblasti NIH3T3 (Katzav S. et al., 1991; Coppola J. et al., 1991).
Per confermare l‟importanza dell‟interazione Sam68/Vav1 ed eventualmente
caratterizzarne il ruolo nella patogenesi delle neoplasie, ho ritenuto interessante
valutarne l‟esistenza nell‟ambito della segnalazione ALK-mediata. A questo scopo
esperimenti di co-immunoprecipitazione sono stati da me effettuati, utilizzando come
modello sperimentale sia le cellule Karpas299 sia cellule 32D infettate con un
costrutto retrovirale contenente la proteina di fusione NPM/ALK (da qui in poi
denominate 32D-NPM/ALK). Le cellule 32D sono una linea mieloide murina la cui
77
propagazione è strettamente dipendente dalla presenza di IL-3 nel mezzo di coltura
(Pierce, J.H. et al., 1988). Tale linea cellulare è frequentemente utilizzata come
modello sperimentale di trasformazione, dato che numerosi studi hanno dimostrato
come l‟espressione di molecole ad attività oncogenica in queste cellule sia sufficiente
per indurre proprietà proliferative IL-3 indipendenti (Fazioli, F. et al. 1993).é stato
precedentemente dimostrato che anche l‟espressione di NPM/ALK in queste cellule
risulta nell‟acquisizione di un fenotipo IL-3-indipendente, a dimostrazione delle
proprietà trasformanti di NPM/ALK (Bacchiocchi, R. et al., 2005).
Come mostrato in Figura 25, l‟anticorpo anti-Vav1 è capace di
immunoprecipitare il complesso Vav1-Sam68 sia nelle cellule Karpas299 che nelle
cellule 32D-NPM/ALK; l‟assenza di questa interazione nella linea 32D parentale
indica che l‟associazione è dipendente dall‟attività enzimatica di ALK.
Figura 25: Figura 25. Associazione Va1/Sam68. Le cellule Karpas299, 32D e 32D-NPM/ALK sono
state coltivate per 6 ore in un mezzo contenente 2% di BSA prima di essere sottoposte a lisi. Uguali
quantità di lisato cellulari sono stati immunoprecipitaei con un anticorpo anti-Sam68; gli
immunocomplessi sono stati quindi separati per SDS-PAGE e analizzati per Western blot utilizzando
un anticorpo anti-Vav1 (pannello superiore) o anti Sam68 (pannello centrale). Lo stesso lisato è stato
analizzato direttamente per Western blot con anticorpo-anti Vav1(pannello inferiore).
4.6. Fosforilazione in vivo di Vav1.
La stimolazione di diversi recettori, ivi compresi recettori dell‟immunità
specifica, integrine e recettori per fattori di crescita, determina la rapida
fosforilazione in tirosina delle proteine Vav, fosforilazione ampiamente correlata alla
sua attivazione enzimatica (Bustelo X. R., 2001). Studi NMR hanno, infatti,
dimostrato che il meccanismo responsabile dell‟attivazione delle proteine Vav
consiste nell‟apertura di un ansa auto-inibitoria presente in prossimità di un residuo
78
tirosinico situato nella regione acidica della molecola (Aghazadeh B. et al., 2000).
Va, inoltre, sottolineato che diverse evidenze sperimentali hanno dimostrato
l‟importanza di Vav1 per le proprietà trasformanti di varie oncoproteine a
localizzazione citoplasmatica, incluso
Bcr/Abl, l‟oncogene implicato
nella
patogenesi della leucemia mieloide cronica (Basserman, F. et al, 2002).Ho, pertanto,
ritenuto opportuno eseguire una serie di esperimenti atti a valutare i livelli di
fosforilazione di Vav1 nei miei modelli sperimentali. A tale scopo, le cellule
Karpas299, 32D-NPM/ALK e 32D-EGFR/ALK sono state coltivate per 6 ore in
condizioni di “serum-starvation”. Prima di effettuare la lisi, le cellule esprimenti la
chimera EGFR/ALK sono state coltivate ulteriormente per 10 min. a 37°C in assenza
(-) o in presenza di EGF 100 ng/ml. I lisati ottenuti sono stati immunoprecipitati con
l‟anticorpo anti-Vav1, separati per SDS-PAGE e quindi analizzate per Western blot
sia con anticorpi anti-fosfotirosina, sia con anticorpi anti-Vav1 al fine di verificare
che simili quantitativi fossero stati effettivamente immunoprecipitati da ciascun
lisato.
B
A
Karpas299
32D
32D-EGFR/ALK
32D N/A
EGF:
+
IP: α-Vav1
WB: α-pTyr
IP: α-Vav1
WB: α-Vav1
Figura 26. Livelli di fosforilazione in tirosina di Vav. (A) Cellule Karpas299, 32D e 32DNPM/ALK sono state coltivate per 16 ore in condizioni di “starvation” prima di esser lisate. Uguali
quantità di proteine cellulari sono state immunoprecipitate con un anticorpo anti-Vav1:
successivamente gli immunoprecipitati sono stati analizzati per Western blot con un anticorpo antifosfotirosina (pannello superiore) o con anticorpi anti-Vav1 (pannello inferiore) (B) Le cellule 32DEGFR/ALK sono state deprivate di siero per 16 ore e successivamente mantenute per 10 minuti a
37°C in assenza (-) od in presenza di EGF 100 ng/ml EGF (+) prima di essere sottoposte a lisi.
L’immunoprecipitazione ed l’analisi per Western blot sono state effettuate come descritto in A.
I risultati ottenuti, riportati nella Figura 26, hanno messo in evidenza una
fosforilazione costitutiva di Vav1 nelle Karpas299 e nelle 32D-NPM/ALK; è
rilevante notare che nelle cellule 32D-NPM/ALK, i livelli di fosforilazione di Vav1
sono significativamente più elevati rispetto a quelli osservati nella linea parentale
79
32D (Figura 26 A), ad indicazione del fatto che la fosforilazione di Vav1 può essere
direttamente correlata all‟espressione dell‟oncogene NPM/ALK.
Tale assunto è stato ulteriormente confermato dal risultato ottenuto sulle
cellule 32D-EGFR/ALK, nel quale si nota il drastico aumento della fosforilazione di
Vav1 in seguito alla stimolazione delle cellule con EGF (Figura 26 B)
4.7. Attivazione di Rac1.
Dato che, sia in vitro che in vivo, Vav1 è inequivocabilmente un fattore di
scambio preferenziale per Rac1 (Movilla, N. et al., 2001), ho ritenuto opportuno
verificare se l‟attività enzimatica Rac1 è correlabile all‟ attivazione di ALK. A
questo scopo sono stati da me effettuati test di co-immunoprecipitazione con uso
della GST- PAK-CRIB, una proteina ricombinante costituita dalla Glutatione-STrasferasi (GST) in fusione con il dominio CRIB (Cdc42/Rac Interactive Binding
region) della proteina PAK, purificata come descritto nel paragrafo 3.14; tale
proteina è in grado di legare in maniera specifica solo la forma attivata di Rac1, cioè
solo quella legata al GTP. Tali esperimenti sono stati condotti su lisati ottenuti da
cellule Karpas299, 32D-NPM/ALK e 32D-EGFR/ALK.
A
B
Karpas
32D
32D-EGFR/ALK
32DN/A
EGF:
Rac1-GTP
Rac1
+
Rac1-GTP
Rac1
Figura 27. Attivazione di Rac1. Cellule Karpas299, 32D, 32D-NPM/ALK (A) e 32D-EGFR/ALK (B)
sono state mantenute in “condizioni di starvation” per 16 ore; le cellule 32D-EGFR/ALK sono state
ulteriormente coltivate per 10 minuti a 37°C in assenza (-) o in presenza (+) di EGF 100 ng/ml prima
di effettuare la lisi. L’immunoblot, effettuato utilizzando l’anticorpo anti-Rac, è stato eseguito
direttamente sugli estratti cellulari (100 µg delle proteine totali, pannello inferiore) o dopo
incubazione con 15 μg di GST-PAK-CRIB purificata (3 mg delle proteine totali, pannello superiore).
La posizione delle molecole in analisi è indicata a destra della figura.
80
Come controllo positivo del saggio, simili esperimenti sono stati condotti su
cellule NIH-EGFR/ALK transfettate transientemente con il costrutto pEXV-Val12Rac1-myc che trascrive per una versione costitutivamnete attiva di Rac1. Come si
può osservare in Figura 27 A, un‟elevata attivazione di Rac1 è riscontrabile nelle
cellule Karpas299. In linea con questo risultato, elevati livelli di Rac1-GTP sono
evidenziabili nelle cellule 32D-NPM/ALK; a tale riguardo è importante notare che in
queste cellule i livelli di attivazione di Rac1 sono significativamente più elevati
rispetto a quelli osservati nella linea parentale 32D. Un significativo aumento dei
livelli di attivazione è, inoltre evidente nelle cellule 32D-EGFR/ALK dopo
stimolazione con EGF (Figura 27 B), ad ulteriore sostegno della diretta correlazione
esistente tra l‟attività catalitica di ALK ed i livelli intracellulari di Rac1-GTP.
Per ottenere un ulteriore riscontro sperimentale sul ruolo svolto da Vav1 nella
modulazione dell‟attività di Rac1 durante la segnalazione ALK-mediata, simili
esperimenti sono stati effettuati su cellule Karpas299 dopo soppressione
dell‟espressione di Vav1 ottenuta mediante transfezione cellulare con plasmidi pRS
contenti shRNA specifici (vedi paragrafo 3.16), sintetizzati dalla ditta Origene.
Nessun costrutto era in grado di abolire completamente l‟espressione di Vav1 nelle
cellule Karpas299; tuttavia, per la successiva fase sperimentale, è stata da me
selezionata la sequenza che garantiva maggiore soppressione (Figura 28 A).
A
B
Karpas299
pRS C-
Karpas299
shRNA
pRS C-
Vav1
-actin
shRNA
Rac1-GTP
Rac1
Figure 28. Effetto del silenziamento di Vav1 sull’attivazione di Rac1.Quarantotto ore dopo
transfezione transiente con un plasmide pRS contenente un shRNA specifico per la sequenza di Vav1 o
con il plasmide controllo, le cellule Karpas299 sono state lisate e successivamente (A) analizzate
tramite Western blot per valutare i livelli di espressione di Vav-1 (pannello superiore) o di β-actina,
assunti quali controllo sperimentale interno; (B) e analizzate per il contenuto di Rac1-GTP (pannello
superiore) od il contenuto totale di Rac1 (pannello inferiore).
Quarantotto ore dopo la transfezione con il plasmide selezionato, sono stati
effettuati esperimenti di immunoprecipitazione con GST- PAK-CRIB, analoghi a
81
quelli appena descritti. I risultati ottenuti, riportati in Figura 28 B, rivelano una
severa diminuizione dei livelli di attivazione di Rac1. rispetto a quelli osservati nelle
cellule transfettate con un plasmide controllo (contenente un shRNA scramble).
4.8. Effetti biologici del silenziamento di Vav1.
La soppressione dei livelli di espressione di Vav1 nelle cellule Karpas299
determina una compromissione della capacità migratoria, valutata con saggio su
membrane Transwell (circa il 35% di inibizione rispetto alle cellule Karpas229
transfettate con il plasmide di controllo) (Figura 29 A). Tuttavia, l‟effetto biologico
significativamente più rilevante è osservabile sulla crescita cellulare. Come mostrato
in Figura 29 B, bassi livelli di espressione di Vav1 comportano un‟alterazione
evidente della proprietà proliferativa, con valori di inibizione rispetto al controllo
pari a circa il 60% già dopo due giorni dalla tranfezione.
A
100
100
OD (% of control)
Migrating cells (% of control)
B
50
0
pRSCpRS
C-
sh3 Vav1
shRNA
50
0
pRSCpRS
C-
sh3 Vav1
shRNA
Figura 29. Effetto del silenziamento di Vav1 sulla migrazione e proliferazione delle cellule
Karpas299. 48 ore dopo la transfezione con il plasmide di controllo (pRS) o con il plasmide
contenente l’shRNA specifico per Vav1 (vedi capitolo 3.16 e nella precedente figura), le cellule
Karpas299 sono state coltivate in condizioni di starvation prima di : (A) consentire la migrazione
verso un mezzo contenente FBS al 10% attraverso filtri Transwell; (B) effettuare saggio colorimetrico
con MTT dopo ultriori 48 ore di coltura. Per ogni serie di esperimenti, i risultati sono espressi come
% rispetto ai valori delle cellule Karpas299 transfettate con plasmide di controllo .
82
4.9. Sam68 e mesotelioma.
Un numero sempre maggiore di analisi sperimentali sono a sostegno della
funzione biologica svolta da Sam68 nella trasformazione neoplastica. A questo
riguardo, particolarmente interessante è l‟osservazione che l‟aploinsufficienza per il
gene Sam68 rallenta lo sviluppo di tumori mammari e diminuisce la formazione di
metastasi in un modello animale della neoplasia (Richard S, et al., 2008). Inoltre,
l'azione di Sam68 è richiesta per la trasformazione neoplastica indotta da due potenti
oncogeni: MLL-EEN (Cheung, N. et al., 2007) e Vav1 (Lazer G et al., 2007).
Per quel che riguarda il mesotelioma maligno, sono attualmente assenti in
letteratura dati riguardanti il ruolo svolto da Sam68. Ho, quindi ritenuto opportuno,
nella fase finale del dottorato, estendere alcuni aspetti della mia sperimentazione,
soprattutto per quel che riguarda la suscettibilità ai chemioterapici e le proprietà
migratorie su cellule non immortalizzate MM-5, derivate da una biopsia prelevata da
un paziente affetto da mesotelioma maligno della pleura.
4.9.1. Effetti del silenziamento di Sam68 su cellule MM-5
Le cellule MM-5 sono state transientemente transfettate con il plasmide
shRNA-2 specifico per Sam68 descritto nel paragrafo 4.2. (da qui in poi denominate
MM-5-sh2) e con il plasmide controllo (da qui in poi denominate MM5-C-). I livelli
di espressione di Sam68, valutati tramite Western Blot 48 ore dopo la transfezione,
sono mostrati nella Figura 30.
MM-5
WB: α-Sam68
WB: α-β actina
Figura 30: Transfezione delle cellule di mesotelioma maligno MM-5 con plasmidi shRNA
specifici per Sam68. 48 ore dopo la transfezione le cellule MM-5 sono state lisate ed analizzate
tramite Western Blot con un anticorpo anti-Sam68 (pannello superiore) o con un anticorpo per la βactina come controllo interno dell’esperimento. (pannello inferiore).
83
Anche se in queste cellule non ho ottenuto lo stesso livello di soppressione
osservato nelle cellule Karpas299, i risultati hanno mostrato una significativa e
drastica diminuzione di Sam68 endogeno rispetto al controllo.
Tali cellule (MM-5-sh2 e MM-5-C-) sono state sottoposte a test colorimetrico
con MTT, dopo coltura per 24 e 48 ore dalla transfezione, in assenza o in presenza di
cisplatino alle dosi di 20μM e 40 μM. In linea con la minore soppressione
dell‟espressione di Sam68, il decremento colorimetrico osservato sia in assenza che
in presenza del chemioterapico, seppur presente, non era altrettanto evidente come
quello ottenuto sulle cellule Karpas299.
Figura 31: Effetto della soppressione di Sam68 sulle capacità migratorie delle cellule MM-5. Le
cellule MM-5, MM-5 C- e MM-5-sh2 sono state coltivate in una piastra da 24 pozzetti; due scratchs
sono stati praticati orizzontalmente, vicini al centro del pozzetto, utilizzando un puntale da 10μl
sterile, quando le cellule avevano raggiunto una confluenza del 70-80% (tempo 0, TO);
l’osservazione al microscopio a contrasto di fase, effettuata dopo 24 (T24) e 48 (T48) ore, può
evidenziare la capacità delle cellule di ripristinare la confluenza originaria.
Anche su tale sistema cellulare, un effetto particolarmente significativo è
stato osservato sulla capacità migratoria, nonostante la riduzione della proteina
84
endogena ottenuta non fosse ottimale. A questo riguardo, i dati migliori sono stati
ottenuti con il il test di Wound/Healing, comunemente chiamato“scratch test”, come
si evince dalle fotografie, mostrate in figura 31, scattate a 24 e 48 ore dall‟inizio del
saggio.
4.9.2. Localizzazione di Sam68 nelle cellule di mesotelioma maligno
dopo trattamento con cisplatino.
Recentemente è stato dimostrato che il trattamento con mitoxantrone, un
inibitore della topoisomerasi II, determina nelle linea cellulare di carcinoma
prostatatico PC3, una rilocalizzazione di Sam68, che da una diffusa distribuzione
nucleare, passa ad una distribuzione in aree ben distinte dall‟apparenza granulare,
presenti sia a livello nucleare che citoplasmatico. È stata avanzata l‟ipotesi che tali
granuli nucleari e citoplasmatici indotti dallo stress genotossico rappresentino delle
aree di intensa attività metabolica sull‟RNA, come avvalorato dalla concomitante
presenza in queste aree di altre RBP coinvolte nello splicing alternativo (Busà, R. et
al., 2010).
Figura 32: Ri-distribuzione di Sam68 nelle cellule MM-5 in seguito a trattamento con cisplatino. Le cellule sono state coltivate in assenza (pannelli superiori) e in presenza di cis platino
20μM (pannelli inferiori) Dopo 48 ore i campioni sono stati incubati con il colorante Hoechst
(colorazione blu) e con l’ anticorpo anti-Sam68 (colorazione rossa) prima di essere analizzati al
microscopio a fluorescenza.
85
Ho ritenuto interessante determinare se un simile fenomeno possa essere
indotto nel mio sistema cellulare dal trattamento con cisplatino. A questo scopo le
cellule MM-5 sono state coltivate per 48 ore in assenza o in presenza di cisplatino
alla dose 20μM, prima di essere analizzate per immunofluorescenza mediante l‟uso
di un anticorpo specifico per Sam68. I dati di questi esperimenti sono mostrati in
Figura 32, nella quale sono riportate immagini rappresentative. Mentre nelle cellule
MM-5 non trattate si osserva una diffusa localizzazione principalmente nucleare , il
trattamento con il cisplatino comporta lo spostamento di Sam68 a livello
citoplasmatico.
4.9.3. Effetti del silenziamento di Sam68 sull’espressione delle
isoforme di CD44
CD44 è una glicoproteina transmembrana coinvolta nell‟adesione, nella
proliferazione e nella migrazione cellulare. Questa capacità di CD44 di intervenire in
diversi processi cellulari risiede nel meccanismo di processamento alternativo del
suo pre-mRNA, consentendo la traduzione di diverse isoforme proteiche con
proprietà biologiche differenti. In particolare il pre-mRNA di CD44 è composto da
10 esoni costitutivi e 10 esoni variabili e può essere processato in circa 20 mRNA
alternativi che traducono isoforme proteiche caratterizzate da proprietà biologiche
differenti (vedi paragrafo 1.1.3 e Figura 7): l‟espressione delle isoforme contenenti
l‟esone variabile 5 (CD44v5) conferisce alle cellule capacità migratorie ed è
riscontrabile durante il movimento delle cellule T e durante la fase invasiva di molti
tumori (Matter, N. et al., 2002). Sam68 promuove l‟inclusione di vari esoni, ivi
compresa la variante v5. (Cheng, C. and Sharp, P.A., 2006; Matter, N. et al., 2002).
Ho voluto quindi indagare nelle cellule MM-5 gli effetti della soppressione di
Sam68 sull‟espressione di alcune isoforme di CD44 e piu in particolare
sull‟espressione dell‟isoforma standard (da qui in poi denominata CD44std) e delle
isoforme contenenti gli esoni variabili v5 (da qui in poi denominata CD44v5) e v6
(da qui in poi denominata CD44v6). L‟analisi è stata effettuata su cellule MM-5-sh2
e MM-5C- mediante Real Time PCR utilizzando opportuni primer come specificato
nel paragrafo 3.20. Come si evince dalla Figura 33, nessuna differenza significativa
è stata rilevata tra le due linee cellulari per quanto riguarda nei livelli di mRNA
86
relativi alle isoforma CD44std e CD44v6. Al contrario, una drastica e significativa
riduzione (pari a circa il 50%) è evidenziabile nei livelli di mRNA relativi
all‟isoforma CD44v5 nelle cellule MM-5-sh2 a conferma del ruolo svolto da Sam68
nello splicing di questa variante.
Real Time PCR
MM-5-sh2 vs MM-5-C1,4
X FOLD
1,2
1
0,8
CD44 std
CD44 v5
CD44 v6
0,6
0,4
0,2
Figura 33 Effetto della soppressione di Sam68 sull’espressione delle isoforme CD44 standard,
CD44 v5 e CD44 v6 nelle cellule di mesotelioma maligno. L’RNA totale, estratto delle cellule MM5-sh2 e MM5 C- è stato retrotrascritto ed analizzato in real time PCR con i primer specifici per CD44
std, CD44 v5 e CD44 v6 descritti nella sezione Materiali e Metodi. I risultati sono espressi come
espressione relativa (X fold) delle tre isoforme nelle cellule MM5-sh2 rispetto alla loro espressione
nelle cellule di controllo MM5-C-.
87
5. DISCUSSIONE.
La deregolazione dell‟espressione genica rappresenta il segno distintivo delle
cellule tumorali. L‟acquisizione di un nuovo profilo di proteine espresse può, infatti,
conferire alla cellula coinvolta nel processo di trasformazione neoplastica la capacità
di rientrare nel ciclo cellulare o la possibilità di usufruire di condizioni alternative di
crescita e/o di migrazione nettamente più vantaggiose rispetto a quelle disponibili per
le cellule normali. Una della modalità più efficienti e rapide per alterare l‟espressione
genica è rappresentata dalla sovversione dei normali processi che presiedono alla
maturazione e processazione degli mRNA già trascritti. Di fatto, modificazioni della
stabilità
degli
mRNA
e/o
dell‟efficienza
traduzionale
sono
sempre
più
frequentemente descritte nelle cellule tumorali.
La stabilità e la traduzione degli mRNA sono controllate da un complesso
network di interazioni RNA/proteine che coinvolge il riconoscimento di specifici
RNA bersaglio da parte di proteine leganti l‟RNA (RNA-BPs) (Lukong, K. E. et al.,
2008). Ciò spiega il grande interesse dimostrato negli ultimi anni dalla comunità
scientifica per questa classe di proteine: in particolare l‟attenzione si è
progressivamente focalizzata sulla molecola Sam68 mano a mano che si è iniziato a
intravederne la funzionalità biologica in concomitanza con la sua aberrante
espressione e/o deregolazione in varie neoplasie umane.
Le indagini sperimentali atte a dimostrare un possibile ruolo di Sam68 nella
trasformazione neoplastica sono state inizialmente contraddittorie. In un primo
momento, infatti, sono state attribuite a Sam68 proprietà oncosoppressorie in
contrasto con evidenze successive che ne testimoniano la funzione pro-oncogenica.
(Lukong, K.E. et al., 2008).
A sostegno dell‟ormai accreditato ruolo oncogenico di Sam68 sono diverse analisi
immunoistochimiche effettuate su biopsie ottenute da carcinomi alla prostata (Busà,
R. et al., 2007), alla mammella (Song, L. et al., 201) e al rene (Zhang, Z. et al.,
2009), che ne documentano la frequente iper-espressione. Ancor più interessanti
sono state le osservazioni sul fenotipo esibito dai topi knock out per il gene di
Sam68: nonostante questi animali manifestino gravi difetti nello sviluppo della
ghiandola duttale mammaria, essi mostrano una significativa refrattarietà allo
88
sviluppo di tumori. Inoltre, in un modello murino nel quale il tumore mammario è
sperimentalmente indotto grazie all‟espressione tessuto-mirata dell‟ antigene T
medio del polioma virus, l‟aploinsufficienza del gene di Sam68 correla con un
drastico rallentamento dell‟insorgenza della neoplasia nonché della eventuale
formazione di metastasi (Richard S, et al., 2008). Il potenziale oncogenico di Sam68
è anche supportato da studi che dimostrano come la sua espressione sia fondamentale
per la proliferazione e per la chemioresistenza di cellule derivanti da tumore alla
prostata (Busà, R. et al., 2007; Busà, R. et al., 2010) e alla mammella (Song, L. et al.,
201).
Il ruolo svolto da Sam68 nei processi di splicing alternativo sembrerebbe
particolarmente rilevante per l‟acquisizione del fenotipo neoplastico. E‟ stato
recentemente documentato il diretto coinvolgimento di Sam68 nello splicing di
varianti oncogeniche di diverse proteine, tra cui è importante citare CD44 (Matter, N.
et al., 2002), Bcl-x (Paronetto, M. P. et al., 2007) e la ciclina D1 (Paronetto, M. P. et
al., 2010). Va inoltre ricordato che Sam68 è coinvolta nei processi di trasduzione del
segnale di svariati recettori: la presenza di varie regioni ricche in prolina, nonché la
sua rapida fosforilazione in seguito all‟attivazione recettoriale, conferiscono a Sam68
la capacità di associare con diversi trasduttori intracellulari attraverso interazioni
SH2 e SH3-mediate. Risulta pertanto evidente che il ruolo svolto da Sam68
nell‟oncogenesi va non solo inquadrato nell‟ambito delle sue proprietà funzionali, ma
analizzato anche nel contesto degli eventi cellulari che ne modulano l‟attività.
Per quanto gli studi finora effettuati siano più che sufficienti nell‟accreditare
proprietà oncogeniche alla proteina Sam68, i meccanismi molecolari attraverso i
quali essa promuove la trasformazione neoplastica sono ancora poco conosciuti e
necessitano, quindi, di ulteriori studi.
In questo contesto si inserisce l‟attività di ricerca da me svolta in corso di
dottorato. Al fine di analizzare e caratterizzare più in dettaglio i processi molecolari
attraverso i quali l‟attività di Sam68 è modulata durante la trasduzione di segnali sia
fisiologici che trasformanti, ho principalmente, ma non esclusivamente, utilizzato i
modelli sperimentali sviluppati in questo laboratorio, coinvolto da tempo nella
caratterizzazione dei meccanismi molecolari di trasduzione mediati dal recettore
tirosin-chinasico ALK, le cui varianti oncogeniche, più frequentemente rappresentate
dalla proteina chimerica NPM/ALK, giocano un ruolo centrale nella patogenesi del
89
linfoma anaplastico a grandi cellule (ALCL, Anaplastic Large Cell Lymphoma), un
tipo di linfoma non Hodgkin‟s (NH) di tipo T. In base all‟osservazione che
l‟espressione costitutiva della variante CD44v6 correla con un fenotipo più maligno
dei linfomi NH, ho voluto valutare l‟espressione delle varianti di splicing di CD44
espresse in una linea cellulare umana ottenuta da un caso di ALCL, quale la linea
Karpas299. Esperimenti di PCR esone-specifici hanno indicato presenza delle
varianti CD44v5 e CD44v6 con livelli tra loro simili. Questo mi ha indotto ad
analizzare la possibilità che Sam68 sia coinvolto nella vie di trasduzione mediate da
ALK e possibilmente nella mediazione delle sue proprietà trasformanti. Differenti
esperimenti hanno dimostrato che l‟attività chinasica di ALK è in grado di modulare
la fosforilazione di Sam68 e sono qui riassunti: i) Sam68 risulta fortemente
fosforilata nelle cellule Karpas299 NPM/ALK-positive; ii) la fosforilazione di
Sam68 è anche osservata in un sistema modello che consente la dissezione delle
proprietà enzimatiche di ALK in condizioni di attivazione ligando-inducibili e
rappresentata da una chimera EGFR/ALK, nella quale i domini extracellulari e
transmembrana del recettore ALK sono stati sostituiti con le corrispondenti regioni
del recettore per il fattore di crescita epidermico (EGFR). La validità di questo
sistema modello è stata ampiamente dimostrata: analisi biochimiche e immunoistochimiche hanno, infatti, rivelato che nelle cellule la chimera EGFR/ALK è
correttamente espressa in superficie, dove è in grado di interagire con l‟EGF e
trasdurre all‟interno della cellula un segnale EGF-mediato, ma ALK-specifico. Nei
sistemi cellulari da me analizzati la fosforilazione in tirosina di Sam68 in seguito ad
attivazione di ALK avviene, come atteso, attraverso un meccanismo p60srcdipendente. Di fatto sia l‟inibizione farmacologica di p60src sia l‟impiego di un
mutante di ALK in cui l‟associazione con p60src è completamente abrogata, correlano
con livelli basali di fosforilazione di Sam68, anche quando i lisati cellulari sono
ottenuti da cellule sottoposte a stimolazione con EGF.
Al fine di inibire l‟espressione di Sam68 nelle cellule Karpas299 sono stati
utilizzati diversi shRNA specifici per il gene umano inseriti sia in costrutti plasmidici
che lentivirali. La down-regolazione di Sam68 sulle cellule Karpas299 determina una
drastica inibizione delle capacità migratorie. Meno drammatico, ma sempre
estremamente significativo, l‟effetto della riduzione dell‟espressione di Sam68 sulla
proliferazione cellulare. La soppressione di Sam68 correla inoltre con una
90
diminuzione dei livelli di espressione delle CD44v5, mentre il trascritto della CD44
standard e della CD44v6 rimangono inalterati.
Parte del lavoro di questa tesi si è focalizzato sulla proteina Vav1. I dati da
me prodotti, indicano che l‟attivazione di Vav1 è necessaria per la segnalazione
ALK-mediata sia in fibroblasti che in cellule della linea ematopoietica.. L‟attivazione
di questo recettore comporta reclutamento ed attivazione di p60src. Probabilmente la
stessa attivazione di p60src modula lo stato di fosforilazione, nonché di attivazione, di
Vav1; questo a sua volta, determina l‟attivazione di Rac1.
Vav1 è una proteina con localizzazione prevalentemente citoplasmatica che in
seguito a stimolazione delle cellule ematopoietiche si viene a trovare in prossimità
della membrana plasmatica, ma in alcune condizioni è stata osservata a livello
nucleare. Sulla base di una recente osservazione che ha dimostrato la possibile
interazione in vivo tra Vav1 e Sam68, ho voluto analizzare questa eventualità nei
miei sistemi cellulari. Esperimenti di co-immunoprecipitazione hanno dimostrato
l‟associazione Sam68/Vav1 nelle cellule 32D-NPM/ALK, ma non nelle cellule 32D
parentali suggerendo che tale interazione dipende presumibilmente dalla attività di
NPM/ALK.
E‟ stato anche riportato come l‟associazione intracellulare tra Sam68 e Vav1;
sia mediata dalla regione ricca in prolina P0 di Sam68 ed il dominio SH3 carbossiterminale di Vav1 (Lazer, G. et al., 2007). Basandomi sui dati presenti in letteratura e
sui risultati da me ottenuti, è possibile proporre il seguente modello sperimentale
(Figura 34). In seguito ad attivazione recettoriale, una frazione intracellulare di
Sam68 è reclutata in prossimità della membrana plasmatica dove interagendo con il
dominio SH3 di p60src, ne induce un cambio conformazionale atto a favorirne la sua
completa attivazione come suggerito da Huot .e collaboratori (Huot M. E 2009a).
L‟ attivazione di questa chinasi determina quindi fosforilazione in tirosina di svariati
substrati (come ad esempio PLC-γ; GRB2 e GAP), ivi compresa la stessa Sam68. In
seguito a questa modificazione post-traduzionale, non si esclude che Sam68 possa
interagire con altre contenenti domini SH2. Contemporaneamente Vav1, che in
queste fasi della segnalazione intracellulare si trova in prossimità della membrana
plasmatica dove viene fosforilata da p60src, può interagire tramite il suo dominio SH3
con la regione PO di Sam68. E‟quindi possibile speculare che sia proprio Vav1, una
91
volta completato il suo ruolo di GEF in membrana, a promuovere il trasferimento
della forma fosforilata di Sam68 al nucleo.
Figura34: Modello proposto per il ruolo della’associazione Vav1/Sam68 (p62). A. Sam68 si
associa al dominio SH3 di p60sr, contribuendo alla sua completa attivazione. B. l’attivazione di p60 src
comporta successiva fosforilazione di Sam68. C. Sam68 e Vav1, entrambe substrati di p60 src, si
associan tramite interazione P0-SH3. D. Vav11 si stacca da p60src , e trasportando Sam68 al nucleo.
92
I dati da me ottenuti su Sam68 nell‟ambito della segnalazione ALK mediata,
hanno trovato riscontro anche in cellule di mesotelioma maligno della pleura.
Il Mesotelioma Maligno della Pleura è una neoplasia ad elevata malignità,
difficile trattamento e prognosi infausta. Studi epidemiologici hanno sottolineato il
rapporto esistente tra lo sviluppo di tale neoplasia e l‟esposizione all‟amianto, fibra
minerale conosciuta anche con il nome di asbesto. L‟esposizione non è da
considerarsi esclusivamente di natura occupazionale ma anche ambientale e spesso
familiare, quest‟ultima si realizza generalmente attraversi gli abiti del lavoratore
contaminati dalle fibre di asbesto.
In cellule MM-5 la soppressione dell‟espressione di Sam68 è strettamente
correlata ad una drastica riduzione delle capacità migratorie. In linea con questi dati,
nelle cellule transfettate con il plasmide interferente per Sam68, i livelli di
espressione del trascritto CD44v5 si dimezzano se paragonati a quelli delle cellule
transfettate con un vettore vuoto. L‟espressione di questa isoforma conferisce alle
cellule capacità migratorie ed è riscontrabile durante il movimento delle cellule T e
durante la fase invasiva di molti tumori (Matter, N. et al., 2002).
Un altro dato interessante riguarda il coinvolgimento di Sam68 nella risposta
allo stress genotossico: dopo abolizione dell‟espressione di Sam68 si assiste, infatti,
ad una drastica sensibilizzazione delle cellule al chemioterapico. Tale effetto è
particolarmente evidente nelle cellule Karpas299, dove sono riuscita a silenziare
completamente la proteina Sam68 grazie all‟uso di un vettore lentivirale. Tuttavia,
anche se non così marcato, tale effetto è riscontrabile anche sulle cellule MM-5. Sto
attualmente procedendo con l‟ottimazione del silenzia mento di Sam68 in cellule di
mesotelioma al fine di convalidare ulteriormente il dato.
Il trattamento con cisplatino induce nelle cellule di mesotelioma maligno una
rilocalizzazione di Sam68 dal nucleo al citoplasma. È possibile, quindi, che non solo
Sam68 sia coinvolta nella sopravvivenza delle cellule neoplastiche, ma che una sua
compartimentalizzazione sia fondamentale nella risposta allo stress genotossico e
quindi nello sviluppo di un fenotipo neoplastico resistente ai farmaci chemioterapici.
In conclusione, dal mio lavoro emerge l‟importanza di Sam68 nella
proliferazione e nella sopravvivenza delle cellule neoplastiche. Questa proteina
potrebbe, quindi, essere un ottimo target terapeutico sia per l‟ALCL che per il
mesotelioma maligno della pleura. Ulteriori studi sono comunque necessari allo
93
scopo di delineare i meccanismi molecolari tramite cui Sam68 regola la
proliferazione, la resistenza all‟apoptosi e la migrazione delle cellule neoplastiche.
94
6. BIBLIOGRAFIA.
Aghazadeh B., Lowry W. E., Huang X. Y.and Rosen M. K. (2000) “Structural basis for relief of
autoinhibition of the Dbl homology domain of proto-oncogene Vav by tyrosine phosphorylation.”
Cell. 102:625-633.
Ambrogio, C., Voena, C., Manazza, A.D., Martinengo, C., Costa, C., Kirchhausen, T., Hirsch, E.,
Inghirami, G. and Chiarle, R.( 2008) “The anaplastic lymphoma kinase controls cell shape and growth
of anaplastic large cell lymphoma through Cdc42 activation” Cancer Res. 68(21):8899-907.
Amin, H. M., Medeiros, L. J., Ma, Y., Feretzaki, M., Das, P., Leventaki, V., Rassidakis, G. Z.,
O‟Connor, S. L., McDonnell, T. J. and Lai, R. (2003) “Inhibition of JAK3 induces apoptosis and
decreases anaplastic lymphoma kinase activity in anaplstic large cell lymphoma”. Oncogene 23: 53995407.
Andreotti, A.H., Bunnell, S.C., Feng, S., Berg, L.J. and Schreiber, S.L. (1997) “Regulatory
intramolecular association in a tyrosine kinase of the Tec family” Nature 385 93– 97.
Ardini, E., Magnaghi, P., Orsini, P., Galvani, A. and Menichincheri, M. (2010)"Anaplastic
Lymphoma Kinase: role in specific tumours, and development of small molecule inhibitors for cancer
therapy” Cancer Lett.; 299(2):81-94..
Arning, S., Gruter, P., Bilbe G. and Kramer, A. (1996) “Mammalian splicing factor SF1 is encoded by
variant cDNAs and binds to RNA” RNA 2 794– 810.
Babic, I., Jakymiw, A. and Fujita, D.J. (2004) “The RNA binding protein Sam68 is acetylated in
tumor cell lines, and its acetylation correlates with enhanced RNA binding activity” Oncogene
23:3781–89
Babic, I., Cherry, E. and Fujita, D.J. (2006) “SUMO modification of Sam68 enhances its ability to
repress cyclin D1 expression and inhibits its ability to induce apoptosis” Oncogene 25 4955–4964.
Bacchiocchi, R., Baldanzi, G., Carbonari, D., Capomagi, C., Colombo, E., van Blitterswijk, W. J.,
Graziani, A. and Fazioli, F. (2005) “Activation of alpha-diacylglycerol kinase is critical for the
mitogenic properties of anaplastic lymphoma kinase”. Blood. 106 (6): 2175-2182.
Bai, R. Y., Dieter, P., Peschel, C., Morris, S. W. and Duyster, J. (1998) “Nucleophosmin–Anaplastic
lymphoma kinase of Large–Cell Anaplastic Lymphoma is a constitutively active tyrosine kinase that
utilizes phospholipase–C to mediate its mitogenicity” Mol. Cell. Biol. 18: 6951-6961.
Bai, R. Y., Ouyang, T., Miething, C., Morris, S. W., Peschel, C. and Duyster, J (2000)
“Nucleophosmin–Anaplastic lymphoma kinase associated with anaplstic large-cell lymphoma
activates the phosphatidylinositol 3-kinase / Akt antiapoptotic signaling pathway”. Blood 96: 43194327.
Barbacid M. (1995) “Structural and functional properties of the TRK family of neurotrophin
receptors” Ann NY Acad Sci 766:442-458.
Batsche´, E., Yaniv, M. and Muchardt, C. (2006) “The human SWI/SNF subunit Brm is a regulator of
alternative splicing” Nature Structural & Molecular Biology 13:22–29.
Bazigou, E., Apitz, H., Johansson, J., Lorén, C. E., Hirst, E. M. A., Chen, P-L, Palmer, R. H. and
Salecker, I. (2007) “Anterograde Jelly belly and Alk receptor tyrosine kinese signaling mediates
retinal axon targeting in Drosophila”. Cell 128: 961-975.
Beckmann, G. and Bork, P. (1993) “An adhesive domain detected in functionally diverse receptors”
Trend Biochem Sci 18: 40-41.
95
Bedford, M.T., Frankel, A., Yaffe, M.B., Clarke, S., Leder, P. and Richard, S. (2000) “Arginine
methylation inhibits the binding of proline-rich ligands to Src homology 3, but not WW domains” J.
Biol. Chem. 275:16030– 16036.
BenFredj, N., Grange, J., Sadoul, R., Richard, S., Goldberg, Y. and Boyer, V.(2004) “Depolarizationinduced translocation of the RNA-binding protein Sam68 to the dendrites of hippocampal neurons” J
Cell Sci.117:1079-90.
Benharroch, D., Meguerian-Bedoyan, Z., Lamant, L., Amin, C., Brugieres, L., Terrier-Lacombe, M.J.,
Haralambieva, E., Pulford, K., Pileri, S., Morris, S.W., Mason, D.Y. and Delson G. (1998) “ALKpositive lymphoma: a single disease with a broad spectrum of morphology” Blood 91: 2076-2084.
Beylot-Barry, M., Groppi, A., Vergier, B., Pulford, K. and Merlio, J. P. (1998) “Characterization of
the t(2;5) reciprocal transcripts and genomic breakpoints in CD30+ cutaneous lymphoproliferations”
Blood 91: 4468-4676.
Biamonti, G. and Caceres, J.F. (2009) “Cellular stress and RNA splicing” Trends Biochem Sci 34:146153.
Bielli, P., Busà, R., Paronetto, M.P. and Sette,C. (2011) “The RNA-binding protein Sam68 is a
multifunctional player in human cancer” Endocrine-Rel. Cancer 18:91-102.
Bischof, D., Pulford, K., Mason, D. Y., and Morris, S. W. (1997) “Role of the nucleophosmin (NPM)
portion of the non-Hodgkin‟s lymphoma-associates NPM-ALK fusion protein in oncogenesis” Mol.
Cell. Biol. 17: 2312–2325.
Bitter, M.A., Franklin, W.A., Larson, R.A., McKeithan, T.W., Rubin, C.M., Le Beau, M.M.,
Stephens, J.K. and Vardiman, J.W. (1990) “Morphology in Ki-1 (CD30)-positive non-Hodgkin‟s
lymphoma is correlated with clinical features and the presence of a unique chromosomal abnormality,
t (2;5) (p23;q35).” Am. J Surg Pathol. 14: 305-316.
Black, D.L. (2003) “Mechanisms of alternative pre-messenger RNA splicing” Annual Review of
Biochemistry 72
291–336.
Bolognani, F. and Perrone-Bizzozero, N.I. (2008) “RNA-protein interactions and control of mRNA
stability in neurons” J. Neurosci. Res. 86: 481–489.
Borish, B., Yerly, S., Cerato, Ch.., Schwaller, J., Wacker, P., Ozsahin, A. H., Brousse, N. and Hoessli,
D. C. (2003) “ALK-positive anaplastic large-cell lymphoma: strong T and B anti-tumour responses
may cause hypocellular aspects of lymph nodes mimicking inflammatory lesions” Eur. J. Haemetol.
71: 243-249.
Brais, B., Bouchard, J.P., Xie, Y.G., Rochefort, D.L., Chrétien, N., Tomé, F.M., Lafrenière, R.G.,
Rommens, J.M., Uyama, E., Nohira, O., Blumen, S., Korczyn, A.D., Heutink, P., Mathieu, J.,
Duranceau, A., Codère, F., Fardeau, M. and Rouleau, G.A. (1998) “Short GCG expansions in the
PABP2 gene cause oculopharyngeal muscular dystrophy” Nat Genet. 18(2):164-7
Busa`, R., Paronetto, M.P., Farini, D., Pierantozzi, E., Botti, F., Angelini, D.F., Attisani, F.,
Vespasiani, G. and Sette, C. (2007) “The RNA-binding protein Sam68 contributes to proliferation and
survival of human prostate cancer cells” Oncogene 26:4372–4382.
Busà, R., Geremia, R. and Sette, C. (2010) “Genotoxic stress causes the accumulation of the splicing
regulator Sam68 in nuclear foci of transcriptionally active chromatin” Nucleic Acids Res 36, 9 300518.
Bustelo X. R. (2001) “Vav proteins, adaptors and cell signaling” Oncogene 20: 6372-6381.
96
Carrel, T.L., McWhorter, M.L., Workman, E., Zhang, H., Wolstencroft, E.C., Lorson, C., Bassell,
G.J., Burghes, A.H. and Beattie, C.E. (2006) “Survival motor neuron function in motor axons is
independent of functions required for small nuclear ribonucleoprotein biogenesis” J Neurosci.
25;26(43):11014-22.
Cessna, M.H., Zhou, H., Sanger, W.G., Perkins, S.L., Tripp, S., Pickering, D., Daines, C. and Coffin,
C.M. (2002)“Expression of ALK1 and p80 in inflammatory myofibroblastic tumor and its
mesenchymal mimics: a study of 135 cases” Mod Pathol. 15(9):931-8.
Chan, P. K., Chan, F. Y., Morris, S. W. and Xie, Z. (1997) “Isolation and characterization of the
human nucleophosmin/B23 (NPM) gene: identification of the YY1 binding site at the 5‟ enhancer
region” Nucleic Acids Research 25: 1225-1232.
Chan, J. K. (1998) “Anaplastic large cell limphoma: redefining its morphology spectrum and
importance of recognition of the ALK-positive subset” Advances in Anatomic Pathology 5: 281-313.
Chawla, G., Lin, C.H., Han, A., Shiue, L., Ares, M. Jr and Black, D.L. “2009 Sam68 regulates a set of
alternatively spliced exons during neurogenesis” Molecular and Cellular Biology 29:201–213.
Chen, T., Damaj, B., Herrerra, C., Lasko, P. and Richard, S. (1997) “Self-association of the single-KH
domain family members Sam68, GRP33, GLD-1 and Qk1: role of the KH domain” Mol. Cell. Biol. 17
5707–5718.
Cheng, C. and Sharp, P.A. (2006) “Regulation of CD44 alternative splicing by SRm160 and its
potential role in tumor cell invasion” Molecular and Cellular Biology 26:362–370.
Cheung, N., Chan, L.C., Thompson, A., Cleary, M.L. and So, C.W. (2007) “Protein argininemethyltransferase-dependent oncogenesis” Nature Cell Biology 9:1208–1215.
Chiarle, R., Podda, A., Prolla, Gong, J., Thorbecke, G.J. & Inghirami, G.(1999) “CD30 in normal and
neoplastic cells.” Journal of Applied Biomaterials, 90: 157-164.
Chiarle, R., Simmons, W. J., Cai, H., Dhall, G., Zamo, A., Raz. R., Karras, J. G., Levy, D. E. and
Inghirami, G. (2005) “Stat3 is required for ALK-mediated lymphomagenesis and provides a possible
therapeutic target”. Nature Med. 11: 623-629.
Coppola, J., Bryant, S., Koda, T., Conway, D and Barbacid, M. (1991) “Mechanism of activation of
the vav proto-oncogene”. Cell Growth Differ. 2:95-105.
Cordell, J. L., Pulford, K. A., Bigerna, B., Roncador, G., Banham, A., Colombo, E., Pelicci, P. G.,
Mason, D. Y. and Falini B. (1999) “Detection of normal and chimeric nucleophosmin in human cells”
Blood. 93: 632-642.
Cote´, J., Boisvert, F.-M., Boulanger, M.-C., Bedford, M.T. and Richard, S. (2003) “Sam68 RNA
binding protein is an in vivo substrate for PRMT1” Mol. Biol. Cell 14:274–287.
Cruz-Alvarez, M. and Pellicer, A. (1987) “Cloning of a full-length complementarycDNA for as
Artemia salina glycine-rich protein” J. Biol. Chem. 262: 13377– 13380.
Crespo, P., schebel, K.E., Ostrom, A.A., Gutkind, J.S., Bustelo, X.R. (1997) “ Phosphotyrosinedependent activation of Rac1 GDP/GTP exchange by the vav proto-oncogene product” Nature 385:
169-72.
Cussac, D., Greenland, C., Roche, S., Bai, R. Y., Duyster, J., Morris, S. W., Delson, G., Allouche, M.
And Payrastre, B. (2004)” Nucleophosmin-anaplastic lymphoma kinase of anaplastic large-cell
lymphoma recruits, activates and uses pp60c-src to mediate its mitogenicity”. Blood 103: 1464-1471.
97
Daly, N. L., Scanlon, M. J., Djordjevic, J. T., Kroon, P. A. and Smith R. (1995) “Threedimensional
structure of a cysteine-rich repeat from the low density lipoprotein receptor” Proc Natl Acad Sci USA
92: 6334-6338.
Debelenko, L.V., Raimondi, S.C., Daw, N., Shivakumar, B.R., Huang, D., Nelson, M. and Bridge,
J.A. (2011)"Renal cell carcinoma with novel VCL-ALK fusion: new representative of ALKassociated tumor spectrum” Mod Pathol. Mar;24(3):430-42.
Derry, J.J., Richard, S., Carvajal, H.V., Ye, X., Vasioukhin, V., Cochrane, A.W., Chen, T. and Tyner,
A.L. (2000) “Sik (BRK) phosphorylates Sam68 in the nucleus and negatively regulates its RNA
binding activity” Mol. Cell. Biol. 20:6114– 6126.
Di Fruscio, M., Chen, T., Bonyadi, P., Lasko, P. and Richard, S. (1998) “The identification of two
Drosophila KH domain protein: KEP1 and SAM are members of the Sam68 family of GSG domain
proteins” J.Biol.Chem 273: 30122-130.
Dirks, W.G., Fähnrich, S., Lis, Y., Becker, E., MacLeod, R.A., Drexler, H.G. (2002) "Expression and
functional analysis of the anaplastic lymphoma kinase (ALK) gene in tumor cell lines.” Int J Cancer.
100(1):49-56.
Du, X. L., Hu, H., Lin, D. C., Xia, S. H., Shen, X. M., Zhang, Y., Luo, M. L., Feng, Y. B., Cai, Y.,
Xu, X., Han, Y. L., Zhan, Q. M. and Wang, M. R. (2007) “Proteomic profiling of proteins dysregulted
in Chinese esophageal squamous cell carcinoma”. J Mol Med. 85: 863-875.
Ellis, C., Moran, M., McCormick, F. and Pawson, T. (1990) “Phosphorylation of GAP and GAPassociated proteins by transforming and mitogenic tyrosine kinase” Nature 343: 377–380.
Englud, C., Loren, C. E., Grabbe, C., Deleuil, F., Varshney, G. K. and Palmer, R. H. (2003) “Jeb
signals via the Dalk receptor tyrosine kinase to drive visceral muscle fusion”. Nature 425: 512-516.
Espejo, A., Coˆte´, J., Bednarek, A., Richard, S. and Bedford, M.T. (2002) “A protein-domain
microarray identifies novel protein – protein interactions” Biochem. J. 367:697– 702.
Falini, B., Pileri, S., Zinzani, P. L., Carbone, A., Zagonel, V., Woolf-Peeters, C., Verhoef, G.,
Menestrina, F., Todeschini, G., Paulli, M., Lazzarino, M., Giardini, R., Aiello, A., Foss, H. D.,
Araujo, I., Fizzotti, M., Pellicci, P. G., Flenghi, L., Martello, M. F. and Santucci, A. (1999) “ALK+
lymphoma: clinico- pathological findings and outcome”. Blood 93: 2697-2706.
Falini, B. (2001) “Anaplastic large cell lymphoma: Pathological, molecular andclinical features”. Br.
J. Haematol. 114: 741-760.
Fantl J. E, Johnson, D. E and Williams, L. T. (1993) “Signaling by receptor tyrosine kinases” Annu
Rev Biochem 62: 453-481.
Fass, D., Blacklow, S., Kim, P. S. and Berger, J. S. (1997) “Molecular basis of familial
hypercholesterolemia from structure of LDL receptor module”. Nature 388: 691-693.
Fazioli, F., Wong, W. T., Segatto, O. and Di Fiore P. P.: (1993) " Mechanism of mitogenic signal
transduction by EGFR and erbB-2." in De Bellis, A. and Marschke, K. B. (eds.): New perspectives in
Endocrinology. New York, Raven Press. Vol. 99: 249-261.
Fernandez-Zapico, M.E., Gonzalez-Paz, N.C., Weiss, E., Savoy, D.N., Molina, J.R., Fonseca, R.,
Smyrk, T.C., Chari, S.T., Urrutia, R., Billadeau, D.D. (2005) “Ectopic expression of VAV1 reveals an
unexpected role in pancreatic cancer tumorigenesis” Cancer Cell. 7(1):39-49.
Fung, E.T., Lanahan, A., Worley, P.and Huganir, R.L. (1998) “Identification of a Torpedo homolog of
Sam68 that interacts with the synapse organizing protein rapsyn” FEBS Lett. 437:29–33.
Fujimoto, J., Shiota, M., Iwahara, T., Seki, N., Sato, H., Mori, S. and Yamamoto, T. (1996)
“Characterization of the transforming activity of 121 p80, a hyperphosphorylated protein in a Ki-1
98
lymphoma cell line with chromosomal translocation t(2;5)”. Proc. Natl. Acad. Sci. USA 93: 4181–
4186.
Fumagalli, S., Totty, N.F., Hsuan, J.J. and Courtneidge, S.A. (1994) “A target for Src in mitosis”
Nature 368:871– 874.
Gabut, M., Chaudhry, S. and Blencowe, B.J. (2008) “SnapShot: The splicing regulatory machinery”
Cell. 4;133(1):192.e1
Gary, J.D. and Clarke, S. (1998) “RNA and protein interactions modulated by protein arginine
methylation” Prog. Nucleic Acid Res. Mol. Biol. 61:65–131.
Gascoyne, R. D., Aoun, P., Wu, D., Chhanabhai, M., Skinnider, B. F., Greiner, T. C., Morris, S. W.,
Connors, J. M., Viswanatha, D. S., Coldman, A. and Weisenburger, D. D. (1999) “Prognostic
significance of anaplastic lymphoma kinase (ALK) protein expression in adults with anaplastic large
cell lymphoma” Blood 93: 3913- 3921.
Garber, K.B., Visootsak, J. and Warren ST (2008) “Fragile X syndrome”. Eur J Hum Genet.
16(6):666-72.
Gaudino G, Follenzi A, Naldini L, Collesi C, Santoro M, Gallo KA, Godowski PJ, Comoglio PM.
(1994) “RON is a heterodimeric tyrosine kinase receptor activated by the HGF homologue MSP”
EMBO J 13: 3524-3532.
George, R.E., Sanda, T., Hanna, M., Fröhling, S., Luther, W., Zhang, J., Ahn, Y., Zhou, W., London,
W.B., McGrady, P., Xue, L., Zozulya, S., Gregor, V.E., Webb, T.R., Gray, N.S., Gilliland, D.G.,
Diller, L., Greulich, H., Morris, S.W., Meyerson, M. and Look, A.T. (2008) “Activating mutations in
ALK provide a therapeutic target in neuroblastoma” Nature 455(7215):975-8.
Glisovic, T., Bachorik, J.L., Yong, J. and Dreyfuss, G (2008) “RNA-binding proteins and posttranscriptional gene regulation” FEBS Lett. 18;582(14):1977-86.
Gorla, L., Cantu`, M., Micciche`, F., Patelli, C., Mondellini, P., Pierotti, M.A. and Bongarzone, I.
(2006) “RET oncoproteinsinduce tyrosine phosphorylation changes of proteins involved in RNA
metabolism” Cellular Signalling 18:2272–2282.
Grange, J., Boyer, V., Fabian-Fine, R., Fredj, N.B., Sadoul, R. and Goldberg, Y.(2004)
“Somatodendritic localization andmRNA association of the splicing regulatory protein Sam68 in the
hippocampus and cortex” Journal of Neuroscience Research 75:654–666.
Grossman, J.S., Meyer, M.I., Wang, Y.C., Mulligan, G.J., Kobayashi, R. and Helfman, D.M. (1998)
“The use of antibodies to the polypyrimidine tract binding protein (PTB) to analyze the protein
components that assemble on alternatively spliced pre-mRNAs that use distant branch points” RNA 4
613–625.
Han, J., Das. B., Wei, W., et al.,(1997) “Lck regulates Vav activation of members of the Rho family
of GTPas” Mol.Cell.Biol. 17:46-53.
Harper, J.W., Adami, G.R., Wei, N., Komarsi, K. and Ldge, S:J (1993) “The p21 CDK-interacting
protein CIP 1 is a potent inhibitor of G1 cycling-dependent kinases”. Cell 75: 815-15.
Henske, E.P., short, M.P., Jozwiak S. et al., (1995) “Identification of Vav2 on 9q34 and its exclusion
as the tuberous sclerosis gene TSC1 59:25-37.
Harris N. L., Jaffe, E. S., Stein, H., Banks, P. M., Chan, J. K. C., Cleary, M. L., Delsol, G., De Wolf–
Peeters,C., Falini, B., Gatter, K. C., Grogan, T. M., Isaacson, P. G. Knowles, D. M., Mason, D. Y.,
Muller–Hermelink, H. K., Pileri, S. A., Piris, M. A., Rslfkiaer, E. and Warnke, R. A. (1994) “A
revised European–American Classification of lymphoid neoplasm: a proposal from the International
Lymphoma Study Group” Blood 84: 1361
99
Hong, W., Resnick, R.J., Rakowski, C., Shalloway, D., Taylor, S.J. and Blobel, G.A. (2002) “Physical
and functional interaction between the transcriptional domain family members Sam68, GRP33, GLD1, cofactor CBP and the KH domain protein Sam68” Molecular Cancer Research 1:48–55.
Huff JL, Jelinek MA, Borgman CA, Lansing TJ, Parsons JT. (1993) “The protooncogene c-sea
encodes a transmembrane protein-tyrosine kinase related to the Met/hepatocyte growth factor/scatter
factor receptor” Proc Natl Acad Sci USA 90: 6140-6144.
Huot, M.E., Brown, C.M., Lamarche-Vane, N. and Richard, S. (2009)a “An adaptor role for
cytoplasmic Sam68 in modulating Src activity during cell polarization” Molecular and Cellular
Biology 29:1933–1943.
Huot, M.E., Vogel, G. and Richard, S. (2009)b “Identification of a Sam68 ribonucleoprotein complex
regulated by epidermal growth factor” Journal of Biological Chemistry 284 31903–31913.
Ishidate, T., Yoshihara, S., Kawasaki, Y., Roy, B.C., Toyoshima, K., Akiyama, T. (1997)
“Identification of a novel nuclear localization signal in Sam68” FEBS Lett. 409:237– 241.
Iwahashi, C.K., Yasui, D.H., An, H.J., Greco, C.M., Tassone, F., Nannen, K., Babineau, B., Lebrilla,
C.B., Hagerman, R.J. and Hagerman, P.J. (2006) “ Protein composition of the intranuclear inclusions
of FXTAS” Brain. 129(Pt 1):256-71
Iwahara, T., Fujimoto, J., Wen, D., Cupples, R., Bucay, N., Arakawa, T., Mori, S., Ratzkin, B. and
Yamamoto, T. (1997) “Molecular characterization of ALK, a receptor tyrosine kinase expressed
specifically in the nervous system”. Oncogene 14: 439-449.
Jaffe, E. S., Harris, N. L., Stein, H. and Vardiman, J. W. (2001) “World Health Organization
Classification of Tumors: Tumors of the Haematopoietic and Lymphoid Tissue”. International
Agency for Research on Cancer, Lyon
Jan, E., Motzny, C.K., Graves, L.E. and Goodwin, E.B. (1999) “The STAR protein GLD-1, is a
translational regulator of sexual identity in Caenorhabditiselegans” EMBO J. 18 258– 269.
Jazii, F. R., Najafi, Z., Malekzadeh, R., Conrads, T. P., Ziaee, A. A., Abnet, C., Yazdznbod, M.,
Karkhane, A. A. and Salekdeh, G. H. (2006) “Identification of squamous cell carcinoma associated
proteins by proteomics and loss of beta tropomyosin expression in esophageal cancer”. World J.
Gastroenterol. 12:7104-12
Kadin, M.E. and Morris, S.W. “The t(2;5) in human lymphomas(1998) “Leuk Lymphoma. 29(34):249-56.
Kadin, M.E. (1997) “Anaplastic large cell limphoma and its morphological variants.” Cancer Surveys
30: 77-86.
Kanadia, R.N., Shin, J., Yuan, Y., Beattie, S.G., Wheeler, T.M., Thornton, C.A. and Swanson, M.S.
(2006) “Reversal of RNA missplicing and myotonia after muscleblind overexpression in a mouse
poly(CUG) model for myotonic dystrophy” Proc Natl Acad Sci U S A. 103(31):11748-53.
Kaneko, Y., Frizzera, G., Edamura, S., Maseki, N., Sakurai, M., Komada, Y., Tanaka, H., Sasaki, M.,
Suchi, T., Kikuta, A., Wasaka, H., Hojo, H. andMizutani, S. (1989) “A novel traslocation,
t(2;5)(p23;q35), in childhood phagocytic large T–cell lymphoma mimicking malignant histiocytosis”
Blood 73: 806–813.
Karni, R., deStanchina, E., Lowe, S.W., Sinha, R., Mu, D. and Krainer, A.R. (2007) “The gene
encoding the splicing factor SF2/ASF is a proto-oncogene” Nat Struct Mol Biol. 14(3):185-93.
Katzav, S., Martin-Zanca, D., Barbacid, M. (1989) “vav, a novel human oncogene derived from a
locus ubiquitously expressed in hematopoietic cells. EMBO J. 8(8):2283-90.
100
Katzav, S., Cleveland, J. L., Heslop, H. E. and Pulido, D. (1991) “Loss of the aminoterminal helixloop-helix domain of the vav proto-oncogene avtivates its trasforming potential”. Mol Cell. Biol.
1912-1920.
Kawachi, H., Fujikawa, A., Maeda, N. and Noda, M. (2001) “Identification og GIT1/Cat-1 as a
substrate molecule of protein tyrosine phospatase zeta/beta by the yeast substrate-trapping system”.
Proc. Natl. Acad. Sci. USA 98: 6593-6598.
Keene, J.D. (2007) “RNA regulons: coordination of post-transcriptional events” Nat. Rev. Genet. 8,
533–543
Kinney, M.C. & Kadin, M.E. (1999) “The pathologic and clinical spectrum of anaplastic large cell
limphoma and correlation with ALK gene dysregulation.” American Journal of Clinical Pathology
111: S56-S67.
Knudsen, K.E. (2006) “ The cyclin D1b splice variant: an old oncogene learns new tricks” Cell
Division 1:15.
Kuefer, M. U., Look, A. T., Pulford, K., Behm, F. G., Pattengale, P. K., Mason, D. Y. and Morris, S.
W. (1997) “Retrovirus–mediated gene transfer of NPM–ALK causes lymphoid malignancy in mice”.
Blood 90: 2901–2910.
Ladanyi, M. and Cavalchire, G. (1996) “Detection of the NPM-ALK genomic rearrangement of Ki-1
lymphoma and isolation of the involved NPM and ALK introns”. Diagn Mol Pathol. 5: 154-158.
Laggerbauer, B., Ostareck, D., Keidel, E.M., Ostareck-Lederer, A. and Fischer, U. (2001) “Evidence
that fragile-x mental retardation protein is a negative regulator of translation “Hum Mol Genet.
10(4):329-38.
Lamant, L., Pulford, K., Bishof, D., Morris, S. W., Mason, D. Y., Delson, G. and Mariame B. (2000)
“Expression of the ALK tyrosine kinase gene in neuroblastoma”. Am J Pathol 156: 1711-1721.
Lane, J., Martin, T.A, Mansel, R.E. and Jiang, W.G. (2008) “The expression and prognostic value of
the guanine nucleotide exchange factors (GEFs) Trio, Vav1 and TIAM-1 in human breast cancer”
International Seminars in Surgical Oncology, 5:23
Lang, V., Mege, D., Semichon, M., Gary-Gouy, H. and Bismuth, G.A. (1997) “A dual participation of
ZAP-70 and src protein tyrosine kinases is required for TCR-induced tyrosine phosphorylation of
Sam68 in Jurkat T cells” Eur. J. Immunol. 27: 3360– 3367.
Lawe, D.C., Hahn, C. and Wong, A.J. (1997) “The Nck SH2/SH3 adaptor protein is present in the
nucleus with the nuclear protein Sam68” Oncogenes 14 223– 231.
Lazer, G., Pe'er, L., Schapira, V., Richard, S. and Katzav S. (2007) “The association of Sam68 with
Vav1 contributes to tumorigenesis” Cell Signal. (12):2479-86.
Lazer, G., Idelchuk, Y., Schapira, V., Pikarsky, E. and Katzav S. (2009) “The haematopoietic specific
signal transducer Vav1 is aberrantly expressed in lung cancer and plays a role in tumourigenesis.” J
Pathol. 219(1):25-34.
Le Beau, M. M., Bitter, M. A., Larson, R. A., Donate, L. A., Ellis, E. D., Franklin, S. A., Rubin, C.
M., Kadin, M. E .and Vardiman, J. W. (1989) “The t(2;5)(p23;q35): a recurring chromosomal
abnormality in Ki–1–positive anaplastic large cell lymphoma“ Leukemia 3: 866–870.
Li, Z., Zhang, Y., Ku, L., Wilkinson, K.D., Warren, S.T. and Feng, Y. (2001) “The fragile X mental
retardation protein inhibits translation via interacting with mRNA” Nucleic Acids Res. 29(11):227683.
Li, X.Q., Hisaoka, M., Shi, D.R., Zhu, X.Z. and Hashimoto, H. (2004) "Expression of anaplastic
lymphoma kinase in soft tissue tumors: an immunohistochemical and molecular study of 249 cases.”
Hum Pathol. 35(6):711-21.
101
Lin, E., Li, L., Guan, Y., Soriano, R., Rivers, C.S., Mohan, S., Pandita, A., Tang, J. and Modrusan, Z.
(2009)"Exon array profiling detects EML4-ALK fusion in breast, colorectal, and non-small cell lung
cancers”. Mol Cancer Res. 7(9):1466-76.
Liu, K., Li, L., Nisson, P.E., Gruber, C., Jessee, J. and Cohen, S.N. (2000) “Neoplastic transformation
and tumorigenesis associated with sam68 protein deficiency in cultured murine fibroblasts” Journal of
Biological Chemistry 275:40195–40201.
Lonardo, F., Di Marco, E., King, C. R., Pierce, J. H., Segatto, O., Aaronson, S. A. and Di Fiore, P. P.
(1990) “The normal erbB–2 product is an atypical receptor–like tyrosine kinase with constitutive
activity in the absence of ligand” The New Biol. 2:992–1003.
Loren, C. E., Scully, A., Grabbe, C., Edeen, P. T., Thomas, J., McKeown, M., Hunter, T. and Palmer,
R. H. (2001) “Identification and characterization of Dalk: A novel Drosophila Melanogaster RTK
which drive ERK activation in vivo”. Genes Cells 6: 531-544.
Lukong, K.E. and Richard, S. (2003) “Sam68, the KH domaincontaining superSTAR" Biochimica et
Biophysica Acta 1653 73–86.
Lukong ,K.E., Larocque, D., Tyner, A.L. and Richard, S. (2005) “Tyrosine phosphorylation of sam68
by breast tumor kinase regulates intranuclear localization and cell cycle progression” Journal of
Biological Chemistry 280:38639–38647.
Lukong, K.E. and Richard, S. (2008) “Motor coordination defects in mice deficient for the Sam68
RNA-binding protein” Behavioral Brain Research 189 357–363.
Lunde, B.M., Moore, C. and Varani, G. (2007) “ RNA-binding proteins: modular design for efficient
function” Nat Rev Mol Cell Biol. 8(6):479-90
Luthra, R., Pugh, W. C., Waasdorp, M., Morris, S. W., Cabanillas, F., Chan, P. K. and Sarris, A.H.
(1998) “Mapping of genomic t(2;5)(p23;q35) break points in patients with anaplastic large cell
lymphoma by sequencing long-range PCR products”. Hematopathol Mol Hematol. 11: 173-183.
Ma, Z., Cools, J., Marynen, P., Cui, X., Siebert, R., Gesk, S., Schlegelberger, B., Peeters, B., De
Wolf-Peeters, C., Wlodarska, I. and Morris, S. W. (2000) “Inv (2)(p23q35) in anaplastic large-cell
lymphoma induces constitutive anaplastic lymphoma kinase (ALK) tyrosine kinase activation by
fusion to ATIC, an enzyme involved in purine nucleotide biosynthesis”. Blood. 95: 2144-2149.
Maa, M.-C., Leu, T.-H., Trandel, B.J., Chang, J.-H. and Parsons, S.J. (1994) “A protein that is related
to GTPase activating protein-associated p62 complexes with phospholipase Cg” Mol. Cell. Biol. 14:
5466–5473.
Mason, D. Y., Bastard, C., Rimokh, R., Dastague, N., Huret, J. L., Kristoffersson, U., Magaud, J. P.,
Nezelhof, C. , Tilly, H. , Vannier, J. P. , Hemet, J., Warnke, R. (1990) “CD30-positive large cell
lymphomas („Ki-1 lymphoma‟) are associated with a chromosomal translocation involving 5q35”
Bri.t J. Haematol. 74: 161–168.
Mason, D. Y., Pulford, K. A., Bischof, D., Kuefer, M. U., Butler, L. H., Lamant, L., Delson, G. and
Morris, S. W. (1998) “ Nucleolar localization of the nucleophosmin-anaplastic lymphoma kinase is
not required for malignant transformation”. Cancer Res. 58: 1057-1062.
Matter, N., Herrlich, P. and Konig, H. (2002) “Signal-dependent regulation of splicing via
phosphorylation of Sam68” Nature 420:691–695.
Marzec, M., Kasprzycka, M., Ptasznik, A., Wlodarski, P., Zhang, Q., Odum, N. And Wasik, M. A.
(2005) “Inhibition of ALK enzymatic activity in T-cell lymphoma cells induces apoptosis and
suppresses proliferation and STAT3 phosphorylation independently of Jak3” Lab. Invest. 85: 15441554.
102
Mazroui, R., Huot, M.E., Tremblay, S., Filion, C., Labelle, Y., Khandjian, E.W. (2002) “Trapping of
messenger RNA by Fragile X Mental Retardation protein into cytoplasmic granules induces
translation repression” Hum Mol Genet. 11(24):3007-17.
McBride, A.E., Taylor, S.J., Shalloway, D. and Kirkegaard, K. (1998) “KH domain integrity is
required for wild-type localization of Sam68” Exp Cell Res.25;241(1):84-95.
McDermott, U., Iafrate, A.J., Gray, N.S., Shioda, T., Classon, M., Maheswaran, S., Zhou, W., Choi,
H.G., Smith, S.L., Dowell, L., Ulkus, L.E., Kuhlmann, G., Greninger, P., Christensen, J.G., Haber,
D.A. and Settleman, J. (2008) “Genomic alterations of anaplastic lymphoma kinase may sensitize
tumors to anaplastic lymphoma kinase inhibitors.” Cancer Res 68(9):3389-95.
Meng, K., Rodriguez-Pena, A., Dimitrov, T., Chen, W., Yamin, M., Noda, M., Deuel, T. F. (2000)
“Pleiotrophin signals increased tyrosine phosphorylation of beta-catenin through inactivation of the
intrinsic catalytic activity of the receptor-type protein tyrosine phosphatase beta/zeta”. Proc Natl Acad
Sci USA 97: 2603–2608.
Mercatante, D.R., Mohler, J.L. and Kole, R. (2002) “Cellular response to an antisense-mediated shift
of Bcl-x pre-mRNA splicing and antineoplastic agents” Journal of Biological Chemistry 277:49374–
49382.
Mezquita, J., Pau, M. and Mezquita, C. (1998) “Four isoforms of the signal-transductionand RNAbinding protein Qk1 expressed during chicken spermatogenesis” Mol. Reprod. Dev. 50 70– 78.
Miyake, I., Hakomori, Y., Shinohara, A., Gamout, T., Saito, M., Iwamatsu, A. and Sakai, R. (2002)
“Activation of anaplastic lymphoma kinase is responsible for hyperphosphorylation of ShcC in
neuroblastoma cell lines”. Oncogene 21: 5823-5834.
Moog-Lutz, C., Degoutin, J., Gouzi, J. Y., Frobert, Y., Brunet-se Carvalho, N., bureau, J., Creminon,
C. and Vigny, M. (2005) “ Activation and inhibition of anaplastic lymphoma kinase receptor tyrosine
kinase by monoclonal antibodies and absence of agonist activity of pleiotrophin”. J. Biol. Chem. 280:
26039: 26048.
Morris, S. W., Kirstein, M. N., Valentine, M. B., Dittemer, K. G., Shapiro, D. N., Saltman, D. L. and
Look, A. T. (1994) “Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, in nonHodgkin‟s lymphoma” Science 263: 1281-1284
Morris, S. W., Xue, L., Ma, Z. and Kinney M. C. (2001) “ALK + CD30+ lymphomas: a distinct
molecular genetic subtype of non–hodgkin‟s lymphoma” Br. J. Haematol 113: 275-295.
Mossé, Y.P., Laudenslager, M., Longo, L., Cole, K.A., Wood, A., Attiyeh, E.F., Laquaglia, M.J.,
Sennett, R., Lynch, J.E., Perri, P., Laureys, G., Speleman, F., Kim, C., Hou, C., Hakonarson, H.,
Torkamani, A., Schork, N.J., Brodeur, G.M., Tonini, G.P., Rappaport, E., Devoto, M. and Maris, J.M.
(2008)“Identification of ALK as a major familial neuroblastoma predisposition gene.” Nature
455(7215):930-5.
Motegi, A., Fujimoto, J., Kotani, M., Sakuraba, H. and Yamamoto, T. (2004) “ALK receptor tyrosine
kinase promotes cell growth and neurite outgrowth”. J. Cell Sci. 117: 3319-3329.
Movilla, N., Bustelo, X.R. “Biological and regulatory properties of Vav-3, a new member of the Vav
family of oncoproteins”. (1999) Mol.Cell.Biol. 19: 1879:1885.
Movilla N., Dosil M., Zheng Y. and Bustelo X. R. (2001) “How Vav proteins discriminate the
GTPases Rac1 and RhoA from Cdc42”. Oncogene 20: 8057-8065.
Mulligan, R. C. and Berg, P. (1981) “Selection for animal cells that express the E. Coli gene coding
for xanthine–guanine phosphonbosyltrasferase” Proc. Natl. Acad. Sci. USA 78: 2072–2076.
Nakamura, S., Shiota, M., Nakagawa, A., Yatabe, Y., Kojima, M., Motoori, T., Suzuki, R., Kagami,
Y., Ogura, M., Morishima, Y., Mizoguchi, Y., Okamoto, M., Seto, M., Koshikawa, T., Mori, S.,
103
Suchi, T. (1997) “Anaplastic large cell lymphoma: A distinct molecular pathologicentity: A
reappraisal with special reference to p80(NPM/ALK)expression” Am J Surg Pathol 21: 1420–1432.
Najib, S. and Sanchez-Margalet, V. (2002) “Sam68 associates with the SH3 domains of Grb2
recruiting GAP to the Grb2-SOS complex in insulin receptor signaling” J. Cell. Biochem. 86: 99–106.
Najib, S., Martın-Romero, C., Gonzalez-Yanes, C. and Sanchez-Margalet, V. (2005) “Role of Sam68
as an adaptor protein in signal transduction” Cellular and Molecular Life Sciences 62:36–43.
Ostrander, J.H., Daniel, A.R. and Lange, C.A. (2010) “Brk/PTK6 signaling in normal and cancer cell
models” Current Opinion in Pharmacology 10:662–669.
Paez JG, Jänne PA, Lee JC, Tracy S, Greulich H, Gabriel S, Herman P, Kaye FJ, Lindeman N,
Boggon TJ, Naoki K, Sasaki H, Fujii Y, Eck MJ, Sellers WR, Johnson BE, Meyerson M. (2004)
"EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy” Science
304(5676):1497-500.
Pariser, H., Ezquerra, L., Herradon, G., Perez-Pinera, P. and Deuel, T. F. (2005a) “Fyn is a
downstream target of the pleiotrophin/receptor protein tyrosine phsphatase beta/zeta-signaling
pathway: regulation of tyrosine phosphorylation of Fyn by pleiotrophin”. Biochem.Biophys. Res
Commun. 332(3): 664-669.
Pariser, H., Herradon, G., Ezquerra, L., Perez-Pinera, P. and Deuel, T. F. (2005b) “Pleiotrophin
regulates serine phosphorylation and the cellular distribution of beta-adducin through activation of
protein kinase C”. Proc. Natl. Acad. Sci. U.S.A. 102(35): 12407-12412.
Pariser, H., Perez-Pinera, P., Herradon, G., Ezquerra, L., and Deuel, T. F. (2005c) “Pleiotrophin
stimulates tyrosine phosphorylation of beta-adducin through inactivation of the transmembrane
receptor protein tyrosine phosphatase beta/zeta”. Biochem.Biophys. Res Commun. 335(1) :232-239.
Paronetto, M.P., Venables, J.P., Elliott, D.J., Geremia, R., Rossi, P. and Sette, C. (2003) “Tr-kit
promotes the formation of a multimolecular complex composed by Fyn, PLCgamma1 and Sam68”
Oncogene 22 8707–8715.
Paronetto, M.P., Farini, D., Sammarco, I., Maturo, G., Vespasiani, G., Geremia, R., Rossi, P. and
Sette, C. (2004) “Expression of a truncated form of the c-Kit tyrosine kinase receptor and activation of
Src kinase in human prostatic cancer”American Journal of Pathology 164 1243–1251.
Paronetto, M.P., Zalfa, F., Botti, F., Geremia, R., Bagni, C. and Sette, C. (2006) “The nuclear RNAbinding protein Sam68 translocates to the cytoplasm and associates with the polysomes in mouse
spermatocytes” Molecular Biology of the Cell 17:14–24.
Paronetto, M.P., Achsel, T., Massiello, A., Chalfant, C.E. and Sette, C. (2007) “The RNA-binding
protein Sam68 modulates the alternative splicing of Bcl-x” Journal of Cell Biology 176:929–939.
Paronetto, M.P., Messina, V., Bianchi, E., Barchi, M., Vogel, G., Moretti, C., Palombi, F., Stefanini,
M., Geremia, R., Richard, S. and Sette, C. (2009) “Sam68 regulates translation of target mRNAs in
male germ cells, necessary for mouse spermatogenesis” Journal of Cell Biology 85:235–249.
Paronetto, M.P., Cappellari, M., Busa`, R., Pedrotti, S., Vitali, R., Comstock, C., Hyslop, T., Knudsen,
K.E. and Sette, C. (2010) “Alternative splicing of the cyclin D1 proto-oncogene is regulated by the
RNA-binding protein Sam68” Cancer Research 70:229–239.
Passoni, L., Scardino, A., Bertazzoli, C., Gallo, B., Cosuccia, A.M., Lemonnier, F.A., Kosmatopoulos,
K. and Gambacorti-Passerini, C. (2002) “ALK as a novel lymphoma-associated tumor antigen:
Identification of 2 HLAA2.1- restricted CD8+ T-cell epitopes” Blood 99: 2100–2106.
Passoni, L., Longo, L., Collini, P., Coluccia, A.M., Bozzi, F., Podda, M., Gregorio, A., Gambini, C.,
Garaventa, A., Pistoia, V., Del Grosso, F., Tonini, G.P., Cheng, M., Gambacorti-Passerini, C.,
104
Anichini, A., Fossati-Bellani, F., Di Nicola, M. and Luksch, R. (2009) “Mutation-independent
anaplastic lymphoma kinase overexpression in poor prognosis neuroblastoma patients.” Cancer
Res69(18):7338-46.
Pedrotti, S. and Sette, C. (2010) “Spinal muscular atrophy: a new player joins the battle for SMN2
exon 7 splicing” Cell Cycle 9:3874–3879.
Pelisch, F., Gerez, J., Druker, J., Schor, I.E., Munoz, M.J., Risso, G., Petrillo, E., Westman, B.J.,
Lamond, A.I., Arzt, E. and Srebrow, A. (2010) “The serine/arginine-rich protein SF2/ASF regulates
protein sumoylation” PNAS 107:16119–16124.
Perez-Pinera, P., Chang, Y., Austudillo,A., Mortimer, J. and Deuel, T. F. (2007) “Anaplastic
lymphoma kinase is expressed in different subtypes of human breast cancer”. Biochem. Biophys. Res.
Commun. 358: 399-403.
Piccinini, G., Bacchiocchi, R., Serresi, M., Vivani, C., Rossetti, S., Gennaretti, C., Carbonari, D. and
Fazioli, F. (2002) “A ligand–inducible epidermal growth factor receptor/anaplastic lymphoma kinase
chimera promotes mitogenesis and transforming properties in 3T3 cells”. J. Biol. Chem. 277: 95269531.
Pierce, J. H., Ruggiero, M., Flemming, T. P., Di Fiore, P. P., Greenberger, J. S., Varticovski, L.,
Schlessinger, J., Rovera, G. and Aaronson, S. A. (1988) “Signal transduction through the EGF
Receptor transfected in IL-3-dependent haematopoietic cells”. Science 239: 628-631.
Pillay, K., Govender, D., and Chetty, R. (2002) “ALK protein expression in rhabdomyosarcomas”.
Histopathology 41: 461-467.
Piva, R., Pellegrino, E., Mattioli, M., Agnelli, L., Lombardi, L., Boccalatte, F., Costa, G., Ruggeri, B.
A., Cheng, M., Chiarle, R., Palestro, G., Neri, A. ang Inghirami, G. (2006) “Functional validation of
the anaplastic lymphoma kinase signature identifies CEBPB and BCL2A1 as critical target genes”. J.
Clin. Invest. 116: 3171-3182.
Powers, C., Aigner, A., Stoica, G. E., McDonnell, K. And Wellstein, A. (2002) “Pleiotrophin
signaling through anaplastic lymphoma kinase is rate-limiting for glioblastoma growth”. J. Biol.
Chem. 277: 14153-14158.
Pulford, K., Lamant, L., Morris, S. W., Butler, L. H., Wood, K. M., Stroud, D., Delsol, G. and Mason,
D. Y. (1997) “Detection of anaplastic lymphoma kinase (ALK) and nucleolar protein nucleophosmin
(NPM)-ALK proteins in normal and neoplastic cells with the monoclonal antibody ALK1”. Blood 89:
1394–1404.
Pulford, K., Falini, B., Cordell, J., Rosenwald, A., Ott, G., Muller-Hermelink, H.K., MacLennan, K.
A., Lamant, L., Carbone, A., Campo, E. and Mason, D. Y. (1999) “Biochemical detection of novel
anaplastic limphoma kinase proteins in tissue sections of anaplastic large cell limphoma”. American
Journal of Pathology 154: 1657-1663.
Pulford, K., Morris, S. W. and Turturro, F. (2004) “Anaplastic lymphoma kinase proteins in growth
control and cancer”. Journal of cellular Physiology 199: 330- 358.
Richard, S., Yu, D., Blumer, K.J., Hausladen, D., Olszowy, M.W., Connelly, P.A. and Shaw, A.S.
(1995) “Association of p62, a multi-functional SH2-and SH3-binding protein, with src-family tyrosine
kinases, Grb2, and phospholipase Cg-1” Mol. Cell. Biol. 15:186– 197.
Richard, S., Torabi, N., Franco, G.V., Tremblay, G.A., Chen, T., Vogel, G., Morel, M., Cléroux, P.,
Forget-Richard, A., Komarova, S., Tremblay, M.L., Li, W., Li, A., Gao, Y.J. and Henderson, J.E.
(2005) “Ablation of the Sam68 RNA binding protein protects mice from age-related bone loss” PLoS
Genet 1(6):e74
105
Riggi, N., Cironi, L., Suvà, M.L. and Stamenkovic, I. (2007) “Sarcomas: genetics, signalling, and
cellular origins. Part 1: The fellowship of TET” J Pathol. 213(1):4-20.
Rimokh, R., Magaud, J. P., Berger, F., Samarut, J., Coiffier, B., Germain, D. and Mason, D. Y. (1989)
“A traslocation involving a specific breakpoint (q35) on chromosome 5 is characteristic of anaplastic
large cell lymphoma (ki–1 limphoma)” British J. Haematol. 71: 31–36.
Rosenberger, S., De-Castro Arce, J., Langbein, L., Steenbergen, R.D. and Rosl, F. (2010) “Alternative
splicing of human papillomavirus type-16 E6/E6 early mRNA is coupled to EGF signaling via Erk1/2
activation”PNAS 107:7006–7011.
Rosenwald, A., Ott, G., Pulford, K., Katzenberger, T., Kuhl, J., Kalla, J., Ott, M. M., Mason, D. Y.
and Muller-Hermelink, H. K. (1999) “t(1;2)(q21;p23) and t(2;3)(p23;q21): Two novel variant
translocations of the t(2;5)(p23;q35) in anaplastic large cell lymphoma “. Blood 94:362–364.
Ruchatz, H., Coluccia A. M., Stano, P., Marchesi, E. and Gambacorti-Passerini, C. (2003)
“Constitutive activation of Jak2 contributes to proliferation and resistance to apoptosis in NPM/ALKtransformed cells”. Exp. Hematol. 31:309-315.
Sanchez-Margalet, V. and Najib, S. (1999) “p68 Sam is a substrate of the insulin receptor and
associates with the SH2 domains of p85 PI3K” FEBS Lett. 455(3): 307–310.
Sánchez-Margalet, V., Martín-Romero, C., Santos-Alvarez, J., Goberna, R., Najib, S. and GonzalezYanes, C. (2003) “Role of leptin as an immunomodulator of blood mononuclear cells: mechanisms of
action” Clin Exp Immunol. 133(1):11-9.
Sanchez-Margalet, V., Gonzalez-Yanes, C., Najib, S., Fernandez- Santos, J. M. and Martin-Lacave, I.
(2003) “The expression of Sam68, a protein involved in insulin signal transduction, is enhanced
by insulin stimulation” Cell. Mol. Life Sci. 60(4): 751–758.
Sandlund, J. T., Pui, C. H., Roberts, W. M., Santan, V. M., Morris, S. W., Berard, C. W., Hutchinson,
R. E., Ribeiro, R,, Mahmoud, H., Crist, W. M., Rafferty, M., Raimondi, S. C. (1994)
“Clinicopathlogic features and tretament outcome of chidren with large cell lymphoma and the
t(2;5)(p23;q35)“ Blood 84: 2467–2471
Sellier, C., Rau, F., Liu, Y., Tassone, F., Hukema, R.K., Gattoni, R., Schneider, A., Richard, S.,
Willemsen, R., Elliott, D.J. Hagerman, P.J. and Charlet-Berguerand, N..(2010) “Sam68 sequestration
and partial loss of function are associated with splicing alterations in FXTAS patients” EMBO Journal
29:1248–1261
Sette, C. (2010) “Post-translational regulation of star proteins and effects on their biological
functions” Adv Exp Med Biol. 693:54-66.
Shiota M, Fujimoto J, Semba T, Satoh H, Yamamoto T, Mori S. (1994) “ Hyperphosphorilation of a
novel 80 kDa protein tyrosine kinase similar to Ltk in a human Ki-1 lymphoma cell line, AMS3”
Oncogene 9: 1567-1574.
Skinnider, B.F., Connors, J.M., Sutcliffe, S.B. & Gascoyne, R.D. (1999) “Anaplastic large cell
limphoma: a clinicopathologic analysis.” Hematological Oncology 17: 137-148.
Slupianek, A., Nieborowska-Skorska, M., Hoser, G., Morrione, A., Majewski, M., Xue, L., Morris, S.
W., Wasik, M. A.and Skorski, T. (2001) “Role of Phosphatidylinositol 3-Kinase-Akt Pathway in
Nucleophosmin/Anaplastic Lymphoma Kinase-mediated Lymphomagenesis”. Cancer Res. 61:21942199.
So, C.W., Caldas, C., Liu, M.M., Chen, S.J., Huang, Q.H., Gu, L.J.,Sham, M.H., Wiedemann, L.M.
and Chan, L.C. (1997) “EENencodes for a member of a new family of proteins containing an Src
homology 3 domain and is the third gene located on chromosome 19p13 that fuses to MLL in human
leukemia” PNAS 94 2563–2568.
106
Soda, M., Choi, Y. L., Enomoto, M., Takada, S., Yamashita, S., Ishikawa, S., Fujiwara, S., Watanabe,
H., Kurashina,K., Hatanaka, H., Bando, M., Ohno, S., Ishikawa, Y., Aburatani, H., Niki, T., Sohara,
Y., Sugiyama, Y. And Mano, H. (2007) “Identification of the trasforming EML$-ALK fusion gene in
non-small-cell lung cancer”. Nature 448 : 561-566.
Sonenberg, N. and Hinnebusch, A.G. (2007) “New modes of translation control in development,
behavior, and disease” Mol. Cell 28, 721–729.
Song, L., Wang, L., Li, Y., Xiong, H., Wu, J., Li, J. and Li, M. (2010) “Sam68 up-regulation
correlates with, and its downregulation inhibits, proliferation and tumourigenicity of breast cancer
cells” Journal of Pathology 222:227–237.
Souttou, B., Carvalho, N.B., Raulais, D. and Vigny, M. (2001) “Activation of anaplastic lymphoma
kinase receptor tyrosine kinase induces neuronal differentiation through the mitogen-activated protein
kinase pathway”. J. Biol. Chem. 276: 9526–9531.
Stein, H., Mason, D. Y., Gerdes, J., O‟Connor, N., Wainscoat, J., Pallesen, G., Gatter, K., Falini, B.,
Delson, G., and Lemke, H. (1985) “The expression of the Hodgkin‟s disease associated antigen Ki-1
in reactive and neoplastic lymphoid tissue: evidence that Reed-Sternberg cells and histiocytic
malignancies are derived from activated lymphoid cells” Blood 66: 848-858.
Stoica, G. E., Kuo, A., Aigner, A., Sunitha, I., Souttou, B., Malercyk, C., Caughey, D. J., Went, D.,
Karavanov, A., Riegel, A.T. and Wellstein, A. (2001). “Identification of anaplastic lymphoma kinase
as a receptore for the growth factor pleiotrophin” J Biol. Chem. 276:16772–16779.
Stoica, G. E., Kuo, A., Powers, C., Bowden, E. T., Buchert-Sale, E., Riegel, A. T. and Wellstein, A. T.
(2002) “Midkine binds to anaplastic lymphoma kinase (ALK) and acts as a growth factor for different
cell types”. J Biol Chem 277: 35990-35999.
Tamura, H., Fukada, M., Fujikawa, A. and Noda, M. (2006) “ protein tyrosine phosphatase receptor
type Z is involved in hippocampus-dependent memory formation through dephosphorylation at Y1105
on p190 RhoGAP”. Neurosci. Lett. 399(1-2): 33-38.
Taylor, S.J. and Shalloway, D. (1994) “An RNA-binding protein associated with src through its SH2
and SH3 domains in mitosis, Nature 368:867– 871.
Taylor, S.J., Resnick, R.J. and Shalloway, D. (2004) “Sam68 exerts separable effects on cell cycle
progression and apoptosis” BMC Cell Biology 5 5.
Tort, F., Pinyol, M., Pulford, K., Roncador, G., Hernandez, L., Nayach, I., Kluin–Nelemans, H. C.,
Kluin, P., Touriol, C., Delsol, G., Mason, D. and Campo, E. (2001) “Molecular characterization of a
new ALK traslocation involvin moesin (MSN–ALK) in anaplastic large cell lymphoma”. Lab. Inv. 81:
419–426.
Touriol, C., Greenland, C., Lamant, L., Pulford, K., Bernard, F., Rousset, T., Mason, D. Y. and
Dalsol, G. (2000) “Further demonstration of the diversity of chromosomal changes involving 2p23 in
ALK–positive lymphoma: 2 chases expressing ALK kinase fused to CLTCL (clathrin chain
polypeptide like)”. Blood 95: 3204–3207.
Trinei, M., Lanfrancone, L., Campo, E., Pulford, K., Mason, D. Y., Pelicci, P. G. and Falini, B..(2000)
“A new variant anaplastic lymphoma kinase (ALK)-fusion protein (ATIC-ALK) in a case of ALKpositive anaplastic large cell lymphoma”. Cancer Res. 60: 793-798.
Trub, T., Frantz, J.D., Miyazaki, M., Band, H. and Shoelson, S.E. (1997) “The roleof a lymphoidrestricted, Grb2-like SH3-SH2-SH3 protein in T cell receptor signaling” J. Biol. Chem. 272 894– 902.
Ule, J., Jensen, K.B., Ruggiu, M., Mele, A., Ule, A. and Darnell, R.B. (2003) “CLIP identifies Novaregulated RNA networks in the brain” Science 302(5648):1212-5.
107
Valacca, C., Bonomi, S., Buratti, E., Pedrotti, S., Baralle, F.E., Sette, C., Ghigna, C. and Biamonti, G.
(2010) “Sam68 regulates EMT through alternative splicing-activated nonsense-mediated mRNA
decay of the SF2/ASF proto-oncogene” Journal of Cell Biology 191:87–99.
Van Roosbroeck K, Cools J, Dierickx D, Thomas J, Vandenberghe P, Stul M, Delabie J, De WolfPeeters C, Marynen P, Wlodarska I. (2010) “ALK-positive large B-cell lymphomas with cryptic
SEC31A-ALK and NPM1-ALK fusions”. Haematologica. 95(3):509-13.
Venables, J.P., Vernet, C., Chew, S.L., Elliot, D.J., Cowmeadow, R.B., Wu, J., Cooke, H.J., Artzt, K.
and Eperon, I.C. (1999)“T-STAR/ETOILE: a novel relative of Sam68 that interacts with an RNAbinding protein implicated in spermatogenesis” Hum. Mol. Genet. 8:959–969.
Vernersson, E., Khoo, N. K., Henriksson, M. L., Roos, G., Palmer, R. H. and Halberg, B. (2006)
“Characterization of the ALK receptor tyrosine kinase in mice”. Gene Expr. Patterns 6: 448-461
Vernet, C. and Artzt, K. (1997) “STAR, a gene family involved in signal transduction and activation
of RNA”Trends Genet. 13(12):479-84.
Vogel, L.B. and Fujita, D.J. (1995) “p70 phosphorylation and binding to p56lck is an early event in
interleukin-2 induced onset of cell cycle progression in T-lymphocytes” J. Biol. Chem. 270:2506–
2511.
Wang, L., X, J., Zeng, L., Ye, X., Wu, Q., Dai, J., Ji, C., Gu, S., Zhao, C., Xie, Y. and Mao, Y. (2002)
“Cloning and characterization of a novel human STAR domain containing cDNA KHDRBS2” Mol.
Biol. Rep. 369–375.
Weng, A., Thomas, S.M., Rickles, R.J., Taylor, J.A., Brauer, A.W., Seidel-Dugan., C., Michael,
W.M., Dreyfuss, G. and Brugge, J.S. (1994) “Identification of Src, Fyn and Lyn SH3-binding
proteins: implications for a function of SH3 domains” Mol.Cell.Biol. 14:2010-13.
Wong DW, Leung EL, Wong SK, Tin VP, Sihoe AD, Cheng LC, Au JS, Chung LP, Wong MP.(2011)
“A novel KIF5B-ALK variant in nonsmall cell lung cancer”. Cancer. 117(12):2709-18.
Wong, G., Muller, O., Clark, R., Conroy, L., Moran, M.F., Polakis, P. and McCormick, F. (1992)
“Cloning and nucleic acid binding properties of the GAP-associated tyrosine phosphoprotein p62”Cell
69:551– 558.
Yanisch–Perron, C., Vieira, J. and Messing, J. (1985) “Improved M13 phage cloning vectors and host
strains: nucleotide sequences of the M18mp18 and pUC19 vectors” Gene 33: 103– 119.
Yang, H. L., Eriksson, T., Verbersson, E., Vigny, M., Hallberg, B and Palmer, R. H. (2007) “The
ligand Jelly Belly (Jeb) activates the Drosophila Alk RTK to drive PC 12 cell differentiation, but is
inable to activate the mouse ALK RTK”. J. Exp. Zoolog. B Mol. Dev. Evol. 308: 269-282.
Zaffran, S., Astier, M., Gratecos, D. and Semeriva, M. (1997) “The held out wings (how) Drosophila
gene encodes a putative RNA binding protein involved in the control of muscular and cardiac
activity”Development 124: 2087– 2098.
Zamo, A., Chiarle, R., Piva, R., Howes, J., Fan, Y., Chilosi, M., Levy, D. E. and Inghirami, G. (2002)
”Anaplastic Lymphoma Kinase (ALK) activates Stat3 and protecs hematopoietic cells from cell
death”. Oncogene 21:1038-1047.
Zhang, Q., Wang, H. Y., Liu, X. and Wasik, M. A. (2007) “STAT5A is epigenetically silenced by the
tyrosine kinase NPM1-ALK and acts as a tumor suppressor by reciprocally inhibiting NPM1-ALK
expression”. Nature Med. 13:1341-1348.
Zhang, Z., Li, J., Zheng, H., Yu, C., Chen, J., Liu, Z., Li, M., Zeng, M., Zhou, F. and Song, L. (2009)
“Expression and cytoplasmic localization of SAM68 is a significant and independent prognostic
marker for renal cell carcinoma” Cancer Epidemiology, Biomarkers & Prevention 18:2685–2693.
108