PIRUVATO DEIDROGENASI
IL PIRUVATO CHE DERIVA DALLA OSSIDAZIONE DEI
CARBOIDRATI E’ UNA DELLE FONTI DI ACETIL-CoA,
MOLECOLA CHE ENTRA NEL CICLO TCA PER ESSERE
COMPLETAMENTE OSSIDATA
LA CONVERSIONE DEL PIRUVATO IN ACETIL-CoA E’
UNA DECARBOSSILAZIONE OSSIDATIVA OPERATA DA
UN
COMPLESSO
NOTO
COME
PIRUVATO
DEIDROGENASI
LA REAZIONE E’ MOLTO COMPLESSA E PREVEDE NON SOLO LA
DECARBOSSILAZIONE
DEL
PIRUVATO
E
L’ATTIVAZIONE
METABOLICA DEI DUE ATOMI DI CARBONIO RESTANTI, MA ANCHE
LA PRODUZIONE DI EQUIVALENTI RIDUCENTI SOTTO FORMA DI
NADH
LA REAZIONE E’ FORTEMENTE ESOERGONICA E PRATICAMENTE
IRREVERSIBILE.
IL COMPLESSO DELLA PIRUVATO DEIDROGENASI E’ COSTITUITO
DA TRE ENZIMI:
- PIRUVATO DECARBOSSILASI (E1)
- DIIDROLIPOAMMIDE TRANSACETILASI (E2)
- LIPOAMMIDE DEIDROGENASI (E3)
PER LA SUA ATTIVITA’ CATALITICA QUESTO
COMPLESSO ENZIMATICO NECESSITA DI 5 COENZIMI:
TIAMINA PIROFOSFATO (TPP) (Vitamina B1 che diviene
TPP dopo una pirofosforilazione ATP-dipendente). Partecipa a
tutte le decarbossilazioni di -chetoacidi. La parte attiva del
coenzima è rappresentata dall’anello tiazolo in cui il carbonio
a carattere acido (tra l’N e lo S) forma un carbanione che può
legare il carbonio carbonilico producendo un composto di
addizione. Questo composto va incontro ad una
decarbossilazione non ossidativa in cui l’anello tiazolico funge
da trappola di elettroni dando luogo alla formazione di un’eneamina stabilizzata per risonanza. Si produce l’IDROSSIETILTPP
LIPOAMMIDE E’ tipicamente un trasportatore di elettroni e
di gruppi acile che lega allo zolfo della lipoammide
all’IDROSSIETIL-TPP; contemporaneamente si
ossida
l’aldeide e si riduce lo zolfo. Si genera così un gruppo acilico
che verrà successivamente trasferito al Coenzima A
COENZIMI
FLAVINICI
Abbiamo il FLAVIN ADENIN
DINUCLEOTIDE (FAD) (Vitamina B2; riboflavina) e il FLAVIN
MONONUCLEOTIDE (FMN). Per entrambi i coenzimi la parte
funzionale è l’ANELLO ISOALLOSSAZINICO che funge da
accettore di elettroni. Sono tipicamente coenzimi che
partecipano a ossidazioni bielettroniche che possono
procedere in due passaggi monoelettronici
COENZIMA A Partecipa all’attivazione dei gruppi acile tra cui
l’acetile che deriva dal piruvato. Deriva dalla vitamina ACIDO
PANTOTENICO. La parte funzionale è il tiolo libero
all’estremità
NAD Funge da accettore finale di elettroni
MECCANISMO DI AZIONE
DELLA PIRUVATO
DEIDROGENASI
L’OSSIDAZIONE
DEL
PIRUVATO AD ACETILCOA
COINVOLGE
I
COENZIMI
APPENA
ILLUSTRATI
CHE
AGISCONO DI CONCERTO
CON I TRE ENZIMI
La lipoammide è legata all’E2 ma interagisce con
tutti e tre gli enzimi attraverso un braccio flessibile
oscillante
Infatti la sua catena copre una lunghezza di circa
1.4 nm, ma studi strutturali hanno evidenziato che
la distanza tra la TPP legata ad E1 ed il FAD legato
ad E3 è di circa 4.5-6 nm
Ne scaturisce che esistono almeno due bracci
oscillanti che coprono questa distanza
REGOLAZIONE DELL’ATTIVITA’ DELLA PIRUVATO
DEIDROGENASI
L’attività di questo enzima è regolato mediante inibizione
allosterica.
- enzima E2 è inibita dall’ACETIL-COA ed è attivata dal CoA-SH
- E3 è inibita dal NADH ed è attivata dal NAD+
- l’ATP è un inibitore del complesso mentre l’ADP è un attivatore
- una delle regolazioni più complesse è quella a carico dell’enzima
E1 dell’intero complesso. Infatti si ha una regolazione attraverso
modificazione covalente dell’enzima. La presenza di NADH e
acetil-CoA attivano una componente del complesso, la PIRUVATO
DEIDROGENASI CHINASI, che fosforila tre specifici residui di
serina di E1 con conseguente perdita di attività della piruvato
deidrogenasi
Una PIRUVATO DEIDROGENASI FOSFATASI specifica
rimuove idroliticamente il fosfato legato e riattiva in
questo modo il complesso
La fosfatasi è a sua volta attivata dalla concentrazione di
ioni Ca e Mg
Poiché ATP ed ADP differiscono per l’affinità con l’Mg, la
concentrazione di Mg rispecchia il rapporto ATP/ADP nel
mitocondrio. La piruvato deidrogenasi quindi rispecchia il
livello di ATP presente venendo inattivata quando l’ATP è
abbondante
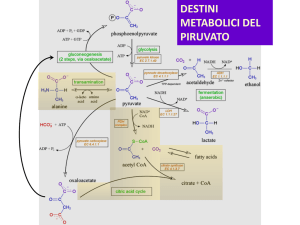
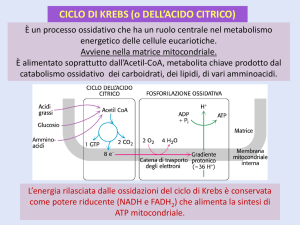
CICLO DEL TCA
1) L’ACETIL-CoA ATTRAVERSO L’ENZIMA CITRATO SINTASI VIENE
CONDENSATO ALL’OSSALACETATO E VIENE SINTETIZZATO ACIDO
CITRICO
Si tratta di una condensazione aldolica. Il gruppo metilico
dell’acetile attivato dal CoA perde un protone a cui segue
l’attacco nucleofilo del carbanione sul carbonio carbonilico
dell’ossalacetato. La reazione forma un prodotto instabile, il
CITRIL-CoA che idrolizza spontaneamente nei prodotti ACIDO
CITRICO e CoA
La reazione è esoergonica ed è un sito regolatore dell’intera via
metabolica
2) IL CITRATO ATTRAVERSO L’AZIONE DELL’ACONITASI VIENE
ISOMERIZZATO A cis-ACONITATO E QUINDI AD ISOCITRATO
Questa reazione rende possibile la futura decarbossilazione
del citrato
Infatti i substrati della decarbossilazione sono generalmente
- o -chetoacidi, per cui per poter essere ossidato a gruppo
carbonilico, il gruppo ossidrilico terziario del citrato deve
subire un trasferimento interno alla molecola
L’enzima coinvolto è l’ACONITASI, che produce
l’ISOCITRATO, un alcol secondario che può essere
ossidato
La reazione consiste di una disidratazione seguita
da una idratazione con il cis-ACONITATO come
intermedio
3) L’ISOCITRATO ATTRAVERSO LA ISOCITRATO DEIDROGENASI
VIENE DECARBOSSILATO ED OSSIDATO (CON CONTEMPORANEA
RIDUZIONE DEL NAD) AD -CHETOGLUTARATO
Rappresenta la prima delle due reazioni di decarbossilazione
ossidativa
Anche in questo caso si forma un intermedio,
l’OSSALSUCCINATO, instabile e legato all’enzima che subisce
la decarbossilazione prima del rilascio. Questo enzima è NADdipendente anche se esiste una forma NADP-dipendente nel
citosol ed anche nel mitocondrio
4) L’-CHETOGLUTARATO SUBISCE UNA DECARBOSSILAZIONE
OSSIDATIVA (SI RIDUCE IL NAD) CON LA CONTEMPORANEA
FORMAZIONE DI UN SUCCINIL-CoA. LA REAZIONE E’ CATALIZZATA
DALL’ENZIMA -CHETOGLUTARATO DEIDROGENASI
Si tratta di una ulteriore decarbossilazione ossidativa di un chetoacido con contemporanea formazione di un acil-CoA
L’-chetoglutarato
deidrogenasi
è
un
complesso
multienzimatico dotato di attività enzimatiche simili alla
piruvato deidrogenasi e che necessita degli stessi coenzimi
(TPP, NAD, FAD, acido lipoico e CoA-SH)
A questo punto del ciclo due atomi di carbonio
sono stati introdotti come acetil-CoA e due sono
stati rimossi come CO2
Nelle successive reazioni del ciclo, il succinil-CoA
che si è formato, viene convertito nel substrato che
prende parte alla prima reazione del ciclo TCA,
l’ossalacetato
5) IL SUCCINIL-CoA E’ UN COMPOSTO AD ALTO CONTENUTO
ENERGETICO CHE
IN UNA REAZIONE CATALIZZATA DALLA
SUCCINIL-CoA SINTETASI PRODUCE ATP CON UNA FOSFORILAZIONE
AL LIVELLO DEL SUBSTRATO E SUCCINATO
Il succinil-CoA è un composto ad alto livello energetico la cui
energia potenziale viene utilizzata per promuovere la formazione
di un composto ad alta energia
Avviene il processo noto come la fosforilazione al livello del
substrato
Negli animali non viene prodotto ATP, ma guanosina-trifosfato
(GTP) che può essere facilmente trasformata in ATP, mediante
scambio di un gruppo fosforico
6)
IL
SUCCINATO
ATTRAVERSO
UNA
DEIDROGENAZIONE OPERATA DALLA
SUCCINATO
DEIDROGENASI FAD-DIPENDENTE VIENE OSSIDATO A
FUMARATO CON PRODUZIONE DI FAD. IN REALTA’ IL
VERO ACCETTORE DI ELETTRONI E’ RAPPRESENTATO
DALL’UBICHINONE
Si tratta di una reazione di deidrogenazione FADdipendente di due atomi di carbonio con
formazione di un doppio legame.
La presenza del FAD è legata al fatto che esso è un
agente ossidante più potente del NAD in quanto il
legame da ossidare è quello C-C
L’enzima succinato deidrogenasi è saldamente
legato alla membrana mitocondriale interna
Questa localizzazione è importante in quanto il
FAD ridotto deve essere riossidato perché l’enzima
possa agire di nuovo. La riossidazione avviene
grazie all’interazione con il sistema di trasporto
elettronico mitocondriale, anch’esso legato alla
membrana
7) ATTRAVERSO UNA IDRATAZIONE IL FUMARATO DA’
IL MALATO AD OPERA DELL’ENZIMA FUMARASI
La reazione consiste di una idratazione catalizzata
dalla fumarasi
8) IL MALATO VIENE QUINDI OSSIDATO
A
OSSALACETATO IN UNA REAZIONE CHE COINVOLGE
L’ENZIMA MALATO DEIDROGENASI CON RIDUZIONE
DEL NAD
Il ciclo viene completato dalla deidrogenazione
NAD-dipendente del malato ad ossalacetato. La
reazione è fortemente endoergonica, ma procede
verso destra per l’azione della citrato sintasi che
mantiene i livelli di OAA estremamente bassi
STECHIOMETRIA ED ENERGETICA DEL CICLO TCA
Il ciclo inizia con l’addizione di un frammento a due atomi di C
(ACETIL-CoA) ed un accettore a 4 atomi di C (OAA). Durante
il ciclo i due atomi di C vengono rimossi sotto forma di CO2 ed
il citrato viene ulteriormente metabolizzato. La reazione
chimica bilanciata è la seguente:
Acetil-CoA + 3 H2O + 3 NAD + + FAD + ADP + Pi 2 CO2 + 3
NADH + 3 FADH2 + CoA-SH + ATP
QUINDI DA UNA MOLE DI GLUCOSIO CHE PRODUCE DUE
MOLI DI ACETIL-CoA SI HANNO:
4 molecole di CO2, 6 molecole di NADH + H+ e 2 molecole di
FADH2 e 2 moli di ATP
Regolazione del ciclo TCA
Ci sono una serie di siti che controllano il ciclo TCA
L’andamento regolare del ciclo presuppone un input
continuo di carbonio, acetil-CoA derivato solitamente dal
piruvato o dagli acidi grassi, anche se possono essere
utilizzati gli amminoacidi e acidi organici
Il
controllo
può
essere
esercitato
quindi
sia
dall’approvvigionamento che dalla velocità di ingresso di
questi substrati nei mitocondri
Inoltre molti enzimi coinvolti nel ciclo TCA sono regolati da
vari metaboliti
Le reazioni catalizzate dal complesso della chetoglutarato deidrogenasi e dalla citrato sintasi
sono irreversibili.
L’attività di entrambi questi enzimi nei mitocondri
è regolata dalla quantità della guanosina
nucleotide.
La -chetoglutarato deidrogenasi è inibita anche
dal succinil-CoA, un intermedio del ciclo.
L’inibizione della citrato sintasi dovuta all’ATP è
stata
spiegata
come
effetto
secondario
dell’aumento di ATP che causa un’inibizione di tipo
feed-back della succinil-CoA sintetasi, che provoca
un aumento nella concentrazione di succinil-CoA
(che inibisce la -chetoglutarato deidrogenasi)
La succinil-CoA sintasi catalizza la fosforilazione
reversibile, a livello di substrato, dell’ADP usando
l’elevata energia libera di idrolisi del legame
tioestere nel succinil-CoA
La formazione del succinato è dunque strettamente
associata alle concentrazioni relative di ATP e ADP
Alte concentrazioni di ADP stimolano la formazione del
succinato mentre alte concentrazioni dell’ATP lo
inibiscono
Quindi la concentrazione degli adenosina e guanosina
nucleotidi influisce enormemente sull’attività di piruvato
deidrogenasi,
citrato
sintasi,
-chetoglutarato
deidrogenasi
e succinil-CoA sintetasi e dunque è
particolarmente importante per controllare il flusso del
carbonio del ciclo
Anche la succinato deidrogenasi esiste in forma attiva ed
inattiva; la forma attiva è ottenuta grazie all’interazione
con vari metaboliti quali lo stesso succinil-CoA,
l’ubichinone ridotto, l’ATP, il succinato, alcuni anioni ed
un basso pH
Comunque, nonostante l’attività enzimatica sia certamente
influenzata da questi prodotti, il loro significato fisiologico
riguardo alla regolazione del ciclo nei mitocondri non è ancora
ben chiarito
Alcuni enzimi del ciclo tra cui la piruvato deidrogenasi e la
isocitrato deidrogenasi sono soggetti ad inibizioni allosteriche
dovute all’aumento del NADH
La malato deidrogenasi che catalizza la reazione di conversione
dal malato ad ossalacetato è inibita sia dal NADH che
dall’ossalacetato
Anche se l’attività di molti enzimi del ciclo TCA può essere
alterata in vitro cambiando la concentrazione dei metaboliti, il
significato di tale attività in vivo è dubbio
REAZIONI (O VIE METABOLICHE) IN CUI SI
UTILIZZANO GLI INTERMEDI DEL CICLO DI
TCA
Il ciclo TCA è una via anfibolica serva cioè ai processi anabolici e
catabolici
.Gli intermedi del ciclo TCA sono implicati in numerosi altri
pathway metabolici
ACETIL-CoA
- beta-ossidazione (ossidazione dei grassiI
- biosintesi dei grassi
- degradazione della lisina, valina, leucina ed
isoleucina
- metabolismo fenilanina
-CHETO GLUTARATO
- biosintesi della lisina
- metabolismo acido ascorbico
- metabolismo glutammato
SUCCINIL-CoA
- metabolismo propionato
- metabolismo fenilalanina
- degradazione valina, leucina ed
isoleucina
SUCCINATO
- biosintesi del butanoato
- metabolismo tirosina
FUMARATO
- ciclo dell’urea
- metabolismo arginina e prolina
- metabolismo tirosina
OSSALACETATO
- metabolismo gliossilato
- metabolismo glutammato ed aspartato
- gluconeogenesis
SEQUENZE ANAPLEROTICHE
Il ciclo TCA funge anche come importante fonte di
intermedi biosintetici. Queste vie tendono a sottrarre
carbonio dal ciclo utilizzando gli intermedi
Ad esempio, l’OAA e l’-CHETOGLUTARATO sono
chetoacidi che portano alla sintesi di amminoacidi
(aspartato e glutammato)
La sottrazione di intermedi dal ciclo determinerebbe il venir
meno del procedere del ciclo stesso se non esistessero
processi in grado di ripristinare le riserve di intermedi del
ciclo stesso. Queste vie sono più propriamente definite
ANAPLEROTICHE (= riempimento)
a) Ripristino dell’OAA
In piante e batteri l’OAA viene direttamente
prodotto dal PEP in una reazione catalizzata dalla
FOSFOENOLPIRUVATO CARBOSSILASI:
b) Enzima malico
Questo enzima è noto anche con il nome di
MALATO DEIDROGENASI NADP-DIPENDENTE
La catena respiratoria
Durante la glicolisi e il ciclo TCA si formano NADH e FADH2
In condizioni aerobiche è necessaria la loro riossidazione
affinché le due vie metaboliche non si blocchino
La riossidazione avviene nella membrana interna del
mitocondrio, attraverso una serie di carriers che
costituiscono una catena di trasporto elettronico nota con il
nome di CATENA RESPIRATORIA
L’ossidazione del piruvato, l’ossidazione dei grassi,
l’ossidazione degli amminoacidi ed il ciclo dell’acido
citrico avvengono tipicamente nella matrice mitocondriale
Sappiamo che il mitocondrio è costituito da una
membrana esterna, da una membrana interna, dallo
spazio intermembrana e dalla matrice. La membrana
interna è ripiegata a formare delle creste
Ma indipendentemente da dove avvengono, tutte
le ossidazioni portano alla produzione di
trasportatori di elettroni ridotti, soprattutto NADH
La maggior parte di questo NADH viene riossidato, con concomitante produzione di ATP,
attraverso la catena degli enzimi facenti parte della
catena respiratoria, saldamente ancorata alla
membrana interna
E’ proprio sulla membrana interna che sono
dislocati i diversi complessi responsabili della riossidazione del NADH e della contemporanea
produzione di ATP
L’effetto principale della catena è il trasporto di
elettroni dal NADH e dal FADH2 sino all’O2, che
costituisce l’accettore finale, per formare H2O
NADH + H+ + ½O2 → H2O + NAD+
FADH2 + ½O2 → H2O + NAD+
A causa della grande differenza tra i potenziali di
ossidoriduzione del donatore (NADH + H+ o ubichinone
ridotto; ΔE0 =- 0.32 V) e l’accettore (O2 ΔE0 =+ 0.82 V) queste
reazioni redox sono fortemente esoergoniche
ΔG0’ = - n FΔE0 = -2(96,5)[0,82-(-0,32)] = -220 kJ mol-1
Gran parte dell’energia disponibile viene utilizzata per la
formazione di un gradiente protonico che viene a sua volta
usato dall’ATP sintasi per produrre ATP
PER OGNI NADH OSSIDATO SI FORMANO 3 ATP MENTRE
PER OGNI FADH2 OSSIDATO SI OTTENGONO 2 ATP
Componenti della catena di trasporto
elettronico mitocondriale
La catena di trasporto degli elettroni avviene attraverso 4
complessi (complessi I, II, III e IV) che si trovano sulla
membrana interna e molecole di trasferimento mobili quali
l’ubichinone (coenzima Q) e il citocromo c
Il complesso II è in realtà la succinato deidrogenasi, che in
realtà appartiene al ciclo del citrato
L’ATP sintasi viene denominata complesso V, anche se non
partecipa al trasporto degli elettroni
Tutti i complessi della catena respiratoria sono formati da
numerose subunità polipeptidiche e contengono una serie di
coenzimi redox legati alle proteine. Tra questi abbiamo:
1) FLAVOPROTEINE Le deidrogenasi che determinano il
movimento degli elettroni nella catena respiratoria sono
FLAVOPROTEINE. La NADH DEIDROGENASI che
catalizza
l’ossidazione del NADH è un enzima legato alla membrana che
contiene flavinmononucleotide (FMN) come gruppo prostetico
2) PROTEINE FERRO-ZOLFO Differiscono dai citocromi in
quanto non contengono il gruppo eme, anche se contengono
ferro, il quale è localizzato tra lo zolfo della cisteina e lo zolfo
inorganico a formare un complesso
3) UBICHINONI Carrier mobile di elettroni solubile ai lipidi
Fe-S proteine
Complesso I:
NADH
deidrogenasi
E’ costituito da 26
polipeptidi e 7 centri
ferro-zolfo. Catalizza il
trasporto di elettroni
dal NADH al gruppo
prostetico FMN della
NADH deidrogenasi e
quindi all’ubichinone.
Gli elettroni possono
essere introdotti nella
catena respiratoria in
punti diversi
Complesso II:
Succinato deidrogenasi
Anche gli elettroni che derivano dall’ossidazione del
succinato, dall’acetil-CoA e da altri substrati vengono
trasferiti all’ubichinone rigenerando il FAD legato ad un
enzima; il processo è mediato dal complesso II o da altre
deidrogenasi mitocondriali
Il complesso II è noto come succinato-ubichinone
ossidoriduttasi ed è legato alla succinato deidrogenasi
che partecipa al ciclo TCA. Il complesso contiene proteine
Fe-S che accettano elettroni dal FADH2, nella succinato
deidrogenasi. Gli elettroni vengono quindi nuovamente
trasferiti all’ubichinone. Il trasferimento di elettroni è
accompagnato dall’assorbimento di 2H+ della matrice
Complesso III: citocromo B, c1
Questo complesso è noto come ubichinone citocromo C
ossidoriduttasi
L’ubichinone ridotto trasferisce i suoi elettroni al complesso
III che, a sua volta, attraverso i due gruppi eme di tipo b, un
centro Fe/S e un gruppo eme di tipo c (citocromo c1), tutti
legati al complesso, riduce la piccola emoproteina citocromo
c
Complesso IV: citocromo
ossidasi
La citocromo c ossidasi contiene due ioni rame
(CuA e CuB) e i gruppi eme a e a3 attraverso i quali
gli elettroni arrivano finalmente all’ossigeno
Il complesso catalizza il trasferimento di 4
elettroni. Ciò è importante in quanto rende
possibile la completa riduzione dell’O2 ad H2O
senza la generazione di intermedi tossici come
l’H2O2
Questo complesso utilizza protoni nella matrice e
trasferisce protoni nello spazio intermembrana
Come abbiamo visto, i complessi, compreso il V, sono tutti
proteine integrali della membrana interna del mitocondrio e
non sono in contatto diretto tra loro
L’ubichinone si muove liberamente nella membrana a causa
della sua lunga catena laterale non polare
Il citocromo c invece è solubile in acqua e si lega alla
superficie esterna della membrana interna
Trasporto elettronico e sintesi
dell’ATP
Abbiamo detto che il trasporto di elettroni nella catena
respiratoria determina la liberazione di energia, la quale
viene
conservata
come
gradiente
protonico
TRANSMEMBRANA che è accoppiato alla sintesi dell’ATP
Si crea un gradiente protonico che determina una
variazione del pH tra matrice e spazio intermembrana.
Infatti:
1) La matrice
intermembrana
è
ALCALINA
rispetto
allo
spazio
2) I protoni rilasciati sono carichi positivamente per cui
determinano
una
carica
positiva
nello
spazio
intermembrana
Tutto ciò determina un GRADIENTE ELETTROCHIMICO
attraverso la membrana interna definito come FORZA
MOTRICE PROTONICA (PMF)
Questa PMF è mantenuta anche perché la membrana
interna è impermeabile ai protoni che quindi non rientrano
nella matrice
L’energia della PMF è incanalata attraverso un complesso
enzimatico nella membrana interna. Il complesso è noto
come F0F1-ATP SINTASI (complesso V) e canalizza la sintesi
di ATP a partire da ADP e Pi
L’unità F1 contiene il sito attivo per la sintesi di ATP
Quando l’unità è isolata dalla membrana mitocondriale non
determina la sintesi di ATP ma catalizza l’idrolisi di ATP in
ADP+Pi
La produzione di ATP
Si pensa che 10 siano i protoni trasportati
attraverso la membrana per ogni molecola di NADH
ossidata Sappiamo che:
3 H+ determinano la sintesi di una mole di ATP
Inoltre 1 H+ è coinvolto nel trasporto di ADP + Pi
nella matrice e dell’ATP nel citoplasma
Quindi le molecole di ATP sintetizzate ogni NADH
ossidato sono 2,5--3,3
Il trasporto di elettroni dal FADH2 all’O2 coinvolge
6 protoni, quindi 1,5--2 moli di ATP
Si
considera
comunque
genericamente che sono 3 le moli di
ATP prodotte per ogni NADH
ossidato e 2 per mole di FADH2
ossidato
In realtà non tutto il NADH è prodotto nella matrice (vedi
GLICOLISI) e la membrana interna mitocondriale è
impermeabile al NADH
Questo problema è ovviato con il sistema “navetta”
(SHUTTLE)
Nella malato-aspartato navetta, l’ossalacetato è ridotto a
malato nel citoplasma dalla MALATO DEIDROGENASI
Durante questa reazione il NADH è ossidato a NAD+
Il malato viene quindi trasportato nella matrice attraverso
un carrier di membrana che scambia il malato
citoplasmatico con l’α–chetoglutarato
Una volta nella matrice il NADH è rigenerato dalla
ossidazione del malato ad ossalacetato attraverso
la malato deidrogenasi
Tale “navetta” è completata da una reazione di
transamminazione in cui l’α-chetoglutarato è
convertito a glutammato e l’ossalacetato in
aspartato
Resa energetica del metabolismo ossidativo
Calcoliamo quanta energia si ottiene sotto forma di ATP dal
catabolismo ossidativo completo del glucosio
Di seguito vengono presentate le equazioni bilanciate per
ognuna della tre vie degradative coinvolte
GLICOLISI:
Glucosio + 2ADP +2Pi +2NAD+ 2 Piruvato + 2ATP + 2NADH
+2H2O + 4H+
COMPLESSO DELLA PIRUVATO DEIDROGENASI:
2Acetil-CoA + 6 H2O + 6NAD + + 2FAD + + 2ADP + Pi 4CO2 +
6NADH + 2FADH + 2CoA-SH + 2ATP
REAZIONE COMPLESSIVA:
Glucosio + 10NAD+ + 2FAD+ + 4H2O + 4ADP + 4 Pi 6CO2
+10NADH + 4H+ + 2FADH2 + 4ATP
Quindi i tre processi producono esattamente 4 moli di ATP, oltre
10 moli di NADH e due moli di FADH2
Considerando che l’ossidazione del NADH porta alla sintesi di 3
moli di ATP e quelle del FADH2 a due moli di ATP si ha una resa
totale di 38 moli di ATP
Le cellule che utilizzano il sistema di trasporto a navetta del
glicerolo fosfato devono pagare un costo energetico
Gli elettroni del NADH citoplasmatico entrano nella catena
respiratoria sotto forma di FADH2; di conseguenza, la resa in
ATP di ognuna di queste due molecole di NADH è pari a 2 e non
a3
Questo diminuisce la resa totale in ATP a 36




![(Microsoft PowerPoint - Respirazione [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/005389674_1-a26fad8be37ceeba30a7c27b4044a2d6-300x300.png)