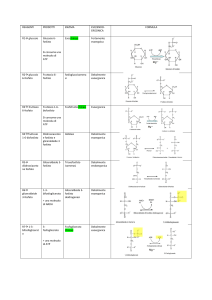
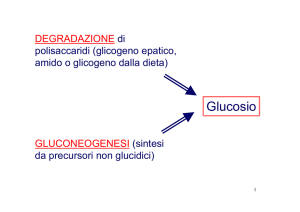
DOSAGGIO SPETTROFOTOMETRICO
DELLE ATTIVITA’ ENZIMATICHE
Se nel corso di una reazione enzimatica si produce NADH+H+, come nella
reazione catalizzata dalla lattato deidrogenasi
lattato + NAD+ piruvato + NADH+H+
l’attività enzimatica può essere determinata sfruttando la proprietà del NADH di
assorbire luce di una determinata lunghezza d’onda (l = 340nm, vedi Fig. 15.7).
Misurando spettrofotometricamente l’aumento di assorbimento/min del NADH+H+
a l340 nm, attraverso la legge di Lambert-Beer (A = e·c·l), conoscendo il valore di
e (6300, a 340 nm), si può determinare la variazione di concentrazione del NADH
nell’unità di tempo. L’applicazione di opportuni parametri consente di calcolare le
unità di enzima presenti nel campione in esame.
Altre reazioni formano prodotti la cui concentrazione non è facilmente misurabile in
maniera diretta. Un esempio è la rezione catalizzata dalla glucochinasi
glucosio + ATP glucosio-6-fosfato + ADP
In questo caso è necessario accoppiare alla reazione catalizzata dalla
glucochinasi una seconda reazione enzimatica che ha come substrato il glucosio6-fosfato prodotto della prima. La reazione in questione è quella catalizzata dalla
glucosio-6-fosfato deidrogenasi
glucosio-6-fosfato + NADP+ gluconolattone-6-fosfato + NADPH+H+
che forma NADPH+H+, misurabile mediante assorbimento a l340 nm, come
descritto per il NADH+H+.
Elementi di Chimica e Biochimica
Rita Roberti, Giovanni Alunni Bistocchi
Copyright © 2007 – The McGraw-Hill Companies s.r.l.







![(Microsoft PowerPoint - Respirazione [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/005389674_1-a26fad8be37ceeba30a7c27b4044a2d6-300x300.png)