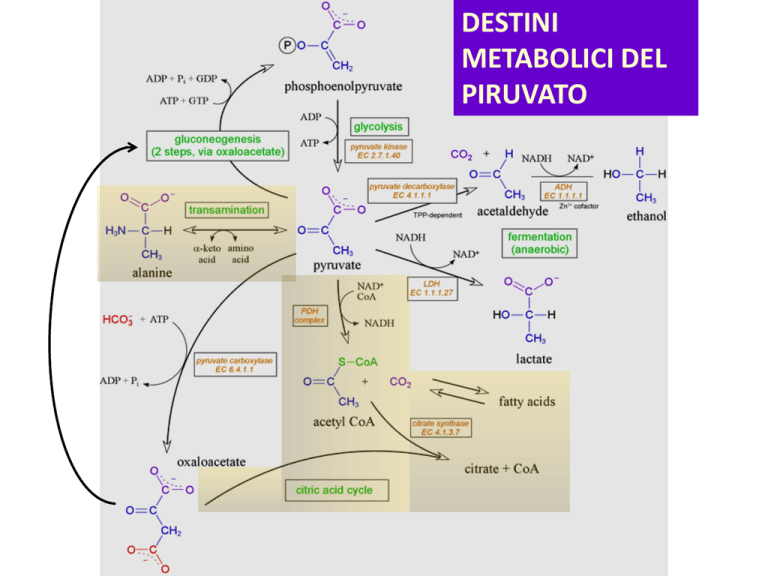
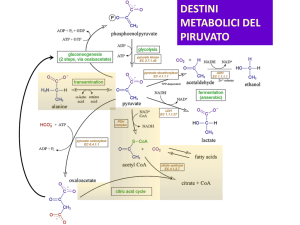
DESTINI
METABOLICI DEL
PIRUVATO
Metabolismo aerobico: il piruvato entra nel mitocondrio
Glicolisi
Piruvato
Acetil-CoA
Ciclo di Krebs
Catena di trasporto degli
elettroni
Complesso della Piruvato
deidrogenasi (PDH)
Piruvato
Acetil-CoA
La reazione produce oltre all’acetil-CoA anche un equivalente riducente di NADH
che può essere indirizzato alla catena di trasporto di e - mitocondriale.
Partendo da 1 molecola di glucosio si ottengono 2 Acetil-CoA e 2 NADH
Complesso della Piruvato
deidrogenasi (PDH)
Complesso multienzimatico contenente
copie multiple di 3 distinte attività
enzimatiche (E1 - E2 - E3)
E1 = piruvato deidrogenasi (24 subunità)
E2 = diidrolipoammide acetiltransferasi (24 subunità)
E3 = diidrolipoammide deidrogenasi (12 subunità)
Decarbossilazione
ossidativa del
piruvato.
È un processo
irreversibile.
Subunità E1 Contiene come cofattore la TPP. Catalizza la decarbossilazione del
piruvato e la formazione dell’intermedio idrossietil-TPP
E1
Piruvato
Idrossietil-
Subunità E2 Contiene come cofattore la Lipoammide. La subunità E1 trasferisce il
gruppo idrossietilico dalla TPP sulla lipoammide della subunità E2: nel trasferimento
l’idrossietile viene gruppo Acetilico e e ilponte disolfuro della lipoammide viene
ridotto. Si forma un legame tioestere ad alta energia.
Acetil-CoA
Lipoillisina
ridotta
Piruvato
E2
Idrossietil-
E1
Lipoillisina
ossidata
La subunità E2 catalizza, quindi, la
transacetilazione del gruppo
acetilico dalla Lipoammide al
Coenzima A con conseguente
formazione di Acetil-CoA. La
lipoammide rimane nella forma
ridotta.
E2
E1
Acetil-CoA
Lipoillisina
ridotta
Piruvato
Idrossietil-
Lipoillisina
ossidata
Subunità E3
E3
Contiene come cofattore il FAD.
Catalizza l’ossidazione della lipoillisina (si riforma il ponte disolfuro) con riduzione del FAD a
FADH2 il quale trasferirà poi 2 e- sul NAD+ con conseguente produzione finale di NADH.
REGOLAZIONE DEL COMPLESSO DELLA PIRUVATO
DEIDROGENASI
DISPONIBILITA’ DEL SUBSTRATO
MODULAZIONE ALLOSTERICA
MODIFICAZIONI COVALENTI
(fosforilazione/defosforilazione)
I prodotti della reazione funzionano da
modulatori allosterici negativi:
Acetil-CoA (sulla transacetilasi, E2)
NADH (sulla diidrolipoil deidrogenasi, E3)
reazione
irreversibile
alte concentrazioni di Acetil-CoA e NADH informano
l’enzima che non è più necessario metabolizzare il
piruvato (le esigenze cellulari sono soddisfatte)
L’attività della PDH è connessa anche al metabolismo
dei lipidi: una elevata degradazione dei lipidi che
incrementa il livello di Acetil-CoA rallenta la PDH e
porta al risparmio di glucosio.
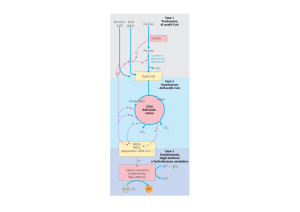
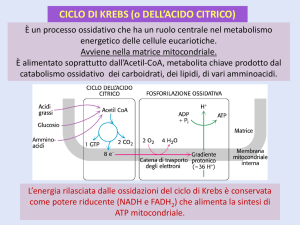
CICLO DI KREBS (o DELL’ACIDO CITRICO)
È un processo ossidativo che ha un ruolo centrale nel metabolismo
energetico delle cellule eucariotiche.
Avviene nella matrice mitocondriale.
È alimentato soprattutto dall’Acetil-CoA, metabolita chiave prodotto dal
catabolismo ossidativo dei carboidrati, dei lipidi, di vari amminoacidi.
L’energia rilasciata dalle ossidazioni del ciclo di Krebs è conservata
come potere riducente (NADH e FADH2) che alimenta la sintesi di
ATP mitocondriale.
Per ogni molecola di Acetil-CoA
che viene ossidata nel ciclo
vengono prodotti:
3 NADH
1 FADH2
1 GTP (ATP)
Acetil-CoA
Citrato
Ossalacetato
Malato
Isocitrato
Ciclo
dell’acido
citrico
chetoglutarato
Fumarato
Succinil-CoA
Succinato
H+
-:CH
2
ACETIL-CoA
CITRATO
SINTASI
CITRATO
OSSALACETATO
3
2
ACONITASI
ACONITASI
Cis-ACONITATO
CITRATO
Isomerizzazione: il gruppo –OH viene
spostato dal C-3 al C-2.
3
2
ISOCITRATO
Nella cellula la reazione è spinta in avanti dal
consumo di isocitrato nella reazione successiva.
H
O
|
F — C — C - Na+
O
|
H
FLUOROACETIL-CoA:
INIBITORE SUICIDA DELL’ACONITASI
È un metabolita del FLUOROACETATO
(Tossina usata come pesticida)
Reagisce con l’ossalacetato per formare FLUOROCITRATO
Il fluoroacetil-CoA entra quindi nel ciclo di Krebs, inizia ad essere
trasformato dalla citrato-sintasi ma quando entra nel sito attivo
dell’ACONITASI interagisce fortemente con essa inibendola in modo
definitivo e bloccando quindi tutto il ciclo e la respirazione cellulare
Decarbossilazione ossidativa dell’isocitrato
Il gruppo –OH in C-2 dell’isocitrato subisce un’ossidazione che porta alla
produzione di NADH (NADPH) e alla formazione di un α-chetoacido
a) Isoenzima NAD-dipendente nella matrice mitocondriale.
b) Isoenzima NADP-dipendente nel mitocondrio e nel citosol
(serve a generare NADPH).
H+ rilasciato dall’ossigeno
CO2
ISOCITRATO
DEIDROGENASI
:H- (ione idruro
trasferito sul NAD+
Isocitrato
α-chetoglutarato
Ossidazione dell’α-chetoglutarato: questa reazione porta alla formazione di un
legame TIOESTERE ad alta energia e alla produzione di NADH
Complesso dell’α-chetoglutarato
deidrogenasi (TPP, Lipoammide,
FAD-dipendente).
Succinil-CoA
α-chetoglutarato
Simile per struttura e funzione al complesso della
piruvato deidrogenasi (sono utilizzati gli stessi
coenzimi e avviene la decarbossilazione ossidativa di
un α-chetoacido)
L’idrolisi del legame tioestere ad alta energia è accoppiata alla fosforilazione
di un nucleoside-difosfato (GDP o ADP).
Si ottiene GTP o ATP. Le cellule animali hanno 2 isozimi,
1 specifico per l’ADP e 1 per il GDP.
Succinil-CoA
sintetasi
Succinil-CoA
Succinato
Legame tioestere
ad alta energia
Un fosfato inorganico spiazza il CoA
dalla molecola di succinil-CoA e si forma
un anidride mista: succinil-fosfato
Il gruppo fosfato viene
ceduto ad un residuo di
His dell’enzima e si libera
succinato
Il fosfo-enzima cede il gruppo fosfato al GDP e si forma GTP
Il GTP scambia il gruppo fosfato con
l’ADP per formare ATP
GTP + ADP
GDP + ATP
Nucleoside difosfato-chinasi
Ossidazione del succinato a fumarato
COMPLESSO II della catena di trasporto di e- mitocondriale
Trasferisce gli e- al complesso III
QH2
Q
SUCCINATO
DEIDROGENASI
SUCCINATO
FUMARATO
FUMARASI
FUMARATO
Aggiunta STEREOSPECIFICA
TRANS di acqua al doppio legame.
Quando il fumarato è nel sito
attivo dell’enzima l’aggiunta della
molecola d’acqua può avvenire
solo in una direzione.
Stato di transizione
carbanionico
FUMARASI
L-MALATO
Il ciclo di Krebs si conclude con un’ossidoriduzione che riforma
l’ossalacetato e produce NADH
L-MALATO
MALATO
DEIDROGENASI
OSSALACETATO
Nelle cellule la reazione è fortemente spinta in avanti perché
l’ossalacetato è continuamente rimosso dalla citrato sintasi la quale
mantiene bassa la concentrazione di ossalacetato nel mitocondrio.
BILANCIO ENERGETICO: Se partiamo dall’ossidazione di 1 molecola di
glucosio possiamo ottenere energia sufficiente a sintetizzare 36 (o 38)
molecole di ATP
sistema navetta
glucosio
diidrossiacetonefosfato/glicerolo 3-fosfato
Glicolisi
2 ATP + 2 NADH
2 piruvato → 2 Acetil-CoA
(PDH)
Ciclo di Krebs
2 NADH
sistema navetta
malato/aspartato
2 NADH
6 NADH + 2 FADH2 + 2 GTP(ATP)
TOTALE: 4 ATP
10 NADH >>>> ~ 30 ATP
2 FADH2 >>>> ~ 4 ATP
~ 38 ATP
2 FADH2
TOTALE: 4 ATP
8 NADH >>>> ~24 ATP
4 FADH2 >>>> ~ 8 ATP
~ 36 ATP






![11. Ciclo di Krebs [modalità compatibilità]](http://s1.studylibit.com/store/data/001120215_1-23827c0a1e611852a5ba14474c14bb9c-300x300.png)

