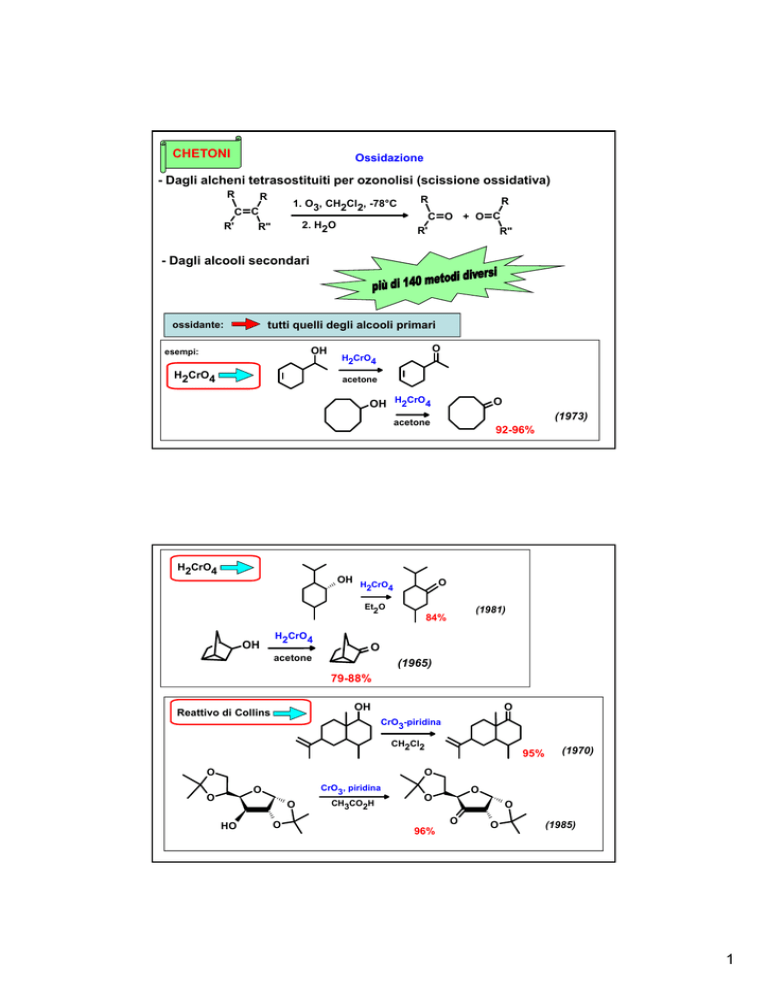
CHETONI
Ossidazione
- Dagli alcheni tetrasostituiti per ozonolisi (scissione ossidativa)
R
R
1. O3, CH2Cl2, -78°C
C C
R'
2. H2O
R"
R
R
C O + O C
R'
R"
- Dagli alcooli secondari
tutti quelli degli alcooli primari
ossidante:
OH
esempi:
H2CrO4
O
H2CrO4
acetone
OH H2CrO4
O
(1973)
acetone
H2CrO4
OH H CrO
2
4
O
Et2O
OH
H2CrO4
92-96%
(1981)
84%
O
acetone
(1965)
79-88%
OH
Reattivo di Collins
O
CrO3-piridina
CH2Cl2
O
95%
(1970)
O
CrO3, piridina
O
O
O
HO
O
CH3CO2H
O
O
O
O
96%
O
(1985)
1
PCC
OH O
O
PCC
O
O
O
CH2Cl2
MnO2
OH
O
MnO2
O
O
CH3
CH3
OH
MnO2
CH CH CH3
HC C C CH CH
HC C C CH CH
(1966)
O
CH C
CH3
57%
(1952)
reagente di Swern
O
OH O
O
O
P2O5
85%
Et3N
ossidante:
NaOCl
in AcOH
O
DMSO
OH
(1987)
O
NaOCl
CH3CO2H
Selettività
alcooli secondari più reattivi dei primari
esempio:
+ NaOCl
CH3CO2H
25°C
OH OH
OH O
85%
(1985)
ossidante:
RuO4
Forte ossidante, può attaccare C=C
Si può preparare in situ da RuO2 con un ossidante (NaOCl o NaIO4)
esempio:
HO
RuO4
O
O
O
O
O
(1970)
con molti altri ossidanti
la reazione non avviene
2
ossidante:
O
H3C
S +
H3C
dimetilsolfuro + NCS
(N-chlorosuccinimide)
N Cl
con una base blanda
O
Meccanismo:
R
HO CH
R
O
N
H3 C
S Cl
H3 C +
CH3
Cl + S
CH3
O
R
R C
B:
H
+ CH3
O S
CH3
Cl-
R
+ CH3
CH O S
R
CH3
R
C
BH+
R
O + (CH3)2S
ossidante:
H3 C +
S O + Cl2
H3 C
con una base blanda
a bassa temperatura
Meccanismo:
O
H3C S + Cl
H3 C
S O + Cl2
H3C
O
+
H3C S
CH3
Cl-
HCl
NEt3
R
H3C
O
C
S O +
H3C
R
C R
H
O
R
+
H3C S O CH
R
CH3
CH3
R
O
R
HO CH
R
3
- Da molecole con CH2 allilico
ossidante:
chetoni α,β-insaturi
SeO2
Meccanismo:
O =/
O
+
R
H
Se
H
O
R
O
H
H
O
R
H
H
Se
O
O
R
H
O H
O H =/
R
O H
Se
Se
Se
Se
O
O
R
H
Δ
+ H2O + Se(0)
R
H
se non cè il secondo H allilico
O
il Se si rimuove con idrolisi
O H
H2O
Se
R
O
R
Se(OH)2
R'
R'
si ottiene un alcool allilico
OH
- Da molecole con C-H enolizzabile (in α ad un carbonile)
ossidante:
SeO2
1,2-dichetoni
O
O
+
R
H
Se
H
O
O
R
R
H
H
O =/
O
Se
O
O H =/
R
O
Se
O
H
O
H
O
O
R
O H
Se
O
H
O H
Se
O
R
H
H
O
Se
O
Δ
+ H2O + Se(0)
R
O
4
stesso livello di ossidazione
- Dagli alchini per idratazione
H3 O +
C H
R C
HO
Hg2+
O
H
C
C
R
R
H
CH3
- Dagli alogenuri vinilici per idrolisi
OH
H3O+
Cl
O
Reazione relativamente poco utile: servono condizioni drastiche (H2SO4
concentrato) e quindi possono reagire altri gruppi funzionali
condizioni più blande
mercuriazione in solvente organico/demercuriazione
con acido diluito
O
O
1. Hg(OCOCF3)2, CH3NO2
temperatura ambiente
2. HCl acquoso
Cl
O
97%
(1979)
Hg può essere rimosso dai composti organici con H- (demercuriazione
riduttiva) o con H+ (protodemercuriazione)
+
HgX2
C
X
C
X
C
demercuriazione riduttiva
X
C
protodemercuriazione
C
HH+
Hg°
HgX
H
C
Hg2+
H
Possibile meccanismo:
HgOCOCF3
+
C C
Cl
+ Hg(OCOCF3)2
HgOCOCF3
C
H+
C OCOCF3
H
C
C OH
Cl
H2O
C C OH
C
H
Cl
H2O
C
Cl +
Cl
-OCOCF
3
HgOCOCF3
H
C
C
O
OH
5
- Da composti aromatici (acilazione di Friedel-Crafts)
O
O
+
R
Z
C
C
AlCl3
chetoni aromatici
R
Cl
Z
- Da cloruri acilici con composti organometallici
O
R
C
+ R'2CuLi
Cl
O
-78°C
R
C
+ R'Cu + LiCl
R'
- Da acidi carbossilici con composti litioorganici
H 3 O+
O
+ 2 R'Li
C
R
OH
O
R
C
R'
Formazione di legame C-C
meccanismo:
O
C
R
O
+ R'Li
OH
H3O+ HO
R
R
R'H
C
O- Li+
O
OH
C
- +
O Li
C
R
R'
Li+ - O
R'Li
R'
R
H2O
IMMINE ed ENAMMINE
R
C
R'
NH
N
C
C
R' R
R
R'
R'
R
R'
C
C
NH2
- IMMINE: da composti carbonilici (aldeidi e chetoni) con ammine
primarie, in condizioni disidratanti
NH2
TsOH
O
N
+ H2O
+
85%
TsOH = acido p-toluensolfonico H3C
(1976)
rimossa
azeotropicamente
SO3H
- ENAMMINE: da composti carbonilici (aldeidi e chetoni) con ammine
secondarie, in condizioni disidratanti
O
TsOH
O
HO
O
O
N
N
+ H2O
+
N
H
toluene
a ricadere
morfolina
4-ossaazacicloesano
72-80%
(1973)
rimossa
azeotropicamente
6
R' O
ACETALI
OR'
C
R"
R
Stesso livello di ossidazione di aldeidi e chetoni, ma C ibridato sp3
gruppo per protezione temporanea di C=O o -OH
- Da aldeidi
H+
O
C
R
R' O
+ R'OH
H
OR'
+ H2O
C
eccesso
R
H
allontanata per
spostare l'equilibrio
Con 1,2- e 1,3-dioli si formano acetali ciclici: la formazione dell'acetale è facile, la
rimozione è difficile
- Da chetoni
La reazione è più difficile, per l’ingombro sterico maggiore del CO: è
utile sinteticamente solo con dioli
O
O
O
TsOH
+ HOCH2CH2OH
O
1 :
25
+ H2O
O
benzene
a ricadere
98%
allontanata per
spostare l'equilibrio
(1985)
distillazione azeotropica
per rimuovere l'acqua
reazione chimica
O
OCH2CH3
H C OCH2CH3 + 2 CH3CH2OH
H2O + H C OCH2CH3
OCH2CH3
ortoformiato di etile (ortometanoato di etile)
- Da un altro acetale (Transacetalizzazione)
O
HO
+ O
O
OH
O
+
O
O
O
H3C
SO3H
eccesso
2-etil-2-metil-1,3-diossaciclopentano
O
(1973)
80%
distillato via
7
- Da alcool ed etere vinilico
N
N
C
C
TsOH
OH
O
CH2Cl2
+
O
temp. ambiente O
(1983)
O
99%
diidropirano
O
O
tetraidropiranile, THP (tetrahydropiranyl)
O
- Da α-alogenoeteri ed alcooli
..
Br CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 OH
+ CH3 O CH2 CH2 O CH2 Cl
1-cloro-2,5-diossaesano
N
CH2Cl2
(1983)
0°C
CH3 O CH2CH2 O CH2 O (CH2)8Br
76%
Gli acetali si rimuovono con acido acquoso o alcoolico, i metil metossietossi
eteri con ZnBr2 anidro in CH2Cl2 a 25°C e poi NaHCO3 acquoso
rimozione selettiva di CH3OCH2CH2OCH2-, lasciando inalterati altri acetali
OR
CH
ETERI VINILICI (ENOL ETERI)
C
R
R'
- Da acetali, per eliminazione acido-catalizzata di un alcool
H3 C O
OCH3
(*)
O
CH3
(*):
TsOH, a caldo ,
CF3SO3Si(CH3)3 +
N
a -20°C
trifluorometansolfonato di trimetilsilile ed etildiisopropilammina
esempi:
H3C O
O
+ HC(OCH3)3
OCH3
O
TsOH
Δ
24 ore
TsOH
temp. amb.
CH3
+ CH3OH
89%
(1974)
8
RO OR
H
iPr2NEt
R
O
CF3SO3Si(CH3)3
+ ROSi(CH3)3
(1988)
-20°C
- Da alchini ed alcooli, in ambiente basico
R'O
R C C R
H OR'
R C C R + R'OH
- Da alogenuri vinilici con alcossidi
+ RO
C C
-
C C
Cl
Cl
-
OR
Questi due metodi richiedono condizioni di reazione molto drastiche:
altri gruppi funzionali potrebbero non resistere
CH
SILIL ENOL ETERI
R
- Da composti carbonilici
C
O
SiMe3
R'
bloccando la forma enolica con trimetilclorosilano
(CH3)3SiCl, (CH3CH2)3N in DMF
Et3N
O
O-
OH
Me3SiCl
Cl
O
Si(CH3)3
-
con chetoni non simmetrici sono possibili due enoli: ad elevata temperatura
si ha prevalenza del doppio legame più sostituito
H3C
H
OSi(CH3)3
O
H (CH3)3SiCl, (CH3CH2)3N
H
DMF, 180°C
controllo termodinamico
H3C
+
73%
OSi(CH3)3
H3C
10%
purificabile per distillazione
9
Quando serve il silil enol etere meno sostituito si deve formare l’enolato
meno sostituito
base stericamente ingombrata, bassa temperatura
controllo cinetico
.. N
..
di isopropilammide di litio
Li+
LDA = Lithium diisopropylamide
O
OSi(CH3)3
1. LDA, THF, -78°C H3C
H3C
OSi(CH3)3
H3C
+
2. (CH3)3SiCl
<1%
96%
Selettività e resa aumentano aggiungendo Me3SiCl prima di LDA
Composti in cui il C del gruppo funzionale è legato ad atomi elettronegativi
con UN SOLO LEGAME
stato di ossidazione inferiore ai precedenti
Questi gruppi funzionali si possono ottenere partendo da un livello di ossidazione più
alto, dallo stesso livello di stato di ossidazione o da un livello di ossidazione più basso
ALCOOLI
riduzione
- Da acidi carbossilici e derivati
riducente:
O
1. LiAlH4
C
R
OH
2. H2O
LiAlH4
O
R CH2 OH
C
R
OR'
2. H2O
O
NaBH4 non è abbastanza reattivo, ma
LiAlH4 non è selettivo: riduce tutti i
derivati degli acidi carbossilici
1. LiAlH4
R CH2 OH
C
R
Cl
10
riducenti selettivi:
LiBH4
Ca(BH4)2
riducono esteri (e lattoni), ma
non gli acidi carbossilici.
Più reattivi di NaBH4 (Li+ e Ca2+ sono
acidi di Lewis più forti di Na+)
esempi:
O
C
O
CH2 OH
Ca(BH4)2
2. H2O
C N
C N
70%
(1982)
OH
LiBH4
O
O
OH
2. H2O
45%
(1986)
riducenti selettivi:
B2H6
diborano
riduce solo gli acidi carbossilici in presenza di esteri
(1985)
Meccanismo:
: O : BH3
:O:
+ BH3
C
R
:O:
C
R
OH
OH
H2
complesso
di Lewis
R
B H
C
H
O
O
R
O
B
C
H
H
H
C
O
H2O
R
O
B
H
R CH2 OH
11
riducenti selettivi:
NaBH4, I2
riduce selettivamente gli acidi carbossilici
in presenza di esteri
esempio:
1. NaBH4, THF
O
O
temp. ambiente
OH
O
O
OH
O
2. I2, THF, 0°C
H H
3. HCl acquoso
86%
(1991)
- Da aldeidi e chetoni
O
OH
CH
[H]
C
R'
R
[H] =
H2/Pt
NaBH4
R
R'
R' = H, alchile, arile
solvente: alcool
stesso livello di ossidazione
- Da alogenuri (solfati, solfonati) alchilici primari e OH( sostituzione nucleofila)
R X + NaOH
(KOH)
R OH
NaX
X = Cl, Br, I; -OSO2R;
O
O S
O
CH3
ossidazione
- Da alcheni, per addizione
C C
+ H2 O
H+
C C
H OH
H2O, H+
Hg(OCOCH3)2/H2O e poi NaBH4
trasposizioni
Regiochimica: -OH sul
C più sostituito
12
esempio:
..
Hg(OAc)2
H2O
Hg+
H2O
OAc
NaBH4
O
Hg
OH
O
B2H6 e poi H2O2, OH-
R CH CH2
BH3.THF
OH
Regiochimica: -OH sul
C meno sostituito
R CH2 CH2 BH2
THF
H2O2
2 R CH CH2
(RCH2CH2)3B
R CH2 CH2 OH
NaOH
Per avere selettività maggiore si usano alchilborani stericamente ingombrati
H
9-BBN
B
9-borabiciclo[3.3.1]nonano
H
esempio:
B
THF H2O2, H2O
+
OH
NaOH
O
O
> 77%
(1984)
- Da aldeidi e chetoni con composti organometallici
O
1. RMgX (o RLi)
C
2. H3O+
OH
C
R
Formazione di legame C-C
13
ETERI
stesso livello di ossidazione
- Da alogenuro (solfati, solfonati) alchilici, con alcossidi
(Sintesi di Williamson)
R X +
R'O- Na+
R O R'
NaX
X = Cl, Br, I; -OSO2R;
O
O S
O
CH3
Per avere concentrazioni adeguate di alcossido:
R'OH + NaOH in DMSO (slurry)
NaOH/ H2O/ CH2Cl2 + Bu4N+
esempio:
OH
+ Br
Br
catalizzatore di trasferimento
di fase
(CH3CH2CH2CH2)4N+ HSO4-
+ NaOH
eccesso
Br
O
H2O, 10-25°C
86%
(1977)
ossidazione
- Dagli alcheni, per addizione di alcooli (mercuriazione/demercuriazione)
Hg(OCOCF3)2 in ROH e poi NaBH4
addizione secondo Markownikov
Regiochimica
esempi:
+
OH
+ Hg(OCOCF3)2
O
NaBH4
O
NaOH, 0°C
84%
HgOCOCF3
(1985)
1. Hg(OCOCF3)2, EtOH
2. NaBH4, NaOH, 0°c
80%
O
(1985)
14
OSSACICLOPROPANI
ossidazione
- Da alcheni e peracidi
C
C
+ RCO3H
C
O
C
RCO2H
stesso livello di ossidazione
- Da aloidrine
X
C C
OH
HOX, H+
C C
meccanismo:
esempio:
X
C C
OH
base
O
X
C C
O-
base
C C
C C
X-
O
O
O
O
O
CH2Cl2
+
O
OH
HN
+ HN
O
r.t. o
O
5-idroperossicarbonilftalimmide
all'ebollizione 98-100%
O
OH
(1998)
insolubile
SILIL ETERI
Servono per la protezione temporanea di funzioni alcooliche
ROSi(CH3)3
CH3 CH3
R O Si C CH3
CH3 CH3
(1985)
instabili con nucleofili deboli: reagiscono anche con MeOH,H+
dimetil-terz-butilsilil eteri
stabili in condizioni basiche, riducenti ed ossidanti
- Da trialchilclorosilani
R OH
+
CH3 CH3
CH3 C Si Cl +
CH3 CH3
primario o secondario
terz-butildimetilclorosilano
SELETTIVITA'
N
N
H
H
N+
CH3 CH3
R O Si C CH3
CH3 CH3
N
H
imidazolo
Alcooli primari > alcooli secondari
15
esempio:
OH
OH
O
OH OCH3
CH3 CH3
+ CH3 C Si Cl
CH3
CH3
Et3N, CH2Cl2
H3C
N
H3C
N
OH
3
O
OCH3
3 O
CH3 C Si
CH3
CH3
84%
CH3 O CH2 O
i-PrNH2, CH2Cl2
O
CH3 CH
O
CH3CH
OCH3
+ CH3 O CH2 Cl
O
CH3 CH
3
CH3 C Si
CH3
CH3
O
OCH3
CH3 C Si
CH3
CH3
CH3 O CH2 O
Bu4+ FO
THF, 27°C
(1988)
OH OCH3
71%
ALOGENURI ALCHILICI
- Dagli alcani, per sostituzione radicalica
C H + X2
hν
C X + HX
(X = Cl, Br)
utile solo con composti ad elevata simmetria o con siti che danno
radicali particolarmente stabili
- Dagli alcheni, per addizione di HX
C
C + HX
H
C
X
C
(X = Cl, Br,I)
HCl, HBr, HI anidri
reazione regiospecifica (carbocatione più stabile). Possibilità di trasposizioni
16
HX/H2O + CH3(CH2)14CH2P+(CH2CH2CH2CH3)3 Br-
bromuro di tributilesadecilfosfonio (catalizzatore di trasferimento di fase)
esempio:
+ HBr acquoso
1 : 5
C16H33Bu3P+ Br- (cat.)
Br
115°C
88%
(1980)
- Da composti carbonilici α,β-insaturi
+ H
OH XO
O
H+
esempio:
O
O
OH
X
X
O
0°C
+ HBr + HOCH2CH2OH
O
Br
(1987)
79%
- Da alcooli
CLORURI ALCHILICI
- Da alcooli, con alogenuri di acidi inorganici
[Cl]
[Cl] = SOCl2, PCl3, PCl5
Cl
H 3C +
N C
ClH3 C
H
PCl5 +
H3C
O
C
N H
CH3
R OH
R Cl
reattivo di Vilsmeier
Cl
H3C +
N C
ClH3C
H
(1976)
DMF
17
esempio:
OH
CHCl3
+ POCl3 + DMF
Cl
temp. amb.
90%
(1980)
100% inversione di configurazione. Niente trasposizione
con alcooli primari e secondari
Selettività: alcool primario più reattivo
di secondario (in piridina)
P
+ CCl4
Niente trasposizione
Meccanismo:
..
HO
P
O
+ CCl4
+
(eccesso)
O
O
+
P O
a ricadere
O
Cl-
CHCl3
O
Cl
Ph3PO
O
80%
(1966)
esempio:
CH3
Ph3P, CCl4
CH3 C CH2OH
CH3
CH3
CH3 C CH2 Cl
CH3
Ph3PO
- Da alcooli terziari, con HCl
R
R C OH
R
R
R C Cl
R
HCl
H2O
via carbocatione (possibili trasposizioni); prodotti di eliminazione
- Da 1,2- e 1,3-dioli
O
Cl
C
C
C CH3
H3C
O
CH3
O
cloruro di 2-acetossi-2-metilpropanoile
(Reagente di Moffatt)
cloruro acilico
O
Cl
C
C
C CH3
H3 C
O
CH3
O
estere
18
Da- 1,2-cicloalcandioli cis
Si ottengono trans-1-acetossi-2-clorocicloalcani
(con cicloalcandioli 1,2-trans la reazione non è non utile sinteticamente, perché si forma
una miscela di stereoisomeri)
Meccanismo:
Cl
O
O
OH
C
+
..
C
C CH3
OH H3C
O
CH3
H+
OH
OH
O CH
3
O CH
3
O
H3C
H3C
O
O
H3C
H3C
OH
+
OH
Cl
O
OC
O C
C CH3
O
CH3
H3 C
O
O+
O
OH
Cl-
CH3
+
OH
H3C
H3C
O
C
OH
O
O
CH3
CH3
CH3
+
OH O
C
H3C
H3C OH
O C
O
O
O
Cl
-
Cl
+
68%
La reazione di cloroacetossilazione funziona anche con dioli 1,2 e 1,3 aliciclici
Cl sostituisce di preferenza OH primario
AcO
COCl
OH OH
CH3CN
OH OH OH
15h, t.a.
Cl
OAc OAc
MeONa/THF
0.5h, t.a.
(NaH/THF)
0.5h, t.a.
OH Cl
90%
(+ isomeri)
t-BuMe2SiCl
76%
O
O
OSiMe2t-Bu
84%
19
BROMURI ALCHILICI
- Da alcooli primari e secondari
[Br]
R Br
R OH
[Br] =
PBr3
O
Br
H3 C +
N C
BrH3C
H
PBr3 +
H3C
C
N
H
CH3
Inversione di configurazione (un po' di perdita di purezza ottica). Niente
traposizione
esempio:
Br
H3C +
N C
BrH3C
H
OH
Ph3P, CBr4, 0°C
Con alcooli primari
85%
Br
(CH3)3SiBr
in CHCl3 a 25-50°C
Con alcooli primari, secondari e terziari
esempio:
OH
+ (CH3)3SiBr
Br
93.8% inversione
(1978)
- Da molecole con H allilici
O
N Br , luce di lampada solare
.
.
O
reagiscono entrambe le estremità del sistema coniugato
20
- Da molecole con H benzilici
Br2 in CCl4 La(OCOCH ) cat.
33
rese: 50-90%
lampada fluorescente
esempio:
CH2 Br
CCl4
CH3
+ Br2
Br
La(OCOCH3)3 cat. Br
lampada
65%
(1982)
- Da anioni enolato di esteri
Br
1,2-dibromoetano
Br
Br
Nu-
Br
+ Br-
Nu-Br +
esempio:
H
H
1. Ph3CLi
O
O
DMF
H temp. ambiente
H
H CH
3
H
Br
O
O
Br
O
O
(eccesso)
Br
H CH
3
85%
CH3
(1974)
- Da chetoni, attraverso i silil enol eteri
esempio:
O
1. LDA, THF, -70°C
2. Me3SiCl, Et3N, -70°C
3. NaHCO3
O
NBS
THF, -78°C
Si(CH3)3
O
Br
resa globale: 98%
(1984)
21
IODURI ALCHILICI
- Da alcooli
[I]
R
R OH
[I] =
I
Con alcooli primari,
secondari e terziari
P2I4 in CS2 a 0°C
Rese: 45-90%
N
Ph3P, I2,
N
H
in CH2Cl2, a temp. ambiente
Niente trasposizione
(1990)
Con alcooli primarie secondari; rese elevate; 80% inversione
- Da altri alogenuri (primari)
R X
[I]
(reazione di Finkelstein)
R
I
X = Cl, Br,
O SO2
[I] =
CH3
NaI
in acetone
esempio:
OH
O
O
1. TsCl in piridina, 0°C
I
O
2. NaI, acetone,
temp. amb., 3 ore
O
83%
(1984)
- Da enol silil eteri di chetoni (o enol acetati)
I2 + Cu(NO3)2 (equimolari)
in CH3CN
esempio:
(1991)
O
SiMe3
I2 , Cu(NO3)2
O
I
CH3CN, temp. amb.
100%
22
- Da alcooli
Reazione di Mitsunobu (SN2)
Permette di avere cloruri, bromuri, ioduri e altri gruppi funzionali
O
PX3
O
+
diazenedicarbossilato di etile
C N N C
O CH2 CH3
CH3CH2 O
Meccanismo:
O
..
PX3 +
C N N C
Et O
O Et
R
R'
..
C OH +
R"
Et O
+
O
O
PX3
O-
C N
-N C
O Et
Et O
N
C
O Et
-O
O
+
O
O
C N
C N
C O PX3 +
R'
Et O
Et O
N C
N C
R"
H
H
O Et
O Et
R
O
C N
Et O
PX3
C N
+
PX3
O
+
O
O
PX3 = PPh3, P(OEt)3,
P(NEt2)3
-N C
O Et
O
-
O
N C
H
O Et
C N
R
R'
Et O
+
C O PX3 +
Nu
Z
R"
Nu
R"
Z
=
ZnCl ;
Cl
R C
; RO P O
O
O
O
H
OH
N
(S)
O
O
NH
C
(R)
O
C(CH3)3
O
H; R C
N
N
OR
O
3-amminocardicinato
di terz-butile
THF, 4.5 h; RT
2. H2, Pd/C; 1 equiv. HCl
AcOEt,AcOH, MeOH
2 giorni; RT
H
R'
1. EtO2C-N=N-CO2Et/P(OEt)3
H2N
OH
O
O
R' Et O
O
H;
O
N C
H
O Et
ZnI ;
I
ZnBr ;
O
O
esempio:
Br
C N
+
Nu C
Z
O
R
CH2
N
O
75%
C
OC(CH3)3
(1990)
> 98% ritenzione
23
FLUORURI ALCHILICI
- Da alcooli primari, secondari e terziari
[F] =
R OH
CH3 CH2
N SF3
CH3CH2
R F
dietilammino zolfo trifluoruro
(1988)
rese elevate
inversione di configurazione
niente trasposizione
da -78° a 25°C
esempio:
OH + Et2NSF3
Br
[F]
CH2Cl2
- 78°C
F
Br
61%
Preparazione:
bassa temperatura
..
(CH3CH2)N-Si(CH3)3 + SF
(CH3CH2)N-SF3 + (CH3)3SiF
4
ATTENZIONE
può decomporsi violentemente sopra i 50°C
F F
O
Et2NSF3 reagisce anche con i chetoni
+ Et2NSF3
SELETTIVITA’: alcooli più reattivi di chetoni
- Da cloruri, bromuri, tosilati primari e secondari
R X
[F] =
Bu4N+ F-
[F]
R F
35-66%, 25°÷ 40°C
fluoruro di tetrabutilammonio
(1984)
anidro, senza solvente
Prodotti secondari
alcooli (da tracce di acqua)
alcheni (F- non solvatato è una base forte)
24
- Da enolati di litio (da esteri, ammidi, chetoni)
O
[F]
O
base
F
O
[F] =
N-fluoro-bis(trifluorometilsolfonil)immide
(CF3SO2)2N-F
(1991)
esempio:
O
1. LDA, THF, -78°C
2. si allontana iPr2NH a 20°C
O
O
F
O
3. (CF3SO2)2NF, THF, -80°C
76%
con aldeidi aromatiche
Introduzione del gruppo CF3
O
O
H
+ CHF3
Z
KH
DMF
-45°C, 30min
da -45°C a r.t.
CF3
(1998)
Z
20-60%
AMMINE
- Da alogenuri alchilici ed ammoniaca (o ammine)
Ammine primarie:
R X + NH3 (eccesso)
+
R NH2 + NH4 Cl
SN2
R primario e secondario; X = Cl, Br, I, OSO2R
L'eccesso di NH3 è necessario per ridurre la competizione di RNH2
(oltre che per neutralizzare HCl)
Ammine secondarie:
R NH2 + R' X
(eccesso)
R
R'
+
NH + NH3R Cl
Buone rese con X = solfonato e controllando le condizioni di reazione
ed il modo di addizione
25
esempio:
O
R
O
OCH3
O
R
NH2
S O2
OCH3
O
NH
H2/Pd
+
R
CH2Cl2
OCH3
NH2
NO2
Ammine terziarie:
R
R
NH + R" X
R'
R'
N R" + +NH3RR' Cl-
(eccesso)
- Con alogenuri alchilici e ftalimmide di potassio
Ammine primarie:
(sintesi di Gabriel)
O
O
:
: N K+ + R X
..
H2N CH3
N R
KX
O
O
NH
NH
R NH2 +
O
CH3
CH3
O
(1970)
- Dai chetoni, per amminazione riduttiva
O
[H]
C
R
R'
+ R" NH2
R CH NH R"
R'
R, R', R" = H, alchile, arile
[H] =
H2, Ni
NaBH3CN, EtOH, Δ
cianoboroidruro di sodio
esempio:
O CH3CO2- +NH4 in CH3OH
O
NaBH3CN, KOH
O
N
80%
(1980)
meccanismo:
O
O
O
NH
O
..
+ NH
3
H2O
O
26
NH2
O
[H]
O
O
..N
H2O
O
[H]
:N
H
N
H2O
- Da immine, per riduzione
N
[H] =
C
H2, Pt
R
NaBH3CN, EtOH, Δ
R"
NH R"
[H]
C
R
R'
R'
(1975)
esempio:
NH2 O
+
[H]
+ H2
H
N
N
Pt
HCl
(1974)
65%
- Da alcooli terziari e nitrile, con acidi forti
(reazione di Ritter)
Permette di ottenere ammine con NH2 sul C terziario (non ottenibili con
i metodi precedenti)
H
N
OH
H2SO4 H O
2
+ CH3 C N :
O
AcOH
NH2
KOH
H2O
200°C
77%
(1981)
meccanismo:
OH H2SO4
+
: N C CH3
+
N
C CH3
H2 O
+ OH
2
H2O
N
N
C CH3
H+
OH
C CH3
H
N
O
27
- Da nitrili, per riduzione
R C
[H] =
[H]
N
R CH2NH2
H2, Pt o Pd a 25°C
LiAlH4
NaAlH2(OCH2CH2OCH3)2
esempio:
1. LiAlH4, Et2O
C
N
CH2NH2
2. H2O
i procedimenti di lavorazione vanno seguiti scrupolosamente, perché le
ammine si complessano con i sali di alluminio e non si recuperano facilmente
- Da ammidi, per riduzione
O
R
O
R
C
C
O
[H]
NH2
[H]
N R"
R'
R CH2NH2
R'
R CH2N
R"
R
C
[H]
NH
R'
R'
R CH2NH
[H] = LiAlH4
NaAlH2(OCH2CH2OCH3)2
- Da ossime, per riduzione
R CH N OH
[H]
R CH2NH2
[H] =
H2, Rh su Al2O3
LiAlH4
NaAlH2(OCH2CH2OCH3)2
- Da nitroderivati (soprattutto aromatici) per riduzione
NO2
Y
NH2
[H]
Y
[H] =
H2, Pt o Pd
Fe/HCl o Sn/HCl
In, NH4Cl, EtOH/H2O (1998)
esteri, nitrili, ammidi ed alogenuri acilici non vengono toccati
28
- Da acetati allilici, con catalizzatori di Pd
Gruppi acetossi in posizione allilica possono essere sostituiti con gruppi
amminici, in presenza di catalizzatori di Pd(0).
OAc + RNH2
OAc + RR'NH
P
P
Pd0 cat.
NHR
Pd0 cat.
NRR'
P
CH2
Pd
CH2
CH
P
P
CH2
P
P
Pd
P
CH
Palladio tetrakis(trifenilfosfina)
Pd(PPh3)4
Diastereoselettività
Pd(PPh3)4 legato a polimero
(polistirene)
dipende dalla struttura del catalizzatore
Studiata con derivati del cicloesene
Stereochimica
amminazione sulla stessa faccia del gruppo acetossi
Regiochimica
attacco regioselettivo sul sito meno ingombrato
CO2Me
O
H3C
C
CO2Me
H3C
C
O
Et2NH
THF, Δ
Pd(0) su polistirene
O
O
CO2Me
Et
N
Et
resa 83%
100% cis
CO2Me
Et2NH
THF, Δ
Pd(0) su polistirene
Et
N
Et
resa 86%
100% trans
29
Meccanismo:
Pd(0)
O
H3C
C
CO2Me
CH2OAc
CO2Me
Et2NH
Et
O
Pd
N
Et
Il catalizzatore si avvicina dalla parte opposta rispetto al sostituente, il
nucleofilo si avvicina dalla parte opposta rispetto al gruppo più voluminoso
CH2OAc
OAc + RNH
2
Pd(0) su polistirene
benzene o
benzene/THF
Δ
Pd(0)
CH2OAc
CH2OAc
Pd
NHR
RNH2
CH2
resa: 87% con R =
100% con R =
CH2 CH2
N
H
C legato con 4 legami ad atomi
più elettronegativi
ISOCIANATI (-N=C=O)
- Da ammine primarie
+
Cl
Cl
R NH3 Cl- +
C
O
Δ
solv.
R NH C Cl
O
R N C O
HCl
fosgene
in laboratorio:
Cl
O
Cl
C Cl
Cl C O C
O
Cl
Cl
carbonato di bis-triclorometile
"trifosgene"
solido, p.f. 81-83°C
esempio:
..
NH2
Cl O ClCl
Cl
+
C C
C
Cl O O Cl
CH3
Et2N
N C O
70°C
CH3
+ + (CH3CH2)2NH Cl
82%
(1987)
30
- Da cloruri acilici, attraverso le ammidi
(trasposizione di Curzius)
CH2Cl2
Bu4N+ -OH + NaN3 in H2O
O
O
+
- benzene
+ Bu4N N3
Cl
25°C
Bu4N+ N3benzene
N
N3 50-90°C
C
O
+ N2
86%
(1974)
Meccanismo:
O
R
Cl
O
N3-
+ .. N
.. N N :
R
O
R
..
N
N:
.. N
+
O
R
..
R N C O
..
N:
: N N:
ALCHENI
- Da 1,2-dialogenoalcani, per eliminazione di alogeno
(*)
C
X
C
X
C
C
X = Cl, Br
(*) = Zn attivato
NaI, Δ
applicazione pratica: inversione della configurazione
di un alchene (addizione anti, eliminazione sin)
esempio:
+ Cl2
trans-2-metil-7-ottadecene
Cl
CH2Cl2
- 78°C
Cl
NaI
(1976)
DMF, 153°C
cis-2-metil-7-ottadecene
resa 95%, stereospecificità 100%
31
- Dagli alogenuri (o tosilati) alchilici, per deidroalogenazione
base
C
C
C
X
(β-eliminazione)
C
HX
X = Cl, Br, I, OTs
Problemi: reazione regioselettiva, ma non regiospecifica
CH3
CH3OO SO
2
Per avere
maggiore
selettività
CH3OH
+
36%
64%
gruppo uscente all'estremità della catena e base troppo
voluminosa per funzionare da nucleofilo, con gruppo
uscente voluminoso (tosilato)
Basi:
N
DBN: 1,5-diazabiciclo[4.3.0]-5-nonene
N
N
DBN
N
DBU: 1,8-diazabiciclo[5.4.0]-7-undecene
DBU
DBU
OTs
unico prodotto
benzene
Ma se il gruppo uscente non è terminale:
OTs
DBU
+
benzene
prevalente
Se si aumenta l’ingombro sterico della base si ha prevalenza dell'alchene
meno sostituito
Base: (CH3)3CO-K+
OTs
(CH3)3CO-K+
(CH3)3COH
> 85%
In condizioni di controllo termodinamico prevale l’alchene più stabile
l'alchene più sostituito è più stabile di quello meno sostituito
l'alchene coniugato è più stabile di quello non coniugato
O
CH3OBr
CH3OH
O
unico prodotto
32
buona selettività si ha con:
LiBr + Li2CO3
in DMF
HO
HO
esempio:
Br
O
O
+ LiBr + Li2CO3
O
(1980)
O
H 78%
H
- Dagli alcooli, per disidratazione acido-catalizzata
(β-eliminazione)
problemi: sono possibili miscele di prodotti
sono possibili trasposizioni
esempi:
OH
TsOH
+
+
+
+
toluene
Δ
OH
KHSO4
+ H2 O
Δ
Meccanismo:
OH
+OH
H
2
H+
+
+
H+
H2O
- Dai chetoni, attraverso i selenossidi
B:-
O
BH
[O]
R
O
+ "-Se-OH"
H
Se
O
Se
O
H
Ar
[Se]
-
O
Se
O
O-
O
Ar +
O-
(1984)
eliminazione sin, con stato di transizione ciclico
[Se]
Se
Cl
Se Se
[O]
NaIO4
H2O2
cloruro di fenilselenile
difenildiseleniuro
R3CO3H
33
esempi:
1. LDA
Se
2.
Se Se
H
H2O2
Se +
O
O
O-
25°C
O
O
1. LDA, THF, -78°C
Se Br
O
2.
O
O
O
THF, -78°C
O
CH3 3. H O , CH Cl
2 2
2 2
O
O
O
temp. ambiente, 1 ora
CH3
62%
(1989)
- Dai chetoni, attraverso i tosilidrazoni, mediante eliminazione riduttiva
(reazione di Shapiro)
Meccanismo:
R
R
N
C
O
C
..
+ NH2 NH SO2
CH2R'
CH3
H2O R
N
C
NH SO2Ar
CH2R'
Li+- +
N Li
Li
N SO2Ar
H2O
H
N
N
C
C
C
R
CH R'
R
CH R'
2 R"H R C CH R' ArSO2Li R
CH R' N
2
Li
NH SO2Ar 2 R"Li
CH2R'
prevalgono gli alcheni meno sostituiti
per avere alcheni trisostituiti, si usa LDA invece di BuLi (o MeLi)
esempi:
1. MeLi
2.H2O
N
O
NHTs
1. TsNHNH2
2. MeLi
3. H2O
(1971)
98-99%
100%
(1968)
1. MeLi
N
NHTs 2. H2O
+
80%
9%
(1977)
34
1. TsNHNH2
O
O
2. LDA
3. H2O
O
(1977)
98%
NHTs
O
H
N
H
TsNHNH2
O
EtOH
H
O
a ricadere
H
1. BuLi 2.5 equiv.
THF, 0°÷ 25°C
O
2. H2O
H
H
(1988)
96%
81%
- Dagli alchini, per riduzione catalitica
idrogenazione parziale
R C C R' + H2
cat.:
R
R'
C C
H
H
cat.
Ni colloidale contenente B (Ni P-2)
+
H2 N
alcheni cis
Ni(OCOCH3)2 + NaBH4
NH2
selettività
200:1 per l'isomero cis
esempio:
C C
Na (o Li) in NH3
+ H2
Ni P-2
H2N
HO
Si(CH3)3 KH
-O
- Da fosfinossidi per eliminazione
+
PPh3
H C C H
R
R'
R C C R' + Na
NH3
resa 96%
99.5% cis
R
H
C C
R'
H
(olefinazione di Petersen)
Si(CH3)3
H C C H
R
R'
H C C H
R
R'
-O
NH2
alcheni trans
- Da sililossidi per eliminazione
(1973)
H
H
C C + (CH ) SiO-K+
33
R'
R
(reazione di Wittig)
H
H
+
C C
+ Ph3P-OR'
R
Formazione di legame C-C
35
ALCANI
- Da alcheni ed alchini, per idrogenazione catalitica
R C C R'
cat.:
H2
Pd/C
H2
R CH2 CH2 R'
Pd/CaCO3
R CH CH R'
Pd/C
catalizzatore di Lindlar
PbO
Permette l’idrogenazione selettiva di legami C-C
(doppi e tripli), in presenza di eteri benzilici
esempio:
O
O
H2
O
O
cat. di Lindlar
MeOH
H
O
O
H
(1998)
> 95%
- Da alogenuri alchilici e cuprati
R' X +
R2CuLi
R' R + R2Cu + LiX
Formazione di legame C-C
RIMOZIONE RIDUTTIVA DI GRUPPI FUNZIONALI
- Dal livello di ossidazione più elevato: in due passaggi
R
O
C
LiAlH4
OR'
R CH2OH
TsCl
py
R CH2OTs
[H]
R CH3
py =
N
[H]
NaBH4 in DMSO
alchile primario e secondario
NaBH3CN
alchile primario, benzile
LiBHEt3
alchile primario e secondario
“SUPERIDRURO”
LiAlH4, LiH
alchile primario
LiAlH(OMe)3
alchile primario e secondario
H3B.NHMe2
Ni su grafite
arile
36
esempi:
OH
H
OTs
[H]
+
+
[H] = LiAlH4
54%
25%
19%
LiEt3BH
80%
20%
0%
CH3
OTs
LiEt3BH
O
CH3 CH3
O
THF
92%
HO
H3C
H3C
O
LiEt3BH
H
H OSO2i-Pr
(1990)
OH
O
HO
H3C
H3C
toluene
(1976)
(1988)
90°C
H
H H
72%
OTs
H3B.NNMe2
H
Ni su grafite
K2CO3, DMF
120°C, 6-14 h
Z
Z
(2006)
- Dai chetoni, attraverso gli idrazoni
(reazione di Wolff-Kishner)
Meccanismo:
H
N NH2 + -OH
O + H2N NH2
N
NH
tautomeria
N N H + -OH
H
N N
H
H
- +H O
2
N2
CH2
-OH
esempi:
O
HO
OH
C
O
O
NH2NH2
HO
KOH
OH
C
O
87-93%
O
(1963)
(CH3)3COK
N
NH2
90%
(1962)
37
- Da aldeidi e chetoni, in ambiente acido
(reazione di Clemmensen)
Zn(Hg)
per aldeidi e chetoni aromatici
CH2
O
HCl
OH
OH
esempi:
O
O
Zn(Hg)
(1963)
HCl
O
OH
OH O
CH3
60-67%
H
Zn(Hg)
(1955)
HCl
81-86%
- Dai chetoni, attraverso i tosilidrazoni, per riduzione
O +
H2N NH
SO2
CH3
H 2O
[H]
H
N NH
SO2
CH3
CH2
N NH
N2
O
[H] =
catecolborano
B H
O e poi H2O, AcONa
riduzione selettiva dei tosilidrazoni
in presenza di esteri e nitrili
NaBH3CN
esempi:
N
NHTs
O
1.
O
B H , CHCl3, -10°C
2. AcONa.3H2O, CHCl3, a ricadere
91%
(1975)
O
TsNHNH2, NaBH3CN
O
O
C N
O
O
DMF,
S
O O
C N
; TsOH cat.
75%
(1973)
38
- Da alogenuri alchilici, per riduzione
}
[H] = NaBH CN
3
(Me3Si)3SiH
X = I, Br, OTS
si può effettuare in presenza di estere, ammide,
cloro, nitrile, alchene, aldeide, ossaciclopropano
tris(trimetilsilil)silano
Bu3SnH
(1989)
tributilstannano
X = Cl, Br, I
(RI>RBr>RCl>>RF)
meccanismo:
reazione radicalica a catena, iniziata da 2,2'-azo-di(2-metilpropanonitrile),
AIBN [azoisobutirronitrile]
CH3
CH3
CH3
.
CH3 C N N C CH3
2 CH3 C
C N
C N
C N
N2
CH3 Bu SnH
3
.
CH3 C
C N
Bu3Sn
.
R X
R
Bu3SnX
.
Bu3SnH
Bu3Sn
R H
.
- chetoni, esteri, ammidi, eteri ed alcooli non reagiscono
- è possibile dealogenare parzialmente composti polialogenati
esempi:
CF3
CF3
Bu3SnH
(1963)
Br
H
99%
O
O
Bu3SnH
Cl
Cl
H
Cl
(1970)
84%
Bu3SnH è molto tossico, ma dal 1975 è stato trovato il modo per usarlo in
quantità catalitiche, diminuendone così la pericolosità
Bu3SnH cat., NaBH4
39