Domane e risposte della CHIMICA
Dato un composto sconosciuto come
determinarne la formula?
La chimica analitica risponde,
occupandosi di determinare
formule e strutture
ChimicaGenerale_lezione2
1
Determinazione delle formule
dei composti
DA COMPOSIZIONE PERCENTUALE
FORMULE EMPIRICHE
FORMULE MOLECOLARI
DAI DATI DI MASSA
DA SPETTROMETRIA DI MASSA
ChimicaGenerale_lezione2
2
Composizione percentuale
Un composto puro è formato sempre
dagli stessi elementi combinati nello
stesso rapporto di massa.
ChimicaGenerale_lezione2
3
Composizione %
Si può esprimere come:
n° atomi per molecola (formula)
la massa di ciascun elemento per mole
di composto
la massa di ciascun elemento in rapporto
alla massa totale del campione (% di
massa)
ChimicaGenerale_lezione2
4
Esempio numerico
Abbiamo 1.000 mol o 17.031g di NH3.
Questa massa è composta da 14.007 g di N (1.0000 mol) e 3.0237 g
di H ( 3.0000 mol). Calcoliamo il rapporto di massa di N e H rispetto
alla massa totale
Massa di N per mole di NH3: 1molNx PAN/1molNH3= 14.007 gN/1molNH3
Massa % N in NH3:
Massa di N in 1mol NH3/massa di 1 mol NH3=
=(14.007gN/17.031gNH3 )x 100 = 82.244%
Ovvero
82.244g di N in 100 g NH3
ChimicaGenerale_lezione2
5
Formule empiriche e molecolari
dalla composizione %
Se conosciamo
gli elementi presenti in un campione e
la massa di ciascun elemento in una
determinata quantità di campione
→ possiamo ricavare la formula empirica
del composto.
ChimicaGenerale_lezione2
6
Strategia
1.Convertire composizione % in massa
2.Convertire la massa in moli
3.Trovare il rapporto molare
4.Dal rapporto molare si risale alla
formula
ChimicaGenerale_lezione2
7
Esempio: l' idrazina
La composizione % di un campione di idrazina è: 87.42%N e 12.58%H. In 100g di
idrazina avremo 87.42g di N e 12.58g di H.
Le moli in 100g di campione saranno
MoliN:
87.42 gN/14.007 g/mol= 6.241 molN
Moli H:
12.58 gH/1.0079 g/mol= 12.48 molH
Rapporto molare dei componenti: 12.48 molH/ 6.241 molN=
= 2.00 molH/1.00 molN →NH2 formula empirica
Per determinare la formula molecolare abbiamo bisogno di
determinare sperimentalmente la massa molare
per l'idrazina la massa molare è 32.0 g/mol, il doppio della massa di NH2
→la formula molecolare è N2H4
ChimicaGenerale_lezione2
8
Determinazione della formula
dai dati di massa
In laboratorio si può:
1.Far reagire quantità note di elementi per
ottenere una determinata quantità di
prodotto
2.Decomporre una quantità nota di
composto per ottenere frazioni di
composizione nota
ChimicaGenerale_lezione2
9
Esempio 1
Ga si combina con O e si ottiene ossido di gallio GaxOy.
Se facciamo reagire 1.25g di Ga e otteniamo 1.68g di
GaxOy qual'è la formula del prodotto?
1.68gprodotto-1.25gGa = 0.43 gO
Moli Ga:
1.25gGa /(69.72 g/mol)= 0.0179 molGa
Moli O:
0.43gO /(16.0 g/mol)= 0.027 molO
Moli O/moli Ga : 0.027 molO/ 0.0179 molGa=1.5/1.0
Ovvero 3 moli O e 2 moli Ga→la formula è Ga2O3
ChimicaGenerale_lezione2
10
Esempio 2
Nix(CO)y (l) → x Ni(s) + y CO(g)
Le masse dei prodotti di decomposizione,
Ni(s) e CO(g), possono essere misurate e
convertite in moli: il rapporto risulta essere
1:4 e consente di ricavare la formula del
composto
Ni(CO)4 (l) → Ni(s) + 4 CO(g)
ChimicaGenerale_lezione2
11
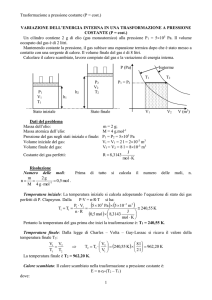
La Stechiometria
La stechiometria di una reazione
chimica relaziona le masse di reagenti
e prodotti tenendo conto della legge di
conservazione della massa.
ChimicaGenerale_lezione4
12
Tabella delle quantità
Equazione:
P4(s) + 6Cl2(g) → 4PCl3 (l)
Quantità iniziale (mol)
1.00 6.00
Variazione (mol)
-1.00 -6.00
Quantità finale (mol)
0
0
+4.00
0
ChimicaGenerale_lezione4
4.00
13
Se invece di 1 mole ne avessimo 0.0100 di P4
(1.24g) serviranno sempre sempre un numero di
moli di Cl2 6 volte maggiore, e si otterrebbero
0.0400 moli di PCl3 (5.49g)
L'unica condizione da rispettare è che le moli di
Cl2 siano 6 volte le moli di P4
ChimicaGenerale_lezione4
14
Suggerimenti
GRAMMI REAGENTE A
GRAMMI PRODOTTO B
X 1 molA/gA
X gB/molB
MOLI REAGENTE A
MOLI PRODOTTO B
X (xmol prodottoB/y mol reagente A)
ChimicaGenerale_lezione4
15
- Qual'è la massa di Cl2 necessaria per reagire
completamente con 1.45 g di fosforo?
- Quale massa di PCl3 si ottiene?
1.Scrivere equazione bilanciata
P4(s)+6 Cl2(g) → 4 PCl3(l)
2.Calcolare le moli dalle masse
da moli P4 calcoliamo massa P4
1.45g / 123.9g/mol= 0.0117 mol P4
3.Usare il fattore stechiometrico
dall'eq. Bilanciata sappiamo che servono 6 volte le moli di P4
0.0117mol X 6= 0.0702 mol Cl2 richieste
4. Calcolare le masse dalle moli
0.0702 mol x 70.91 g/mol = 4.98 g Cl2
ChimicaGenerale_lezione4
16
- Quale massa di PCl3 si ottiene?
Sfrutto la legge di conservazione delle masse
1.Dalla precedente parte sappiamo che le masse dei reagenti
sono 1.45g P4(s) e 4.98g di Cl2(g) , quindi un totale di 6.43g
2.per la legge di conservazione delle masse avremo 6.43g di
prodotto PCl3(l)
Si può sfruttare anche il coefficiente stechiometrico
3.Si calcolano le moli di prodotto
0.0117 mol P4 x 4= 0.0468 mol PCl3
4.Si convertono le moli in massa
5.0.0468 mol x 137.3 g/mol = 6.43 g PCl3
ChimicaGenerale_lezione4
17
Reagente limitante
REAGENTE LA CUI QUANTITA'
DETERMINA O LIMITA
LA QUANTITA' DI PRODOTTO
CHE SI FORMA
ChimicaGenerale_lezione4
18
Esempio 1
4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(l)
Se miscele uguali quantità di reagenti (750.0g di
ciascuno) in questa miscela abbiamo il corretto
rapporto stechiometrico o uno dei reagenti è in
difetto?
Quanto NO si formerà se la reazione va a
completamento?
E quanto del componente in eccesso avrò dopo
che si è formata la massima quantità di NO?
ChimicaGenerale_lezione4
19
Trovare le moli dei reagenti e capire
chi è il reagente limitante
750.0g NH3 /17.03 g/mol = 44.0 mol NH3
750.0g O2 / 32.00 g/mol = 23.4 mol O2
Per capire chi è il reagente limitante esaminare
se il rapporto tra moli rispetta il rapporto
stechiometrico dei reagenti dell'eq. bilanciata da
Da eq.bilanciata: 5/4=1.25 1.25 molO2/1molNH3
Da rapp.moli 23.4/44.0=0.532mol O2/1 mol NH3
L'ossigeno è il reagente limitante!
ChimicaGenerale_lezione4
20
Calcolare la massa del prodotto
Una volta trovato il reagente limitante si può
calcolare la massa del prodotto atteso sulla
base del dei loro coefficienti stechiometrici
mol O2 x (4/5) x PMNO = 23.4 x (4/5) x 30.01 =
562 g NO
ChimicaGenerale_lezione4
21
Calcolare la massa del reagente in
eccesso
In questo esempio il reagente è l'ammoniaca.
Calcoliamo quanta ne rimane dopo aver consumato
tutto l'altro reagente, l'ossigeno.
Le moli consumate: 23.4 mol O x (4 mol NH
2
3
richieste/5 molO2 ) = 18.8 molNH3 richieste
Moli disponibilii-moli richieste= moli in eccesso
44.0-18.8=25.2 mol NH3 in eccesso
25.2.mol NH3 x 17.03 g/mol= 429 g NH3 in eccesso
ChimicaGenerale_lezione4
22
Tabella delle quantità
Equazione
Quantità iniziale(mol)
Variazione (mol)
A fine reazione (mol)
4 NH3(g)+5 O2(g) → 4 NO(g)+6 H2O(l)
44.0
-(4/5) (23.4)
25.2
23.4
- (23.4)
0
0
+(4/5) (23.4) +(6/5) (23.4)
0
ChimicaGenerale_lezione4
18.8
28.1
23
Esempio 2
CO(g) +2 H2(g)
→ CH3OH(l)
se faccio reagire una miscela di 356g
CO e 65.0g H2
Quale è il reagente limitante?
Che massa di metanolo viene prodotta?
Che massa del reagente in eccesso
rimane?
ChimicaGenerale_lezione4
24
CO(g) +2 H2(g)
→ CH3OH(l)
356gCO / 28.01g/mol= 12.7 mol CO
65.0gH2 / 2.016 g/mol= 32.2.mol H2
Rapporto moli 32.2/12.7=2.54 mol H2/1molCO
Rapp. stech. 2H2:1CO
12.7 mol CO x(1mol CH3OH formato/1mol CO disponibile)
CO è reagente limitante!
x 32.04 g/molCH3OH=407 g CH3OH
reagente in eccesso:
25.4 mol H2 necess
12.7 mol COx ( 2molH2/1molCO) =
32.2-25.4= 6.8 mol H2 o 14g di H2
ChimicaGenerale_lezione4
25
Tabella delle quantità
Equazione
CO(g) +2 H2(g)
→ CH3OH(l)
Quantità iniziale(mol)
12.7
32.2
Variazione (mol)
-12.7
2x( -12.7)
A fine reazione (mol)
0
6.8
ChimicaGenerale_lezione4
0
+12.7
12.7
26
Resa percentuale
RESA %=
(RESA EFFETTIVA/RESA TEORICA) X 100
ChimicaGenerale_lezione4
27
Analisi Quantitativa di
una miscela
Si fa reagire sostanza
presente in quantità
incognita con quantità
nota di un'altra;
conoscendo
stechiometria reazione
si risale alla quantità
incognita
Si trasforma un
materiale di
composizione incognita
in una o + sostanza a
composizione nota e se
ne determinano le moli
relative e poi si risale a
quella del composto
iniziale
ChimicaGenerale_lezione4
28
I tipo
Determinazione quantitativa dell' acido acetico in
aceto
CH3CO2H(aq)+NaOH(aq)→CH3CO2Na(aq)+H2O(l)
Si valuta il numero di moli esatto di NaOH impiegati
nella reazione e si calcola in numero di moli di acido
presenti
ChimicaGenerale_lezione4
29
II tipo
Analisi della thenardite (è soprattutto Na2SO4)
macinarne quantità nota e lavarlo in acqua per
solubilizzare Na2SO4
Tratto la soluzione con BaCl2 e precipito il solfato di
bario
Na2SO4(aq) + BaCl2(aq) → BaSO4(s)+ 2NaCl(aq)
Lo raccolgo su filtro asciugo e peso, dalle moli di
BaSO4 risalgo a quelle di Na2SO4
ChimicaGenerale_lezione4
30
Determinare la formula di un
composto dai suoi prodotti
di combustione
La formula empirica di un composto si
può ricavare dalla sua composizione %
Un metodo per ottenere questi dati è
l'analisi per combustione
In questa tecnica ogni elemento del
composto (che brucia completamente
con O2) si combina con l'ossigeno per
dare l'ossido appropriato
ChimicaGenerale_lezione4
31
CH4(g)+2O2(g) → CO2(g)+2H2O(l)
Bruciando metano in presenza di
ossigeno ottengo biossido di carbonio
(anidride carbonica) e acqua
Le separo e ne determino le masse
Da queste masse calcolo le moli di C e H
in CO2 e in H2O
Risalgo poi al loro rapporto nel campione
originale: formula empirica!
ChimicaGenerale_lezione4
32
CH4(g)+2O2(g) → CO2(g)+2H2O(l)
gH2O
Mol
H2O
2xmol H/1mol H2O
mol H /
mol C
CxHy
gCO2
Mol
CO2
ChimicaGenerale_lezione4
1xmol C/1mol CO2
33
Misura delle concentrazioni di
composti in soluzione
la MOLARITA'
MOLARITA' di x (cx) =
x moli di soluto(mol)/volume soluz.(l)
Mette in relazione volume della soluzione,
espressa in litri,
con le moli della sostanza
ChimicaGenerale_lezione4
34
N.B.!
Si parla di numero di moli di soluto per litro
si soluzione, non solvente!
Per avere una concentrazione 1M devo
sciogliere il soluto, prima in una piccolo
volume di solvente, poi arrivare ad un
volume totale della soluzione di 1 litro.
ChimicaGenerale_lezione4
35
esempio
Si prepari 2.00L di soluzione 1.5 M di Na2CO3
Quanto Na2CO3 dobbiamo pesare?
2.00L x 1.5M = 3.00 mol Na2CO3
Quindi
3.00x 106.0g/mol= 318 g Na2CO3
ChimicaGenerale_lezione4
36
Il pH
Si può pensare al pH come ad una scala di
concentrazione di acidi e basi
+
pH = -log[H3O ]
ChimicaGenerale_lezione4
37
Stechiometria delle reazioni
in soluzione
Grammi reagente A
Grammi prodotto B
moli reagente A
moli prodotto B
X Cmolarità A
x(Moli B/moli A)
volume reagente A
X(1/ Cmolarità A)
volume prodotto B
ChimicaGenerale_lezione4
38
Zn(s) + 2 HCl(aq) → 2ZnCl2(aq)+ H2(g)
Che volume, in ml, di HCl 2.50M è necessario
per far reagire completamente 11.8 g di Zn?
11.8gZn/ 65.39 g/mol= 0.180 mol Zn
0.180 x (2mol HCl/1molZn)= 0.360 mol HCl necess.
0.360 mol HCl x (1.00Lsoluz/2.50molHCl)= 0.144 L HCl
= 144 ml HCl
ChimicaGenerale_lezione4
39
Titolazioni acido -base
ChimicaGenerale_lezione4
40
Esempio
Un campione impuro di acido ossalico del
peso di 1.034g viene sciolto in acqua e si
aggiungono poche gocce di indicatore. Per
raggiungere il punto di equivalenza sono
necessari 34.47 ml di soluzione acquosa di
soda 0.485 M.
Qual'è la massa di acido ossalico nel
campione e le sua % in peso?
ChimicaGenerale_lezione4
41
H2C2O4(aq)+NaOH(aq)→Na2C2O4(aq)+2H2O(l)
Moli NaOH:
CNaOH x VNaOH= 0.485 mol/L x 0.03447 L= 0.0167 mol
NaOH
Moli acido ossalico e massa
0.0167 mol NaOH x (1 mol H2C2O4/2 mol NaOH)=
0.00836 mol H2C2O4
0.00836 mol H2C2O4x 90.04 g/mol= 0.753g H2C2O4
quindi 0.753g H2C2O4/1.034g campione x 100 =
72.8% di H2C2O4
ChimicaGenerale_lezione4
42
Spettrofotometria
La spettrofotometria consente di mettere in
relazione la luce assorbita da un campione
con la sua concentrazione
Poiché ogni sostanza assorbe o trasmette
solo determinate lunghezze d'onda
dell'energia radiante ciò consente analisi sia
di tipo qualitativo che quantitativo
ChimicaGenerale_lezione4
43
Schema di una spettrofotometro di assorbimento
ChimicaGenerale_lezione4
44
Trasmittanza e Assorbanza
La trasmittanza è il rapporto tra intensità
di luce trasmessa e intensità di luce
incidente
T=P/Po
L' Assorbanza è il logaritmo negativo
della trasmittanza
A= -log T = -log(P/Po)
ChimicaGenerale_lezione4
45
a) La soluzione + concentrata assorbe di+ e
appare + colorata
b) La quantità di luce assorbita dipende dal
cammino ottico: stesse conc appaiono diverse
se hanno diversi cammini ottici
ChimicaGenerale_lezione4
46
L'Assorbanza di un campione aumenta
all'aumentare della sua concentrazione
L'Assorbanza di un campione cresce con il
crescere del cammino ottico (percorso che
compie la luce nel campione)
ChimicaGenerale_lezione4
47
La legge di Lambert Beer
A ∝ cammino ottico (l) x concentrazione (c)
A= ε x l x c
ChimicaGenerale_lezione4
48