LA QUANTITÀ CHIMICA
Legge di combinazione dei volumi
formulata da Gay-Lussac
Il rapporto tra i volumi di gas che reagiscono tra
loro è espresso da numeri interi e piccoli.
Principio di Avogadro
Volumi uguali di gas diversi, nelle medesime
condizioni di pressione (p) e temperatura (T),
contengono lo stesso numero di molecole.
RICORDA
Atomo: la più piccola parte di un elemento
chimico che conserva le proprietà chimiche
dell'elemento stesso. Un atomo è formato da
costituenti subatomici (elettroni, protoni e
neutroni). Due o più atomi formano una
molecola.
http://www.youtube.com/watch?v=Q4KI1FA4YJ0
Molecola: insieme di due o più atomi dello
stesso elemento o di elementi diversi uniti da
un legame chimico.
ATOMO
MOLECOLA
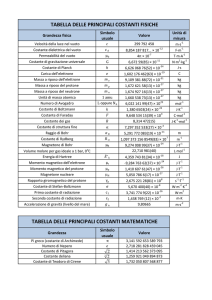
Massa atomica
La massa atomica (MA) di un elemento è il
rapporto tra la massa assoluta espressa in Kg
dell’elemento stesso e la dodicesima parte della
massa assoluta dell’isotopo 12C, che equivale a
1,661∙10-27Kg.
La dodicesima parte della massa di 12C viene
chiamata unità di massa atomica (u.m.a.)
u= 1,661∙10-27Kg
Esempi
• MAHg = 200,6
MAO = 16,00
• MAC = 12,01
MAAu = 197,0
Massa molecolare
La massa molecolare (MM) è la somma delle masse
atomiche degli elementi che compaiono nella
formula della molecola.
Esempi
MMacqua = 2∙ MAH + MAO = 2∙ 1,008 + 16,00 = 18,016
MM di NH3 = MAN + 3∙ MAH =
= 14,01 + 3∙1,008 = 17,034
(Es. pag. 91,)
La mole
Una mole (mol) è la quantità di sostanza che
contiene un numero di particelle elementari
uguale al numero di atomi presenti in 12 g di
12C.
Massa molare
La massa molare (M) di una sostanza è uguale
alla sua massa atomica o molecolare espressa in
g/mol.
(es. pag. 93)
La costante di Avogadro
La costante di Avogadro (Na) rappresenta il
numero di particelle elementari contenute in
una mole.
Na = 6,023∙1023 mol-1
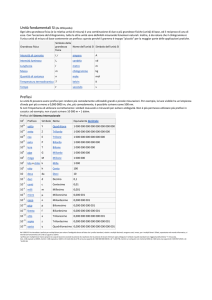
Calcoli con le moli
𝒎
𝒏=
𝑴
n= numero di moli (mol)
m= massa del campione (g)
M= massa molare (g/mol)
Formule inverse:
• m= n∙M ottengo massa del campione (g)
• 𝑀=
𝑚
𝑛
ottengo massa molare (g/mol)
Esempi
(es. pag. 95)
• Calcola il numero di moli contenute in 38,2 g
di glucosio, C6H12O6
MMglucosio = 6∙MAC + 12∙MAH + 6∙MAO = 180,16
Mglucosio = 180,16 g/mol
32,8
g
n=
= 0,212 mol
180,16 g/mol
Volume molare
In condizioni standard, T= 0°C e p=1 atm, il
volume molare (Vm) dei gas è 22,4 L.
Quanto studiato ci serve per…