Capitolo 429 Disturbi della frequenza e del ritmo cardiaci ■ 1687
CONTRACCEZIONE
Tabella 428.6 ASPETTI CHE RICHIEDONO UNA COORDINAZIONE
Una parte importante dell’assistenza degli adulti affetti da cardiopatie
congenite consiste nel fornire o rendere accessibile un servizio di
consulenza sulla contraccezione. Purtroppo, è disponibile un numero
limitato di dati relativi alla sicurezza di varie tecniche di contraccezione nei pazienti affetti da cardiopatie congenite dell’adulto (ACHD).
Le pillole contraccettive orali a base di estrogeni possono essere utilizzate da molti pazienti affetti da ACHD, ma non sono raccomandate
per quelli con ACHD a rischio di tromboembolia, ad esempio gli
individui con cianosi, precedente intervento di Fontan, fibrillazione
atriale o ipertensione arteriosa polmonare. Questa forma di terapia
contraccettiva può inoltre alterare il controllo dell’anticoagulazione.
Mentre sono leggermente meno efficaci i contraccettivi a base di una
combinazione di estrogeni/progesterone, il medrossiprogesterone,
i preparati contenenti soltanto progesterone e il levonorgestrel
sono buone opzioni per la maggior parte dei pazienti affetti da
ACHD. Tuttavia, possono causare ritenzione di liquidi e, di conseguenza, devono essere utilizzate con cautela nei pazienti con scompenso cardiaco. Questi farmaci sono stati inoltre associati a depressione
e spesso a sanguinamenti improvvisi. La legatura delle tube, benché
sia il metodo contraccettivo più sicuro, può essere una procedura
ad alto rischio nei pazienti con CHD complessa o in quelli affetti da
ipertensione polmonare. La sterilizzazione isteroscopica (Essure) può
essere un’opzione ragionevole per i pazienti ad alto rischio. In passato,
i dispositivi intrauterini venivano saltuariamente utilizzati nei pazienti
cardiopatici, a causa del rischio associato di batteriemia, malattia
infiammatoria pelvica ed endocardite. I dispositivi intrauterini più
recenti, sembrano tuttavia essere sicuri ed efficaci, e stanno diventando rapidamente una delle forme contraccettive più comunemente
utilizzate nella popolazione affetta da ACHD.
DELLE CURE TRA IL CARDIOLOGO E IL MEDICO DI BASE
PASSAGGIO DALL’ADOLESCENZA ALL’ETÀ ADULTA
Ormai è generalmente riconosciuto che, nel contesto dell’acquisizione dell’indipendenza, adolescenti e giovani adulti debbano
imparare ad affrontare i propri problemi medici con lungimiranza
e autonomia di giudizio. Per i cardiopatici in età pediatrica, il
processo di transizione deve iniziare nella prima adolescenza e
dovrebbe essere incoraggiato sia dal medico di base sia dal pediatra
cardiologo, ai quali spetta individuare un appropriato programma
per adulti con cardiopatie congenite verso cui possa essere effettuata la transizione nel momento opportuno (Tab. 428.6).
Un processo di transizione condotto con successo comprende
i seguenti elementi:
Sezione 4
• Sviluppo di un programma di transizione scritto, che dovrebbe
iniziare entro e non oltre i 14 anni di età.
• Poiché gli adolescenti e i giovani adulti sono spesso all’oscuro
dei dettagli della propria diagnosi e anamnesi cardiologica, una
relazione medica completa, concisa e portatile, che contenga tutti
gli aspetti pertinenti delle terapie cardiologiche, dovrebbe essere
messo a disposizione degli adolescenti e delle loro famiglie, e
pronto per essere trasmesso alla struttura finale dove il paziente
diventato adulto riceverà le cure mediche.
• Il medico di base e il cardiologo devono tenere presenti i problemi
medici peculiari dell’adolescenza, in quanto hanno ripercussioni
sull’apparato cardiovascolare. Oltre ai problemi medici, andrebbero
discussi con gli adolescenti e le loro famiglie l’istruzione, la programmazione della formazione professionale, argomenti di interesse
psicosociale e problemi riguardanti l’accesso alle cure mediche.
• I giovani adulti hanno la tendenza a sottrarsi alle cure mediche
a causa di una mancanza di istruzione, di rifiuto della propria
malattia o di difficoltà di accesso al sistema sanitario. Un obiettivo
critico del processo di transizione consiste pertanto nell’identificare la sede appropriata dove il paziente possa proseguire le cure
mediche e nell’assicurare la conservazione della documentazione
medica e la continuità delle cure per il giovane adulto. I giovani
adulti affetti da una cardiopatia congenita possono essere curati
nell’ambito di un programma o di una struttura medica pediatrici,
oppure in un centro specializzato per adulti con cardiopatie congenite. Le criticità sono la continuità delle cure, la preparazione
del paziente e il suo coinvolgimento in questo iter.
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
ARITMIE CARDIACHE
Capitolo 429
Disturbi della frequenza
e del ritmo cardiaci
George F. Van Hare
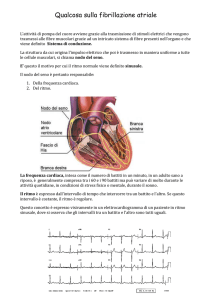
Il termine “aritmia” indica un disturbo della frequenza o del ritmo
cardiaci, che può determinare un rallentamento, un’accelerazione o
irregolarità della frequenza. Tali anomalie possono essere transitorie
o permanenti, congenite o acquisite, o provocate da una tossina o da
farmaci. Possono inoltre essere conseguenti alla correzione chirurgica
di una cardiopatia congenita, il risultato di malattie metaboliche congenite dei mitocondri o secondarie a un’infiammazione fetale come
avviene in caso di lupus eritematoso sistemico (LES) materno. Il ri-
C0100.indd 1687
Profilassi antibiotica per l’endocardite
Farmaci e interazioni farmacologiche
Anticoagulazione in presenza di protesi valvolari
Esercizio fisico e partecipazione all’attività sportiva
Programmazione dell’istruzione e della formazione professionale
Contraccezione e gravidanza
Uso di droghe, consumo di alcol e tabacco
Programmazione di interventi chirurgici non cardiaci
Problemi riguardanti l’anestesia
Nuovi sintomi o malattie acute
Problemi medici coesistenti
Viaggi
schio principale di tutte le aritmie (rallentamento o accelerazione) è la
riduzione della gittata cardiaca o la degenerazione in un’aritmia più
grave come la fibrillazione ventricolare. Queste complicanze possono
provocare sincope o morte improvvisa. Quando un paziente presenta
un’aritmia è importante stabilire se questo particolare ritmo provocherà
sintomi gravi o degenererà in una condizione potenzialmente letale. Le
anomalie del ritmo, quali battiti prematuri atriali e ventricolari isolati,
sono comuni nei bambini non affetti da cardiopatie e, nella stragrande
maggioranza dei casi, non pongono a rischio il paziente.
Per il trattamento delle aritmie negli adulti sono disponibili
numerosi agenti farmacologici efficaci, molti dei quali non sono
tuttavia stati studiati in modo approfondito nei bambini. Data
l’insufficienza di dati in merito a farmacocinetica, farmacodinamica ed efficacia nella popolazione pediatrica, la scelta dell’agente
adeguato viene spesso effettuata in modo empirico. Fortunatamente, la maggior parte dei disturbi del ritmo nei bambini può essere
controllata in modo affidabile con un solo farmaco (Tab. 429.1).
9/29/12 2:22:13 AM
1688 ■ Parte XX Apparato cardiovascolare
Tabella 429.1 FARMACI ANTIARITMICI COMUNEMENTE UTILIZZATI NEI PAZIENTI PEDIATRICI, DIVISI PER CLASSE DI APPARTENENZA
FARMACO
INDICAZIONI
POSOLOGIA
EFFETTI COLLATERALI
CLASSE IA: INIBISCONO I CANALI RAPIDI DEL NA+, PROLUNGANO LA RIPOLARIZZAZIONE
Chinidina
SVT, fibrillazione atriale,
Orale: 30-60 mg/kg/24 ore divisi
Nausea, vomito, diarrea, febbre,
flutter atriale, VT. Nel
ogni 6 ore (solfato) o ogni 8 ore
cinconismo, prolungamento del
flutter atriale è necessario
(gluconato)
QRS e del QT, blocco nodale
somministrare per primo
Adulti, 10 mg/kg/die divisi ogni 6 ore
AV, sincope con asistolia,
un farmaco bloccante
Dose massima: 2,4 g/24 ore
trombocitopenia, anemia
del nodo AV (digossina,
emolitica, LES, offuscamento
verapamil, propranololo)
visivo, convulsioni, reazioni
per prevenire la
allergiche, esacerbazione
conduzione 1:1
di paralisi periodica
Procainamide SVT, fibrillazione atriale,
Orale: 15-50 mg/kg/24 ore divisi ogni
Prolungamento degli intervalli
flutter atriale, VT
4 ore
PR, QRS e QT, anoressia,
Dose massima: 4 g/24 ore
nausea, vomito, rash,
ev: 10-15 mg/kg in 30-45 min (carico)
febbre, agranulocitosi,
seguiti da 20-80 g/kg/min
trombocitopenia, anemia
Dose massima: 2 g/24 ore
emolitica Coombs-positiva, LES,
ipotensione, esacerbazione
di paralisi periodica, proaritmia
Disopiramide SVT, fibrillazione atriale,
Orale: <2 anni: 20-30 mg/kg/24 ore
Effetti anticolinergici, ritenzione
flutter atriale
divisi ogni 6 ore o ogni 12 ore (forma
urinaria, offuscamento
a lunga durata di azione); 2-10 anni:
visivo, secchezza delle fauci,
9-24 mg/kg/24 ore divisi ogni 6 ore
prolungamento degli intervalli
o ogni 12 ore (forma a lunga durata
QT e QRS, tossicità epatica,
di azione); 11 anni: 5-13 mg/kg/24
effetti inotropi negativi,
ore divisi ogni 6 ore o ogni 12 ore
agranulocitosi, psicosi,
(forma a lunga durata di azione)
ipoglicemia, proaritmica
Dose massima: 1,2 g/24 ore
CLASSE IB: INIBISCONO I CANALI RAPIDI DEL NA+, ACCORCIANO LA RIPOLARIZZAZIONE
Lidocaina
VT, VF
ev: 1 mg/kg ripetibile ogni 5 min per 2 Effetti sul SNC, confusione,
volte, seguito da 20-50 g/kg/min
convulsioni, blocco AV di
(dose massima: 3 mg/kg)
grado elevato, asistole, coma,
parestesie, insufficienza
respiratoria
Mexiletina
VT
Orale: 6-15 mg/kg/24 ore divisi ogni
Disturbi gastrointestinali, rash
8 ore
cutaneo, disturbi neurologici
Fenitoina
Intossicazione digitalica
Orale: 3-6 mg/kg/24 ore divisi ogni
Rash, iperplasia gengivale, atassia,
12 ore
letargia, vertigini, tremori,
Dose massima: 600 mg
anemia macrocitica, bradicardia
ev: 10-15 mg/kg in un’ora (carico)
se iniettata in bolo rapido
CLASSE IC: INIBISCONO I CANALI DEL NA+
Flecainide
SVT, tachicardia atriale, VT
Orale: 6,7-9,5 mg/kg/24 ore divisi
Offuscamento visivo, nausea,
ogni 8 ore
riduzione della contrattilità,
Nei bambini più grandi, 50-200 mg/
proaritmia
m2/die divisi ogni 12 ore
Propafenone SVT, tachicardia atriale,
Orale: 150-300 mg/m2/24 ore divisi
Ipotensione, riduzione della
flutter atriale, VT
ogni 6 ore
contrattilità, tossicità epatica,
parestesie, cefalea, proaritmica
CLASSE II: -BLOCCANTI
Propranololo SVT, QT lungo
Orale: 1-4 mg/kg/24 ore divisi ogni
Bradicardia, perdita della
6 ore
concentrazione, problemi
Dose massima 60 mg/24 ore
di rendimento scolastico,
ev: 0,1-0,15 mg/kg in 5 min
broncospasmo, ipoglicemia,
Dose ev massima: 10 mg
ipotensione, blocco cardiaco,
scompenso cardiaco congestizio
Atenololo
SVT, QT lungo
Orale: 0,5-1 mg/kg/24 ore una volta
Bradicardia, perdita di
al giorno o divisi ogni 12 ore
concentrazione, problemi
di rendimento scolastico
CLASSE III: PROLUNGANO LA RIPOLARIZZAZIONE
Amiodarone
SVT, JET, VT
Orale: 10 mg/kg/24 ore in 1-2 dosi
per 4-14 giorni; ridurre a 5 mg/
kg/24 ore per diverse settimane;
in assenza di recidive ridurre a 2,5
mg/kg/24 ore
ev: 2,5-5 mg/kg in 30-60 min,
ripetibili 3 volte, poi 2-10 mg/kg/24
ore in infusione continua
Ipotiroidismo o ipertiroidismo,
trigliceridi elevati, tossicità
epatica, fibrosi polmonare
INTERAZIONI
FARMACOLOGICHE
RANGE
TERAPEUTICO
Aumenta i livelli plasmatici
di digossina, se
somministrata con
warfarin può aumentare
il PPT
2-6 g/mL
Tossicità aumentata
dall’amiodarone e dalla
cimetidina
4-8 g/mL
con NAPA
<40 g/mL
2-5 g/mL
Propranololo; la cimetidina
ne aumenta la tossicità
1-5 g/mL
Cimetidina
0,8-2 g/mL
Amiodarone, anticoagulanti
orali, cimetidina,
nifedipina, disopiramide
ne aumentano la tossicità
10-20 g/mL
L’amiodarone aumenta
la tossicità
0,2-1 g/mL
Aumenta i livelli di digossina
0,2-1 g/mL
L’utilizzo in associazione
a disopiramide o a
verapamil può ridurre la
funzione ventricolare
L’utilizzo in associazione
a disopiramide o a
verapamil può ridurre
la funzione ventricolare
Digossina (aumenta i livelli),
flecainide, procainamide,
chinidina, warfarin,
fenitoina
0,5-2,5 mg/L
(segue)
C0100.indd 1688
9/29/12 2:22:16 AM
Capitolo 429 Disturbi della frequenza e del ritmo cardiaci ■ 1689
Tabella 429.1
FARMACI ANTIARITMICI COMUNEMENTE UTILIZZATI NEI PAZIENTI PEDIATRICI, DIVISI PER CLASSE DI APPARTENENZA – seguito
FARMACO
INDICAZIONI
CLASSE IV: VARIE
Digossina
SVT (non WPW), flutter
atriale, fibrillazione
atriale
Verapamil
SVT (non WPW)
Adenosina
SVT
INTERAZIONI
FARMACOLOGICHE
POSOLOGIA
EFFETTI COLLATERALI
Orale/carico:
Prematuri: 20 g/kg
Neonati: 30 g/kg >
6 mesi: 40 g/kg
Somministrare ½ dose totale seguita
da ¼ ogni 8-12 ore × 2 dosi
Mantenimento: 10 g/kg/24 ore divisi
ogni 12 ore
Dose massima: 0,5 mg
ev: ¾ della dose orale
Dose massima: 0,5 mg
Orale: 2-7 mg/kg/24 ore divisi ogni
8 ore
Dose massima: 480 mg
ev: 0,1-0,2 mg/kg ogni 20 min × 2
dosi
Dose massima: 5-10 mg
PAC, PVC, bradicardia, blocco
AV, nausea, vomito, anoressia,
prolungamento dell’intervallo
PR
Chinidina
Amiodarone e verapamil
ne aumentano i livelli
Bradicardia, asistolia, blocco
AV di grado elevato,
prolungamento dell’intervallo
PR, ipotensione, scompenso
cardiaco congestizio
L’utilizzo in associazione
con un -bloccante o con
disopiramide esacerba
lo scompenso cardiaco
congestizio, aumenta
i livelli e la tossicità della
digossina
ev: 50-300 g/kg al bisogno in bolo
ev rapido
Iniziare con 50 g/kg e aumentare
di 50-100 g/kg/dose
Dose massima: 18 mg
Dolore toracico, flushing, dispnea,
broncospasmo, fibrillazione
atriale, bradicardia, asistolia
RANGE
TERAPEUTICO
1-2 mg/mL
AV, atrioventricolare; ev, endovena; JET, tachicardia ectopica giunzionale; LES, malattia simile al lupus eritematoso sistemico; LQT, sindrome del QT lungo; PAC, complesso atriale prematuro; PTT, tempo
di tromboplastina parziale; SNC, sistema nervoso centrale; SVT, tachicardia sopraventricolare; VT, tachicardia ventricolare; WPW, sindrome di Wolff-Parkinson-White.
Formulazioni e dosi indicate sono quelle autorizzate e in uso negli Stati Uniti.
L’ablazione transcatetere costituisce una terapia accettabile non
solo per le tachiaritmie potenzialmente letali o resistenti ai farmaci,
ma anche per il trattamento di elezione definitivo delle aritmie. In
caso di bradicardia, i pacemaker impiantabili sono di dimensioni
abbastanza ridotte da poter essere utilizzati anche nei prematuri. I
defibrillatori impiantabili (Implantable Cardioverter-Defibrillator,
ICD) sono disponibili per l’impiego nei pazienti ad alto rischio con
aritmie ventricolari maligne ed esposti a un rischio aumentato di
morte improvvisa.
429.1
Principi di terapia antiaritmica
George F. Van Hare
Quando si prende in considerazione il ricorso a una terapia farmacologica nella popolazione pediatrica, è importante tenere conto che
esistono notevoli differenze relative alla farmacocinetica sia in base
all’età sia rispetto agli adulti. I lattanti possono avere un assorbimento più lento, lunghi tempi di svuotamento gastrico e dimensioni
diverse dei compartimenti tissutali con conseguenze sul volume di
distribuzione del farmaco. Il metabolismo epatico e l’escrezione renale
possono variare sia tra i diversi gruppi di età pediatrica sia rispetto
agli adulti. Nel prendere in considerazione una terapia antiaritmica
è importante tenere presente che il probabile meccanismo alla base
dell’aritmia nella popolazione pediatrica può presentare differenze
rispetto a quello che si incontra negli adulti.
Benché esistano molti farmaci antiaritmici per il controllo del
ritmo, la maggior parte di essi non è stata approvata dalla Food
and Drug Administration (FDA) degli Stati Uniti per l’uso pediatrico e il loro impiego è in genere considerato “off-label”. I cardiologi
pediatrici hanno tuttavia esperienza nell’uso di questi farmaci ed
esistono standard riconosciuti che riguardano il dosaggio.
Da quando si sono rese disponibili procedure di ablazione
potenzialmente curative, l’importanza della terapia medica è diminuita. Medici e pazienti sono infatti meno disposti ad accettare
C0100.indd 1689
gli effetti collaterali dei farmaci. Gli effetti inaccettabili, oltre al
potenziale proartimico causato dal farmaco antiartitmico, possono
limitare in modo considerevole la terapia medica e indurranno
medico e famiglia a optare per una procedura di ablazione.
Gli antiaritmici sono comunemente classificati secondo il sistema di Vaughan Williams, costituito da quattro classi: la classe
I comprende gli agenti che bloccano principalmente il canale del
sodio; la classe II comprende i -bloccanti; la classe III comprende
gli agenti che prolungano la ripolarizzazione; la classe IV, infine,
comprende i calcio-antagonisti. La classe I è a sua volta suddivisa
in sottoclassi in base alla potenza del blocco dei canali del sodio
(si veda Tab. 429.1).
429.2
Aritmie sinusali ed extrasistoli
George F. Van Hare
L’aritmia sinusale fasica è una normale variazione fisiologica nella
scarica degli impulsi dal nodo del seno correlata all’attività respiratoria. La frequenza cardiaca diminuisce durante l’espirazione e
aumenta durante l’inspirazione. Alle volte, se la frequenza sinusale
diventa abbastanza lenta, insorge un battito di scappamento dalla
regione della giunzione atrioventricolare (AV) (Fig. 429.1). Nei
bambini, la normale aritmia sinusale fasica può essere alquanto
pronunciata e può mimare frequenti complessi prematuri, ma a
Derivazione 2
7 anni
Figura 429.1 Aritmia sinusale fasica con battito di scappamento giunzionale. Si noti
la variazione dell’intervallo PP con pochi cambiamenti nella morfologia dell’onda P
o dell’intervallo PR. Quando la frequenza sinusale è abbastanza bassa, la giunzione
atrioventricolare subentra producendo battiti di scappamento. Questo ritmo è normale.
9/29/12 2:22:20 AM
1690 ■ Parte XX Apparato cardiovascolare
un’attenta auscultazione può apparire evidente il rapporto con le
fasi della respirazione. I farmaci che aumentano il tono vagale,
come la digossina, possono esagerare l’aritmia sinusale, in genere
eliminata dall’attività fisica. Altre irregolarità del ritmo sinusale,
in particolare la bradicardia associata ad apnea periodica, sono di
comune riscontro nei neonati prematuri.
La bradicardia sinusale è dovuta a una scarica lenta di impulsi
dal nodo del seno, il pacemaker naturale del cuore. Rientra in
questa definizione una frequenza sinusale <90 battiti/min nei
neonati e <60 battiti/min nelle età successive. È un reperto comune negli atleti ben allenati; negli individui sani non ha in genere
alcuna rilevanza. La bradicardia sinusale può insorgere in corso di
malattie sistemiche (ipotiroidismo o anoressia nervosa) e si risolve
quando il disturbo è sotto controllo. Si può inoltre osservare in
associazione a condizioni caratterizzate da un elevato tono vagale,
quali ostruzione gastrointestinale o processi intracranici. I lattanti
con basso peso alla nascita mostrano una notevole variazione
della frequenza sinusale; in questi soggetti è comune la presenza
di bradicardia sinusale in combinazione ad apnea e può essere
associata a battiti di scappamento giunzionali. È inoltre frequente
la presenza di complessi atriali prematuri. Queste variazioni del
ritmo cardiaco, e in particolare la bradicardia, compaiono più
comunemente durante il sonno e non sono associate a sintomi. Di
solito non è necessaria alcuna terapia.
La sindrome da pacemaker atriale migrante (Fig. 429.2) è definita come uno spostamento intermittente del pacemaker del cuore dal
nodo del seno a un’altra parte dell’atrio. È comune nell’infanzia e
di solito rappresenta una variante normale; si può osservare anche
in associazione a bradicardia sinusale in cui lo spostamento del
focus sinusale rappresenta un fenomeno di scappamento.
Le extrasistoli sono prodotte da una scarica prematura proveniente da un focus ectopico, che può essere situato in qualsiasi sede
a livello dell’atrio, della giunzione AV o del ventricolo. Di solito,
extrasistoli isolate non hanno alcuna rilevanza clinica o prognostica. In determinate circostanze, tuttavia, i battiti prematuri possono
essere dovuti a cardiopatia organica (infiammazione, ischemia,
fibrosi) o a tossicità da farmaci, in particolare da digossina.
I complessi atriali prematuri sono comuni nell’infanzia, in
genere in assenza di una patologia cardiaca. A seconda del grado
di prematurità del battito (intervallo di accoppiamento) e dell’intervallo RR precedente (lunghezza del ciclo), i complessi atriali
prematuri possono portare a complessi QRS normali, prolungati
(aberranza) o assenti (complesso atriale prematuro bloccato).
Quest’ultimo caso si verifica quando l’impulso prematuro non può
essere condotto al ventricolo a causa della refrattarietà del nodo
AV o del sistema di conduzione distale (Fig. 429.3). Le extrasistoli
atriali devono essere distinte dai complessi ventricolari prematuri
(Premature Ventricular Contraction, PVC). Un’accurata ricerca
all’elettrocardiogramma di un’onda P prematura che precede
il QRS mostrerà un’onda P prematura che si sovrappone alla
precedente onda T, deformandola, o un’onda P prematura con
un aspetto diverso rispetto a quello delle altre onde P sinusali. I
complessi atriali prematuri, in genere, resettano il pacemaker del
nodo del seno, provocando una pausa compensatoria incompleta,
ma questa caratteristica non è considerata un metodo affidabile
per differenziare i complessi prematuri atriali da quelli ventricolari
nei bambini.
Derivazione 2
7 anni
Figura 429.2 Pacemaker atriale migrante. Si noti il cambiamento della configurazione
dell’onda P nel settimo, nel nono e nel decimo battito. La settima onda P può
rappresentare una fusione tra l’onda P sinusale e il pacemaker atriale ectopico
che si osserva nel decimo battito.
C0100.indd 1690
Derivazione 2
17 anni
Figura 429.3 Complesso atriale prematuro. I complessi QRS (l’ottavo, il decimo
e l’ultimo) in questo tracciato sono preceduti da un’onda P invertita, indicativa di
un’origine ectopica della depolarizzazione atriale. Si noti che l’ottavo e l’ultimo complesso
QRS assomigliano a quelli di origine sinusale, mentre il decimo è condotto in modo
anomalo. Questo spostamento dell’origine dei complessi è in funzione della lunghezza
del ciclo precedente, che influenza il periodo refrattario delle branche. Il fatto che
la pausa dopo il complesso atriale prematuro sia più lunga di due intervalli PP implica
che la depolarizzazione atriale prematura ha invaso e scaricato il nodo del seno per poi
resettarlo affinché scarichi in modo ritardato.
Derivazione 2
15 anni
Figura 429.4 Complessi ventricolari prematuri in un ritmo bigemino, in un paziente
in iperventilazione. Si noti che il battito prematuro è ampio e ha una morfologia
completamente diversa da quella di un battito sinusale. Il battito prematuro non
è preceduto da un’onda P prematura distinguibile o da deformazioni apprezzabili
della precedente onda T.
I PVC, che possono insorgere in qualsiasi zona dei ventricoli,
consistono in complessi QRS prematuri, allargati e anomali che
non sono preceduti da un’onda P prematura (Fig. 429.4). Quando
tutti i battiti prematuri hanno una forma identica, sono classificati
come di origine unifocale, il che suggerisce un’origine da un sito
comune. Quando i PVC variano in termini di forma, sono invece
definiti multifocali, termine che indica un’origine da più di un sito
ventricolare. Le extrasistoli ventricolari sono spesso, anche se non
sempre, seguite da una pausa compensatoria. La presenza di battiti
di fusione, ovvero complessi con caratteristiche morfologiche intermedie tra quelle dei normali battiti sinusali e quelle dei PVC, è
un indizio dell’origine ventricolare dei battiti prematuri. Le extrasistoli producono una gittata sistolica e un polso inferiori rispetto
alla norma e, se abbastanza premature, possono non essere udibili
all’auscultazione con uno stetoscopio o palpabili al polso radiale.
Se frequenti, le extrasistoli possono assumere un ritmo definito,
ad esempio, in alternanza ai battiti normali (bigeminismo) o in
seguito a due battiti normali (trigeminismo). La maggior parte dei
pazienti non percepisce i complessi ventricolari prematuri isolati,
anche se alcuni possono avvertire la “mancanza di un battito” in
regione precordiale. Questa sensazione è dovuta all’aumentata
gittata sistolica del battito normale dopo una pausa compensatoria.
I PVC possono essere esacerbati dall’ansia, da una malattia febbrile
o dall’ingestione di vari farmaci o stimolanti.
È importante distinguere i PVC benigni da quelli che hanno una
probabilità di generare aritmie più gravi. I primi scompaiono in
genere durante la tachicardia indotta dall’attività fisica; se durante
l’attività fisica persistono o diventano più frequenti, l’aritmia può
avere una rilevanza maggiore. I seguenti criteri sono indicazioni
ad approfondire gli accertamenti, nel caso in cui si sospetti la
presenza di PVC che potrebbero richiedere una terapia soppressiva: (1) due o più battiti ventricolari prematuri in sequenza; (2)
PVC multifocali; (3) aumento dell’attività ectopica ventricolare in
seguito ad attività fisica; (4) aspetto R su T (la depolarizzazione
ventricolare prematura avviene sull’onda T del battito precedente);
(5) presenza di una cardiopatia sottostante e/o pregresso intervento
chirurgico cardiaco (quest’ultimo punto rappresenta l’aspetto più
importante). Il cardine della terapia per i PVC benigni è la rassicurazione dei pazienti, ai quali occorre spiegare che l’aritmia non
rappresenta un pericolo per la vita; i pazienti molto sintomatici,
tuttavia, possono trarre beneficio da una terapia soppressiva.
I PVC maligni sono di solito secondari a un’altra condizione clinica
9/29/12 2:22:24 AM
Capitolo 429 Disturbi della frequenza e del ritmo cardiaci ■ 1691
(squilibrio elettrolitico, ipossia, tossicità da farmaci, danno cardiaco o presenza di un catetere intraventricolare). Un trattamento
efficace consiste nella correzione dell’anomalia sottostante. La
terapia di prima linea è rappresentata dalla somministrazione di
un bolo endovenoso di lidocaina seguito da infusione; i farmaci
più efficaci, quali l’amiodarone, sono invece riservati ai casi refrattari o a pazienti con sottostante disfunzione ventricolare o
compromissione emodinamica.
429.3
Tachicardia sopraventricolare
George F. Van Hare
“Tachicardia sopraventricolare” (SupraVentricular Tachycardia,
SVT) è un termine generico che comprende tutte le forme di tachicardia parossistica o permanente a eccezione della tachicardia
ventricolare. La SVT può essere suddivisa in tre principali sottocategorie: tachicardie da rientro che utilizzano una via accessoria, tachicardie da rientro senza una via accessoria e tachicardie ectopiche
o con automatismo. La tachicardia reciprocante atrioventricolare
(AtrioVentricular Reciprocating Tachycardia, AVRT) interessa una
via accessoria e rappresenta il meccanismo più comune della SVT
nei lattanti. La tachicardia da rientro del nodo atrioventricolare
(AtrioVentricular Node Re-Entry Tachycardia, AVNRT) è rara
durante l’età del lattante ma è caratterizzata da un’incidenza crescente nell’infanzia e nell’adolescenza. Il flutter atriale è raro nei
bambini con cuore normale, mentre la tachicardia da rientro intraatriale (Intra-Atrial Re-Entry Tachycardia, IART) è comune nei
pazienti sottoposti a intervento chirurgico cardiaco. Le tachicardie
ectopiche giunzionali e atriali sono perlopiù associate ad anomalie
cardiache (cardiomiopatia) e all’immediato periodo postoperatorio
in caso di interventi per cardiopatie congenite.
MANIFESTAZIONI CLINICHE
La SVT da rientro è caratterizzata da un esordio brusco e da un’altrettanto brusca cessazione; di solito si verifica quando il paziente è a
riposo, ma nei lattanti può essere scatenata da un’infezione acuta. L’attacco può durare solo pochi secondi o persistere per ore. La frequenza
cardiaca solitamente supera i 180 battiti/min e talvolta può arrivare
fino a 300 battiti/min. L’unico disturbo può essere rappresentato
dalla percezione consapevole dell’elevata frequenza cardiaca. Molti
bambini tollerano benissimo questi episodi ed è improbabile che brevi
parossismi costituiscano un rischio per la vita. Se la frequenza cardiaca
è eccezionalmente elevata o se l’attacco è prolungato, possono sopravvenire fastidio precordiale e scompenso cardiaco. Nei bambini,
la SVT può essere esacerbata dall’esposizione a decongestionanti
o broncodilatatori da banco.
Nei lattanti, la diagnosi può essere più difficoltosa a causa dell’incapacità dei pazienti stessi di comunicare i sintomi. La frequenza
cardiaca a quest’età è di norma più elevata che nei bambini più
grandi e aumenta considerevolmente con il pianto. Alle volte, i
lattanti con SVT giungono all’osservazione con scompenso cardiaco, poiché la tachicardia non viene riconosciuta per lungo tempo.
Durante questi episodi, la frequenza cardiaca è spesso compresa
tra i 240 e i 300 battiti/min. Se la durata dell’attacco è pari o superiore a 6-24 ore, è possibile riconoscere la presenza di scompenso
cardiaco e il lattante presenterà colorito cinereo, sarà irrequieto
e irritabile, e mostrerà tachipnea ed epatomegalia. Quando la tachicardia si verifica nel feto, può causare idrope fetale, che rappresenta
la manifestazione in utero dello scompenso cardiaco.
Nei neonati, la SVT si manifesta di solito con un complesso
QRS stretto (<0,08 s). L’onda P è visibile all’elettrocardiogramma
standard solo nel 50-60% dei neonati con SVT, ma è riconoscibile
con una derivazione transesofagea nella maggior parte dei pazienti. Benché possa essere difficile, differenziarla da una tachicardia
sinusale è importante in quanto quest’ultima richiede il trattamento del problema sottostante (ad es. sepsi, ipovolemia) piuttosto
che la somministrazione di farmaci antiaritmici. Se la frequenza
C0100.indd 1691
è >230 battiti/min con un asse dell’onda P anomalo (un’onda P
anormale è positiva nelle derivazioni I e aVF), è improbabile che si
tratti di una tachicardia sinusale. La frequenza cardiaca in una SVT,
inoltre, tende a rimanere stabile, mentre nella tachicardia sinusale
varia con i cambiamenti del tono vagale e simpatico. La tachicardia
reciprocante AV utilizza un tratto bypass che può condurre in entrambi i sensi (sindrome di Wolff-Parkinson-White [WPW]) o solo
in senso retrogrado (via accessoria nascosta). I pazienti con sindrome di WPW sono esposti a un rischio basso, ma concreto, di
morte improvvisa. Se la via accessoria conduce rapidamente in senso
anterogrado, il paziente è a rischio di fibrillazione atriale che genera
fibrillazione ventricolare. La stratificazione del rischio, comprendente
un monitoraggio Holter nelle 24 ore e un test da sforzo, può aiutare
a differenziare i pazienti a rischio più elevato di morte improvvisa
da WPW. La sincope costituisce un sintomo negativo nei pazienti
affetti da WPW e, se presente, è necessario eseguire uno studio elettrofisiologico e, probabilmente, un’ablazione transcatetere.
Le caratteristiche elettrocardiografiche tipiche della sindrome
di Wolff-Parkinson-White si osservano di solito quando il paziente
non presenta tachicardia. Queste comprendono un intervallo PR
corto e un lento innalzamento del QRS (onda delta) (Fig. 429.5).
Anche se, nella maggior parte dei casi, è presente nei pazienti con
un cuore normale, la sindrome può essere associata ad anomalia
di Ebstein della valvola tricuspide o a cardiomiopatia ipertrofica.
La struttura anatomica fondamentale è una via accessoria consistente in un ponte muscolare che connette l’atrio al ventricolo, a
destra o a sinistra dell’anello AV (Fig. 429.6). Durante il ritmo
sinusale, l’impulso viene condotto attraverso il nodo AV e la via
accessoria, producendo un certo grado di fusione dei due fronti
di depolarizzazione, che porta a un QRS anomalo. Nell’AVRT,
l’impulso viene condotto in senso anterogrado attraverso il nodo
AV (conduzione ortodromica), il che porta a un normale complesso QRS, e in senso retrogrado attraverso la via accessoria
all’atrio, con conseguente perpetuarsi della tachicardia. In questi
casi è solo dopo la cessazione della tachicardia che si riconoscono
le caratteristiche ECG tipiche della sindrome di WPW (si veda
Fig. 429.5). Quando si verifica una rapida conduzione anterograda
attraverso la via di pre-eccitazione durante la tachicardia e la via
di rientro retrogrado all’atrio è attraverso il nodo AV (conduzione
aVF
A
aVF
B
Figura 429.5 A. Tachicardia sopraventricolare in un bambino con sindrome
di Wolff-Parkinson-White (WPW). Si notino i normali complessi QRS durante la tachicardia,
nonché le evidenti onde P retrograde all’innalzamento delle onde T. B. In seguito sono evidenti
le caratteristiche tipiche della sindrome di WPW (intervallo PR corto, onda delta, QRS ampio).
9/29/12 2:22:24 AM
1692 ■ Parte XX Apparato cardiovascolare
*
a
n
a
NSR
Figura 429.6 Rappresentazione schematica del cuore con una via accessoria
destra (sindrome di Wolff-Parkinson-White). L’asterisco indica l’inizio del battito
sinusale. Le frecce indicano la direzione e la diffusione dell’eccitazione. Il complesso
elettrocardiografico riportato rappresenta un battito di fusione che combina l’attivazione
delle vie normale (n) e accessoria (a). Quest’ultima iscrive l’onda delta. NSR, ritmo
sinusale normale.
antidromica), i complessi QRS sono ampi e la possibilità che si
verifichino aritmie gravi (fibrillazione ventricolare) è più elevata,
soprattutto se insorge una fibrillazione atriale.
La tachicardia da rientro del nodo AV (AVNRT), osservabile più
comunemente nell’adolescenza, comporta l’utilizzo di due vie nel
nodo AV. È una delle poche SVT a essere talvolta associata alla sincope. Questa aritmia è di solito sensibile alla terapia antiaritmica,
ad esempio con -bloccanti, o all’ablazione mediante catetere.
TRATTAMENTO
La stimolazione vagale ottenuta immergendo il volto in acqua
ghiacciata (nei bambini più grandi) o posizionando una borsa del
ghiaccio sul volto (nei lattanti) può stroncare l’attacco. Per far
terminare l’attacco, ai bambini più grandi possono essere insegnate
manovre vagali, come la manovra di Valsalva, la contrazione
dei muscoli addominali atti alla spinta intestinale, il trattenere il
respiro o il mettersi a testa in giù. Non si deve mai ricorrere alla
compressione dei bulbi oculari, e il massaggio del seno carotideo
raramente risulta efficace. Se queste misure falliscono, sono disponibili numerose alternative farmacologiche (si veda Tab. 429.1).
Nei pazienti stabili, l’adenosina per bolo endovenoso rapido rappresenta il trattamento di elezione per la sua rapida insorgenza di
azione e per i minimi effetti sulla contrattilità cardiaca. Se non si
osserva alcun effetto sulla tachicardia può essere necessario ripetere
la dose. Poiché l’adenosina può provocare fibrillazione atriale,
non deve essere somministrata senza tenere a portata di mano un
dispositivo per la cardioversione elettrica. Per il trattamento iniziale
della SVT nei bambini più grandi sono stati utilizzati anche calcioantagonisti come il verapamil. Quest’ultimo agente può ridurre
la gittata cardiaca e provocare ipotensione e arresto cardiaco nei
pazienti di età inferiore a 1 anno ed è pertanto controindicato
in questo gruppo di età. In situazioni urgenti, in cui si sono già
sviluppati sintomi di grave scompenso cardiaco, si raccomanda
di ricorrere alla cardioversione elettrica sincronizzata (0,5-2 J/kg)
come trattamento iniziale (Cap. 62).
Una volta effettuata la cardioversione a ritmo sinusale, si sceglie un farmaco a maggiore durata di azione per la terapia di
mantenimento. Nei pazienti senza una via accessoria anterograda
(non-WPW), il cardine della terapia è rappresentato dalla somministrazione di -bloccanti. Spesso si ricorre anche alla digossina, la
cui efficacia è però maggiore nei lattanti e minore nei bambini più
grandi. Nei bambini con WPW, la digossina o i calcio-antagonisti
possono aumentare il grado di conduzione anterograda degli
impulsi attraverso il tratto bypass, con possibilità di provocare
fibrillazione ventricolare, e devono pertanto essere evitati. Questi
pazienti sono di solito trattati a lungo termine con -bloccanti. In
presenza di tachicardia resistente sono stati usati procainamide,
C0100.indd 1692
chinidina, flecainide, propafenone, sotalolo e amiodarone. La maggior parte degli agenti antiaritmici può provocare nuove pericolose
aritmie (proaritmia) e diminuire la funzione cardiaca; l’uso della
flecainide e del propafenone, in particolare, deve essere limitato
nei pazienti con cuori per altri aspetti sani.
Se si sviluppa uno scompenso cardiaco a causa di una tachicardia prolungata in un bambino con un cuore normale, la funzione
cardiaca torna di solito alla normalità una volta ripristinato il ritmo sinusale, anche se possono essere necessari giorni o settimane.
I lattanti con SVT diagnosticata nei primi 3-4 mesi di vita hanno
una più bassa incidenza di recidive rispetto a quelli in cui la prima
diagnosi viene formulata a un’età più avanzata. Questi pazienti
hanno una probabilità di risoluzione dell’80% nel primo anno di
vita, ma circa il 30% presenterà recidive più avanti nel corso dell’infanzia; se è necessario ricorrere alla terapia medica questa può
essere diminuita progressivamente fino alla sospensione nel giro di
un anno, dopodiché il paziente può essere tenuto sotto osservazione
per individuare eventuali segni di recidiva. Si deve insegnare ai
genitori a misurare la frequenza cardiaca dei propri figli, in modo
da individuare episodi di SVT non evidenti e prolungati prima che
insorga lo scompenso cardiaco.
Le registrazioni elettrocardiografiche per 24 ore (Holter) sono
utili per il monitoraggio del decorso della terapia e per rilevare brevi
episodi di tachicardia senza sintomi, soprattutto nei lattanti e nei
bambini piccoli. In alcuni centri viene utilizzato il pacing transesofageo per valutare gli effetti della terapia nei lattanti. Nei pazienti
con SVT refrattarie candidati all’ablazione mediante catetere sono
spesso indicati studi elettrofisiologici più dettagliati, eseguiti nel
laboratorio di emodinamica e consistenti nel posizionamento per via
endovenosa di numerosi cateteri, dotati di elettrodi, in diverse sedi
del cuore. Il pacing viene effettuato per valutare le caratteristiche
della conduzione della via accessoria e per indurre la tachiaritmia;
viene quindi eseguita una mappatura per localizzare la via accessoria. L’ablazione mediante catetere di una via accessoria è spesso utilizzata come procedura di elezione nei bambini e negli adolescenti,
nonché nei pazienti che necessitano di più farmaci o non tollerano i
loro effetti collaterali, o per i quali il controllo dell’aritmia è scarso.
L’ablazione può essere eseguita con radiofrequenza, che provoca un
riscaldamento dei tessuti, o mediante tecniche di crioablazione, che
provocano invece un congelamento dei tessuti. Il tasso di successo
complessivo iniziale varia da circa l’80 al 95%, a seconda della sede
della via accessoria. In pazienti selezionati, può essere efficace anche
l’ablazione chirurgica dei tratti bypass.
La gestione della SVT dovuta a una tachicardia da rientro del
nodo AV (AVNRT) è praticamente identica a quella dell’AVRT. I
bambini con AVNRT non sono esposti a un rischio aumentato di
morte improvvisa in quanto non presentano una via accessoria
manifesta. In questi soggetti, in pratica, gli episodi sono più probabilmente provocati dall’attività fisica o da altre forme di stress, e
la frequenza cardiaca può essere piuttosto elevata con conseguente
dolore toracico, capogiri e, alle volte, sincope. Tra i farmaci antiaritmici per il trattamento cronico, i -bloccanti rappresentano la
terapia di elezione; l’AVNRT non risponde all’adenosina. Nonostante si conosca poco della storia naturale, i pazienti con AVNRT
spesso presentano il disturbo anche in età adulta e sembra pertanto
improbabile che avvenga una risoluzione spontanea. Questi pazienti sono buoni candidati all’ablazione mediante catetere, sia
con radiofrequenza sia con crioablazione, mostrando tassi elevati
di successo e tassi ridotti di complicanze.
La tachicardia atriale ectopica, poco comune durante l’infanzia,
è caratterizzata da una frequenza cardiaca variabile (raramente
>200 battiti/min), onde P identificabili con un asse anomalo e da
una tachicardia sostenuta o permanente non sostenuta. Questa
forma di tachicardia atriale ha un singolo focus di automatismo.
Nell’identificazione di questo meccanismo risulta utile il monitoraggio dell’elettrocardiogramma mentre si inizia una manovra
vagale o una terapia farmacologica. Le tachicardie da rientro
cessano improvvisamente, mentre quelle da automatismo dapprima rallentano, poi aumentano gradualmente la loro frequenza.
9/29/12 2:22:24 AM
Capitolo 429 Disturbi della frequenza e del ritmo cardiaci ■ 1693
Le tachicardie atriali ectopiche sono di solito più difficili da controllare mediante la somministrazione di farmaci rispetto alle più
comuni tachicardie da rientro. Se la terapia farmacologica con un
unico principio attivo non ha successo si suggerisce l’ablazione
mediante catetere, che ha un tasso di successo >90%.
Le tachicardie atriali caotiche multifocali sono caratterizzate
da ≥3 onde P ectopiche, frequenti onde P bloccate e intervalli PR
variabili di battiti condotti. Questa aritmia si verifica più spesso nei
bambini di età inferiore a 1 anno, in genere in assenza di cardiopatia, anche se vi sono evidenze che indicano un’associazione con
la miocardite virale o la pneumopatia. L’obiettivo del trattamento
farmacologico è rallentare la frequenza ventricolare, in quanto la
conversione a ritmo sinusale può non essere possibile e spesso è
richiesta la somministrazione di più agenti. Quando questa aritmia
si verifica durante l’età del lattante, di solito si risolve spontaneamente entro i 3 anni di età.
La tachicardia ectopica giunzionale (JET) accelerata è un’aritmia
da automatismo (non da rientro) in cui la frequenza giunzionale è
superiore a quella del nodo del seno, con conseguente dissociazione
AV. Principalmente riconosciuta nel primo periodo postoperatorio
dopo chirurgia cardiaca, può essere difficilissima da controllare.
La riduzione della velocità di infusione delle catecolamine e il
controllo dell’iperpiressia sono fattori aggiuntivi importanti ai fini
della gestione. È possibile osservare la presenza di JET congenita
in assenza di un precedente intervento chirurgico. Si tratta di una
condizione permanente, che può provocare cardiomiopatia dilatativa. L’amiodarone per via endovenosa è efficace nel trattamento
della JET postoperatoria. I pazienti che necessitano di una terapia
cronica possono rispondere all’amiodarone o al sotalolo. La JET
congenita può essere curata mediante ablazione con catetere; il
blocco AV a lungo termine che richiede l’impianto di un pacemaker
rappresenta tuttavia una complicanza importante.
Il flutter atriale, noto anche con il nome di tachicardia intraatriale rientrante, è una tachicardia caratterizzata da un’attività
atriale di frequenza pari a 250-300 battiti/min nei bambini e negli
adolescenti e pari a 400-600 nei neonati. Il meccanismo del flutter
atriale comune consiste in un ritmo rientrante che origina nell’atrio
destro e circonda l’anulus della valvola tricuspide. Poiché il nodo
AV non è in grado di trasmettere impulsi tanto rapidi, è quasi sempre presente un certo grado di blocco AV e i ventricoli rispondono
ogni 2°-4° battito atriale (Fig. 429.7). A volte la risposta è variabile
e il ritmo appare regolare.
A
Nei bambini più grandi, il flutter atriale si verifica in genere nel
contesto di una cardiopatia congenita; i neonati, invece, hanno
spesso cuori normali. Il flutter atriale, pur potendo verificarsi
durante malattie infettive acute, si osserva perlopiù in pazienti con
grandi atri distesi, come quelli associati a insufficienza mitralica
o tricuspidale di lunga data, atresia della tricuspide, anomalia di
Ebstein o stenosi mitralica reumatica. Può inoltre manifestarsi
dopo chirurgia palliativa o correttiva intra-atriale. Un flutter
atriale incontrollato è in grado di far precipitare uno scompenso
cardiaco. Le manovre vagali (come la pressione sul seno carotideo
o l’immersione del volto in soluzione salina ghiacciata) o l’adenosina generalmente provocano un temporaneo rallentamento della
frequenza cardiaca per effetto di un aumentato blocco AV. La diagnosi è confermata dall’elettrocardiografia, che evidenzia onde di
flutter, rapide e regolari a dente di sega. Il flutter atriale di solito si
converte immediatamente in ritmo sinusale con la cardioversione
elettrica sincronizzata che, nella maggior parte dei casi, rappresenta
il trattamento di elezione. I pazienti con flutter atriale cronico nel
contesto di una cardiopatia congenita possono essere esposti a un
rischio aumentato di tromboembolia e ictus e devono pertanto essere sottoposti ad anticoagulazione prima della cardioversione di
elezione. La digossina, i -bloccanti o i calcio-antagonisti possono
essere usati per rallentare la risposta ventricolare nel flutter atriale
prolungando il periodo refrattario del nodo AV. Per mantenere il
ritmo sinusale possono essere utilizzati altri agenti, comprendenti
i farmaci di classe I come la procainamide o il propafenone e i
farmaci di classe III come l’amiodarone e il sotalolo. Altre modalità
di trattamento, tra cui l’ablazione chirurgica e mediante catetere,
sono state utilizzate con risultati moderati in pazienti più grandi
affetti da cardiopatie congenite. Dopo cardioversione, i neonati con
cuori normali possono essere trattati con digossina per 6-12 mesi;
successivamente è in genere possibile interrompere la somministrazione del farmaco poiché il flutter atriale neonatale in genere
non si ripresenta.
La fibrillazione atriale è poco comune nei bambini e rara nei
lattanti. L’eccitazione atriale, caotica e più rapida (400-700 battiti/
min), induce una risposta ventricolare e un polso irregolarmente
irregolari (Fig. 429.8). Questo disturbo del ritmo è spesso associato
a un ingrandimento o a una patologia degli atri. La fibrillazione
atriale si osserva principalmente nei bambini più grandi con stenosi
mitralica reumatica. Per quanto raramente, si riscontra anche come
complicanza della chirurgia atriale nei pazienti con ingrandimento
atriale sinistro secondario a insufficienza valvolare AV del cuore
sinistro e nei pazienti con sindrome di WPW. Nei bambini più
grandi o negli adolescenti in precedenza normali con fibrillazione
atriale è possibile sospettare la presenza di tireotossicosi, embolia
polmonare, pericardite o cardiomiopatia. In casi molto rari, la
fibrillazione atriale può essere familiare. Il miglior trattamento iniziale è il controllo della frequenza, ottenuto in modo più efficace con
calcio-antagonisti, per limitare la frequenza ventricolare durante la
fibrillazione atriale. In presenza di sindrome di WPW la digossina
non viene somministrata. Il normale ritmo sinusale può essere ripristinato con procainamide o amiodarone per via endovenosa o con
la cardioversione elettrica; quest’ultima rappresenta il trattamento
di elezione nei pazienti emodinamicamente instabili. I pazienti
con fibrillazione atriale cronica, essendo a rischio di sviluppare
Derivazione V1
16 anni
B
Figura 429.7 Flutter atriale neonatale. Si noti che le onde di flutter non sono evidenti
nel primo tracciato (A), ma dopo la somministrazione di una dose di adenosina compaiono
onde di flutter a una frequenza di circa 450 battiti/min (B).
C0100.indd 1693
Figura 429.8 Fibrillazione atriale, caratterizzata dall’assenza di chiare onde P e da una
risposta ventricolare irregolarmente irregolare. È possibile osservare le rapide ondulazioni
irregolari (onde F). Le onde di fibrillazione possono non essere visibili in tutte le derivazioni
e devono pertanto essere ricercate attentamente in tutti i tracciati con intervalli RR
irregolari. Si noti l’assenza di due intervalli RR uguali.
9/29/12 2:22:24 AM
1694 ■ Parte XX Apparato cardiovascolare
tromboembolia e ictus, devono essere sottoposti a trattamento
anticoagulante con warfarin. Gli anticoagulanti devono essere
somministrati anche ai pazienti trattati con cardioversione elettrica di elezione.
429.4
Tachiaritmie ventricolari
George F. Van Hare
La tachicardia ventricolare (Ventricular Tachycardia, VT), meno
comune della SVT nei pazienti pediatrici, per definizione consiste in almeno tre PVC a una frequenza >120 battiti/min (Fig.
429.9). Di tipo parossistico o incessante, può essere associata a
miocardite, origine anomala di un’arteria coronaria, displasia
aritmogena del ventricolo destro, prolasso della valvola mitrale,
tumori cardiaci primitivi o cardiomiopatia. È stata osservata in
presenza di un intervallo QT prolungato da cause congenite o
acquisite (farmaci proaritmici), sindrome di WPW e in caso di
uso di droghe (cocaina, amfetamine). Può svilupparsi anni dopo
un intervento chirurgico intraventricolare (tetralogia di Fallot e
difetti correlati) o verificarsi in assenza di un’evidente patologia
cardiaca organica. La VT deve essere distinta dalla SVT condotta
con vie di conduzione aberrante o rapida lungo una via accessoria
(Tab. 429.2). La presenza di battiti di cattura e di fusione conferma
la diagnosi. Anche se alcuni bambini tollerano frequenze ventricolari elevate per molte ore, questa aritmia deve essere trattata
rapidamente poiché può dare luogo a ipotensione e degenerare in
fibrillazione ventricolare. Nei pazienti emodinamicamente stabili, i
farmaci di elezione iniziali sono l’amiodarone per via endovenosa,
la lidocaina o la procainamide. Se il trattamento ha successo, è
indispensabile ricercare e correggere qualsiasi anomalia sottostante come squilibri elettrolitici, ipossia o tossicità da farmaci.
L’amiodarone è il trattamento di elezione durante l’arresto cardiaco
(Cap. 62). I pazienti emodinamicamente instabili con VT devono
essere immediatamente trattati con cardioversione elettrica. Anche
l’incremento della frequenza ventricolare, mediante elettrodi per
RR
Contrazione ventricolare
prematura
Tachicardia ventricolare
p
p
p
2XRR
p
p
p
Fibrillazione ventricolare
Figura 429.9 Aritmie ventricolari. (Da Park MY: Pediatric cardiology for practitioners,
ed 5, Philadelphia, 2008, Mosby/Elsevier, p 429, Fig 24-6.)
pacing temporanei o pacemaker permanente, può essere efficace,
sebbene talvolta possa provocare un peggioramento dell’aritmia a
fibrillazione ventricolare. Nel periodo neonatale, la VT può essere
associata a un’arteria coronaria sinistra anomala (Cap. 426.2) o a
un tumore miocardico.
A meno che non venga identificata una causa chiaramente
reversibile, è in genere indicato uno studio elettrofisiologico per
i pazienti in cui si è sviluppata una VT e, a seconda del risultato,
può essere opportuno procedere all’ablazione mediante catetere
e/o all’impianto di un ICD.
Nei lattanti, talvolta, si osserva un’aritmia simile alla VT. Si definisce allo stesso modo della VT, ma la frequenza è solo leggermente
più rapida rispetto alla frequenza sinusale coesistente (nell’ordine
del 10%). Si tratta solitamente di una condizione benigna.
La fibrillazione ventricolare è un’aritmia caotica che porta alla
morte se non viene rapidamente ristabilito un efficace battito ventricolare (si veda Fig. 429.9). Un pugno sul torace può talvolta
ripristinare il ritmo sinusale. Di solito sono necessarie la rianimazione cardiopolmonare e la defibrillazione. Se quest’ultima risulta
inefficace o vi è una recidiva di fibrillazione, è possibile somministrare amiodarone o lidocaina per via endovenosa e ripetere la
defibrillazione (Cap. 62). Una volta che la fibrillazione ventricolare
si è risolta, si deve avviare una ricerca della causa sottostante.
L’esecuzione di uno studio elettrofisiologico è indicata per i pazienti
che sono sopravvissuti alla fibrillazione ventricolare a meno che
non sia identificata una causa chiaramente reversibile. Se si riscontra una sindrome di WPW, si deve eseguire un’ablazione mediante
catetere. Per i pazienti in cui non si individua alcuna anomalia
correggibile, è quasi sempre indicato procedere all’impianto di un
ICD, per via dell’alto rischio di morte improvvisa.
429.5
Sindromi del QT lungo
George F. Van Hare
Le sindromi del QT lungo (Long QT Syndrome, LQTS) sono anomalie genetiche della ripolarizzazione ventricolare con un’incidenza
stimata di circa 1 per 10.000 nati vivi (Tab. 429.3). Presentano
un intervallo QT lungo all’ECG di superficie e sono associate ad
aritmie ventricolari maligne (torsione di punta e fibrillazione ventricolare). Sono una causa di sincope e morte improvvisa e possono
essere associate a sindrome della morte improvvisa del lattante o
ad annegamento. Almeno il 50% dei casi è familiare, ma a causa
della variabilità della penetranza, è possibile che si tratti di una
stima per difetto. La distinzione che si effettuava in passato tra le
forme dominante e recessiva della patologia (sindrome di RomanoWard e sindrome di Jervell e Lange-Nielsen) non viene in genere più
utilizzata in quanto ormai è noto che la forma ”recessiva“ è dovuta
Tabella 429.2 DIAGNOSI DELLE TACHIARITMIE
REPERTI ELETTROCARDIOGRAFICI
FREQUENZA CARDIACA
(BATTITI/MIN)
ONDA P
DURATA DEL QRS
Tachicardia sinusale
Tachicardia atriale
<230
180-320
Asse normale, sempre presente
Presente
Asse e morfologia dell’onda P anormali
Normale
Normale o prolungata
(con aberranza)
Fibrillazione atriale
120-180
Onde di fibrillazione
Flutter atriale
Onde di flutter a dente di sega
Tachicardia giunzionale
Atriale: 250-400
Risposta ventricolare
variabile: 100-320
120-280
Normale o prolungata
(con aberranza)
Normale o prolungata
(con aberranza)
Tachicardia ventricolare
120-300
C0100.indd 1694
Dissociazione atrioventricolare senza
fusione e battiti di cattura normali
Dissociazione atrioventricolare
con battiti di cattura e di fusione
Normale o prolungata
(con aberranza)
Prolungata per l’età
REGOLARITÀ
La frequenza varia con il respiro
In genere regolare, ma la risposta ventricolare può
essere variabile a causa della conduzione di tipo
Wenckebach
Irregolarmente irregolare (assenza di due intervalli
RR simili)
Risposta ventricolare regolare (ad es. 2:1, 3:1, 3:2
e così via)
Regolare (tranne in caso di battiti di cattura)
Regolare (tranne in caso di battiti di cattura)
9/29/12 2:22:24 AM
Capitolo 429 Disturbi della frequenza e del ritmo cardiaci ■ 1695
Tabella 429.3 MUTAZIONI EREDITARIE DEI CANALI NELLE SINDROMI DEL QT LUNGO E CORTO
CROMOSOMA
LQTS
1 11p15.5
2 7q35-36
GENE
KCNQ1
KCNH2
PROTEINA
KvLQT1 (Kv7.1)
HERG, (Kv11.1)
3 3p24-21
SCN5A
Nav1.5
4 4q24-27
ANK2
Anchirina-B
5 21q22
KCNE1
MinK
6 21q22
KCNE2
MiRP1
7 17q23
KCNJ2
Kir2.1
8 12p13.3
CACNA1C Cav1.2
9 3p25.3
CAV3
Caveolina-3
10 11q23.3
SCN4B
NaV4
SINDROME DEL QT CORTO
1 7q35-36
KCNH2
HERG, (Kv11.1)
2 11p15.5
KCNQ1
KvLQT1 (Kv7.1)
3 17q23
KCNJ2
Kir2.1
4 12p13.3
CACNA1C Cav1.2
5 10p12.33
CACNB2b CaV2b
SINDROME DI JERVELL E LANGE-NIELSEN
1 11p15.5
KCNQ1
KvLQT1 (Kv7.1)
2 21q22
KCNE1
MinK
CORRENTE IONICA INTERESSATA
IKs
IKr
FATTORE SCATENANTE
CARATTERISTICHE PARTICOLARI/FREQUENZA
42-54%
35-45%
INa
INa-K, INa-Ca, INa
IKs
IKr
IK1
ICa
INa
INa
Attività fisica (nuoto), emozioni
Riposo, emozioni, attività fisica (stimolo
acustico, postpartum)
Riposo, sonno, emozioni
Attività fisica
Attività fisica, emozioni
Riposo, attività fisica
Riposo, attività fisica
Attività fisica, emozioni
Non da sforzo, sonno
Attività fisica, postpartum
IKr
IKs
IK1
ICa
ICa
Attività fisica, riposo (stimolo acustico)
—
Sonno
—
—
—
—
—
—
—
IKs
IKs
Attività fisica (nuoto), emozioni
Attività fisica (nuoto), emozioni
1-7%; sordità
<1%; sordità
1,7-8%; altamente letale
<1%
<1%
<1%
Paralisi periodica, carattere dismorfico
Rara, sindattilia
Rara
<0,1%
Da Morita H, Wu J, Zipes DP The QT syndromes: long and short, Lancet 372:750–762, 2008, p 751, Table 1.
allo stato di omozigosi. La sindrome di Jervell e Lange-Nielsen è
associata a sordità neurosensoriale congenita. Non tutti i pazienti
asintomatici portatori della mutazione genica hanno un intervallo
QT prolungato. L’allungamento del QT può divenire evidente con
l’attività fisica o durante un’infusione di catecolamine.
Gli studi genetici hanno identificato mutazioni nei canali cardiaci del potassio e del sodio (si veda Tab. 429.3). Benché siano
state descritte anche altre forme di LQTS, si tratta in genere di
condizioni molto più rare. La sindrome di Jervell e Lange-Nielsen è stata osservata nei pazienti con mutazioni in omozigosi di
KVLQT1 e minK, mentre lo stato di eterozigosi si manifesta sotto
forma di sindrome di Romano-Ward. Il genotipo consente di predire le manifestazioni cliniche: ad esempio, gli eventi nella LQT1
sono in genere indotti dallo stress, mentre gli eventi nella LQT3
si verificano spesso durante il sonno. Gli eventi nella LQT2 sono
caratterizzati da un pattern intermedio. La LQT3 è associata alla
più elevata probabilità di morte improvvisa, seguita dalla LQT2
e dalla LQT1. I farmaci possono prolungare l’intervallo QT in
modo diretto, ma più spesso questo effetto si verifica quando il loro
metabolismo viene inibito da principi attivi come l’eritromicina o
il ketoconazolo (Tab. 429.4).
La manifestazione clinica delle LQTS nei bambini è molto
spesso rappresentata da un episodio sincopale indotto dall’attività
fisica, da uno spavento o da una sorpresa improvvisa; alcuni eventi
avvengono durante il sonno (LQT3). I pazienti possono giungere
all’osservazione del medico con crisi epilettiche, presincope o
palpitazioni; circa il 10% è inizialmente in arresto cardiaco. La
diagnosi si basa sui criteri clinici ed elettrocardiografici. Non tutti i
pazienti con intervallo del QT lungo hanno una LQTS; pazienti con
intervallo QT normale all’elettrocardiogramma a riposo possono
avere la LQTS. Un intervallo QT corretto per la frequenza cardiaca
>0,47 s è altamente indicativo, mentre un intervallo QT >0,44 s
è suggestivo. Altre caratteristiche comprendono onde T indentate,
alternanza dell’onda T, una bassa frequenza cardiaca per l’età,
un’anamnesi di sincope (specialmente da stress) e un’anamnesi
familiare positiva per LQTS o morte improvvisa inspiegata. Il
monitoraggio Holter delle 24 ore e il test da sforzo aiutano nella
diagnosi. È possibile ricorrere alla genotipizzazione, che è in grado
di identificare la mutazione in circa il 75% dei pazienti con LQTS
C0100.indd 1695
Tabella 429.4 CAUSE ACQUISITE DI PROLUNGAMENTO DEL QT*
FARMACI
Antibiotici: eritromicina, claritromicina, telitromicina, azitromicina, trimetoprim/
sulfametoxazolo
Antimicotici: fluconazolo, itraconazolo, ketoconazolo
Antiprotozoari: pentamidina isetionato
Antistaminici: astemizolo, terfenadina (Seldane; ritirato dal mercato per questa
ragione)
Antidepressivi: triciclici come imipramina, amitriptilina, desipramina
e doxepina
Antipsicotici: aloperidolo, risperidone, fenotiazine quali tioridazina
e clorpromazina
Antiaritmici
Classe IA (bloccanti dei canali del sodio): chinidina, procainamide,
disopiramide
Classe III (prolungano la depolarizzazione): amiodarone (raramente), bretilio,
dofetilide N-acetil-procainamide, sotalolo
Ipolipemizzanti: probucolo
Antianginosi: bepridil
Diuretici (per la perdita di K+): furosemide, acido etacrinico (bumetanide)
Ipoglicemici orali: glibenclamide, gliburide
Insetticidi organofosfati
Stimolanti della motilità: cisapride
Vasodilatatori: prenilamina
SQUILIBRI ELETTROLITICI
Ipokaliemia: diuretici, iperventilazione
Ipocalcemia
Ipomagnesiemia
CONDIZIONI CLINICHE SOTTOSTANTI
Bradicardia: blocco atrioventricolare completo, bradicardia grave, malattia
del nodo del seno
Disfunzione miocardica: cardiotossicità da antracicline, scompenso cardiaco
congestizio, miocardite, tumori cardiaci
Endocrinopatie: iperparatiroidismo, ipotiroidismo, feocromocitoma
Neurologiche: encefalite, trauma cranico, ictus, emorragia subaracnoidea
Nutrizionali: alcolismo, anoressia nervosa, digiuno
*Un elenco più completo e aggiornato dei farmaci che possono provocare un prolungamento
dell’intervallo QTc è disponibile sul sito internet della University of Arizona Center for Education
and Research of Therapeutics (www.azcert.org).
Da Park MY Pediatric cardiology for practitioners, ed 5, Philadelphia, 2008, Mosby/Elsevier,
p 433, Box 24-1.
9/29/12 2:22:28 AM
1696 ■ Parte XX Apparato cardiovascolare
certa in base ai criteri clinici. Benché la genotipizzazione non sia
utile per escludere la diagnosi negli individui con patologia sospetta, in caso di risultati positivi è molto utile ai fini dell’identificazione di familiari del caso indice asintomatici ma affetti dalla
condizione.
Le sindromi del QT breve (si veda Tab. 429.3) si manifestano
con fibrillazione ventricolare o atriale e sono associate a sincope
e a morte improvvisa.
Il trattamento delle LQTS comprende l’impiego di -bloccanti a
dosi che rallentano la frequenza cardiaca in risposta all’attività fisica.
Alcuni pazienti necessitano di un pacemaker a causa dell’estrema
bradicardia indotta dai farmaci. Se gli episodi sincopali continuano a
ripresentarsi nonostante il trattamento, è indicato il posizionamento
di un defibrillatore cardiaco impiantabile per quei pazienti che non
rispondono ai -bloccanti e per quelli che sono andati incontro ad
arresto cardiaco. Secondo studi di correlazione genotipo-fenotipo,
i -bloccanti non sono efficaci nei pazienti con LQT3 e, in tali
individui, è in genere indicato l’impianto di un ICD.
429.6
Disfunzione del nodo del seno
George F. Van Hare
Un arresto sinusale e un blocco senoatriale possono provocare
un’improvvisa interruzione del battito cardiaco. Il primo fenomeno
è presumibilmente causato dalla mancata formazione dell’impulso a livello del nodo del seno e il secondo da un blocco tra il
pacemaker sinusale e l’atrio circostante. Queste aritmie sono rare
nell’infanzia, tranne che quali manifestazioni di intossicazione da
digossina o in pazienti sottoposti a intervento chirurgico esteso a
carico degli atri.
La malattia del nodo del seno dipende da anomalie del nodo
del seno e/o delle vie di conduzione atriali. Si può manifestare in
assenza di cardiopatia congenita e ne sono stati riferiti casi nei
fratelli; tuttavia, si osserva più spesso dopo correzione chirurgica di
difetti cardiaci congeniti, in particolare dopo intervento di Fontan
e intervento di switch atriale (Mustard o Senning) per trasposizione
delle grandi arterie. Le manifestazioni cliniche dipendono dalla
frequenza cardiaca. La maggior parte dei pazienti rimane asintomatica in assenza di terapia, ma possono manifestarsi capogiri e
sincope durante periodi di marcato rallentamento sinusale senza
che vi sia un ritmo di scappamento giunzionale (Fig. 429.10).
L’impianto di pacemaker è indicato in pazienti che manifestano
sintomi, quali intolleranza allo sforzo o sincope.
I pazienti con disfunzione del nodo del seno possono anche
presentare episodi di SVT (sindrome bradicardia-tachicardia) e
sintomi quali palpitazioni, intolleranza allo sforzo o capogiri. Il
trattamento deve essere personalizzato. La terapia farmacologica
per controllare le tachiaritmie (propranololo, sotalolo, amiodarone) può sopprimere la funzione del nodo del seno e del nodo AV al
punto da determinare una bradicardia sintomatica. Pertanto, per
questi pazienti, è in genere necessario l’impianto di un pacemaker
in associazione alla terapia farmacologica, anche in assenza di
sintomi riconducibili a una ridotta frequenza cardiaca.
429.7
Blocco AV
George F. Van Hare
Il blocco AV si può manifestare in tre forme. Nel blocco di primo
grado, l’intervallo PR è prolungato, ma tutti gli impulsi atriali
sono condotti al ventricolo (Fig. 429.11). Nel blocco di secondo
grado alcuni impulsi atriali non sono condotti al ventricolo. In una
variante del blocco di secondo grado, nota come tipo Wenckebach
(o tipo di Mobitz I), l’intervallo PR aumenta progressivamente fino
a che un’onda P non è condotta; nel ciclo successivo al battito mancante, l’intervallo PR si normalizza (si veda Fig. 429.11). Nel tipo
Mobitz II, dopo il battito bloccato, non si osserva alcun ritardo
di conduzione progressivo con successivo accorciamento dell’intervallo PR. Questo difetto di conduzione è meno comune, ma ha
maggiori probabilità di provocare sincope e può essere progressivo.
Il blocco AV di alto grado è una condizione correlata ancora più
preoccupante in cui più di un’onda P consecutiva non conduce. Nel
blocco di terzo grado (blocco cardiaco completo), nessun impulso
dagli atri raggiunge i ventricoli (si veda Fig. 429.11). Generalmente
è presente un ritmo di scappamento indipendente (ma può non
essere affidabile), che provoca sintomi quali sincope.
Il blocco AV completo congenito in età pediatrica è presumibilmente causato da un danno autoimmune del sistema di conduzione
fetale, imputabile ad anticorpi IgG passati dalla madre (anti-SSA/
Ro, anti-SSB/La), quando la madre è affetta da LES conclamato
o (più spesso) asintomatico, oppure da sindrome di Sjögren. Le
patologie autoimmuni costituiscono il 60-70% di tutti i casi di
blocco cardiaco completo e circa l’80% dei casi in cui il cuore non
presenta anomalie strutturali (Fig. 429.12). È stata descritta una
mutazione del gene homeobox, NKX2-5, in cui il blocco AV congenito si osserva molto spesso in associazione a difetti del setto interatriale. Il blocco AV completo si riscontra anche in pazienti con
p
p
p
p
Blocco AV di primo grado
Blocco AV di secondo
grado
Tipo Mobitz I
(fenomeno di Wenckebach)
p
p
p
p
p
p
p
p
p
p
p
p
Tipo Mobitz II
p
p
p
p
p
p
p
p
p
Blocco AV 2:1
R
Blocco AV completo
(di terzo grado)
p
R
p
p
p
R
p
p
p
R
p
p
p
Figura 429.11 Blocco atrioventricolare (AV). (Da Park MY: Pediatric cardiology
for practitioners, ed 5, Philadelphia, 2008, Mosby/Elsevier, p 446, Fig. 25-1.)
Monitoraggio continuo
2,52 s
Figura 429.10 Sindrome bradicardia-tachicardia con disfunzione del nodo del seno.
Si notino gli attacchi di tachicardia sopraventricolare, probabilmente di origine atriale
multifocale, seguiti da lunghi periodi di arresto sinusale e da bradicardia sinusale. Spesso,
i sintomi sono dovuti alle lunghe pause sinusali che si verificano al termine della tachicardia
e non alla tachicardia stessa.
C0100.indd 1696
2,0 s
Figura 429.12 Blocco atrioventricolare (AV) completo congenito. La frequenza
ventricolare è regolare, 53 battiti/min. La frequenza atriale è variabile, da 65 a 95 battiti/
min, e completamente dissociata dal ventricolo. La morfologia QRS è normale, un reperto
comune nel blocco AV completo congenito.
9/29/12 2:22:32 AM
Capitolo 430 Morte improvvisa ■ 1697
cardiopatia congenita e anomalo sviluppo embrionale del sistema
di conduzione. È stato associato a tumori miocardici e miocardite,
ed è una complicanza nota dell’ascesso miocardico secondario a
endocardite. Oltre a essere stato osservato nel quadro di anomalie genetiche, comprese le LQTS e la sindrome di Kearn-Sayre, rappresenta
una complicanza della riparazione di una cardiopatia congenita e,
in particolare, di riparazioni che interessano la chiusura di un difetto
del setto interventricolare.
L’incidenza del blocco cardiaco completo congenito è di 1/20.00025.000 nati vivi; un’elevata un’elevata frequenza di morte fetale può
tuttavia indurre a sottostimare la sua reale incidenza. In alcuni
lattanti, nati da madri affette da LES, il blocco cardiaco completo
non è presente alla nascita, ma si sviluppa nei primi 3-6 mesi dopo
la nascita. L’aritmia, spesso diagnosticata nel feto (secondariamente
alla dissociazione tra le contrazioni atriali e ventricolari osservate
all’ecografia fetale), può causare idrope fetale. I lattanti con cardiopatia congenita e scompenso cardiaco associati hanno un elevato
tasso di mortalità.
Nei bambini più grandi, con un cuore per altri aspetti normale,
la condizione è spesso asintomatica, anche se si possono verificare
sincope e morte improvvisa. I bambini fino ai 3 anni di età possono
avere terrori notturni e mostrare stanchezza con frequenti assopimenti e irritabilità. Il polso periferico è scoccante a causa dell’ampia
gittata sistolica ventricolare compensatoria e della vasodilatazione
periferica; la pressione sistolica è elevata. Le pulsazioni venose
giugulari si verificano irregolarmente e possono essere evidenti
quando l’atrio si contrae mentre la valvola tricuspide è chiusa
(onda cannone). L’attività fisica e l’atropina possono provocare
un’accelerazione della frequenza cardiaca ≥10-20 battiti/min. Sono
spesso udibili soffi sistolici lungo il margine sternale sinistro e non
sono infrequenti soffi apicali mesodiastolici. Il primo tono cardiaco
è variabile per via del mutevole riempimento ventricolare con
dissociazione AV. Il blocco AV porta a un ingrandimento cardiaco
sulla base di un maggiore riempimento diastolico ventricolare.
La diagnosi è confermata dall’elettrocardiogramma; le onde P e i
complessi QRS non hanno un rapporto costante (si veda Fig. 429.12).
La durata del QRS può essere prolungata o anche normale, se il
battito ha inizio nella zona alta del nodo AV o del fascio di His.
La prognosi per il blocco cardiaco completo congenito è di
solito favorevole; i pazienti che sono giunti all’osservazione all’età
di 30-40 anni avevano condotto una vita normale e attiva. Alcuni
pazienti hanno episodi di intolleranza allo sforzo fisico, capogiri e
sincopi (attacchi di Stokes-Adams), sintomo che richiede l’impianto
di un pacemaker cardiaco definitivo. L’impianto di pacemaker deve
essere preso in considerazione per i pazienti che sviluppano sintomi
quali un ingrandimento cardiaco progressivo, pause prolungate o
frequenza cardiaca durante la veglia ≤50 battiti/min. Inoltre, visto
il basso rischio della procedura e la difficoltà nel prevedere chi
svilupperà sintomi gravi improvvisi, negli adolescenti è ragionevole
procedere all’impianto profilattico di pacemaker.
Lo stimolatore cardiaco è raccomandato nei neonati con basse
frequenze ventricolari (≤50 battiti/min), evidenze di scompenso
cardiaco, ritmi a complessi larghi o cardiopatia congenita. L’isoproterenolo, l’atropina o l’adrenalina sono farmaci che possono essere
utilizzati per cercare di aumentare temporaneamente la frequenza
cardiaca in attesa che possa essere predisposto l’impianto di un pacemaker. Nei lattanti sono stati tradizionalmente utilizzati impianti
di pacemaker epicardici transtoracici; il posizionamento per via
venosa di un pacemaker è disponibile per i bambini piccoli.
Un blocco AV completo postoperatorio può verificarsi a seguito
di qualsiasi procedura che richieda una sutura in vicinanza delle
valvole AV o della cresta del setto interventricolare. Esso viene
inizialmente trattato con elettrodi per uno stimolatore temporaneo.
La probabilità di ripristino del ritmo sinusale dopo 10-14 giorni è
bassa e, una volta trascorso questo lasso di tempo, è raccomandato
un pacemaker permanente.
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
C0100.indd 1697
Capitolo 430
Morte improvvisa
George F. Van Hare
La morte improvvisa, eccettuata la sindrome della morte improvvisa
del lattante (Sudden Infant Death Syndrome, SIDS; Cap. 367) è
rara nei soggetti giovani di età inferiore ai 18 anni. La sua origine
può essere traumatica o non traumatica. Le cause traumatiche, le
più comuni nei bambini, comprendono incidenti stradali, morti
violente, decessi durante un’attività ricreativa o sul lavoro. Le morti
improvvise non traumatiche sono spesso dovute a specifiche cause
cardiache. L’incidenza della morte improvvisa va dallo 0,8 al 6,2 su
100.000 all’anno nei bambini e negli adolescenti, in contrasto con la
più elevata incidenza della morte cardiaca improvvisa negli adulti,
che è di 1 su 1.000. Circa il 65% delle morti improvvise è dovuto a
problemi correlati alla sfera cardiaca in pazienti con cuori normali
o con anomalie congenite (corrette, sottoposte a palliazione o non
trattate con intervento chirurgico). Gli sport competitivi praticati
nelle scuole superiori (pallacanestro, calcio) sono fattori ambientali
associati a un rischio elevato. La causa più comune di morte negli
atleti che praticano sport competitivi è la cardiomiopatia ipertrofica,
con o senza ostruzione del tratto di efflusso ventricolare sinistro.
Altre cause potenziali sono elencate nella Tabella 430.1. Queste
possono essere classificate come anomalie strutturali (stenosi aortica
e anomalie delle arterie coronarie comprese), patologie miocardiche
come le miocarditi, patologie del sistema di conduzione, come la
sindrome del QT lungo (LQTS), e cause varie, tra le quali l’ipertensione polmonare e la commotio cordis. I sintomi possono essere
assenti prima dell’evento; in caso contrario, comprendono sincope,
dolore toracico, dispnea e palpitazioni. I pazienti possono avere
un’anamnesi familiare positiva per cardiopatia (cardiomiopatia
dilatativa o ipertrofica, intervallo Q-T lungo, displasia aritmogena
del ventricolo destro, sindrome di Marfan) o per morte improvvisa.
Il decesso fa spesso seguito ad esercizio o sforzo fisico.
MECCANISMI ALLA BASE DELLA MORTE IMPROVVISA
Tre sono i meccanismi responsabili della morte improvvisa: cardiaco, aritmico e non aritmico (cause circolatorie e vascolari) e non
cardiaco. La fibrillazione ventricolare (VF), che è una delle più
comuni cause finali di morte improvvisa negli adulti, rappresenta
la causa finale solo nel 10-20% dei bambini colpiti da morte improvvisa di origine cardiaca. Più comunemente, una bradicardia
porta alla VF o all’asistolia (Cap. 429).
CARDIOPATIE CONGENITE
La stenosi valvolare aortica è il difetto congenito più spesso associato a morte improvvisa in età pediatrica. Secondo i dati storici,
circa il 5% dei bambini con questa patologia muore. Una storia di
sincopi, dolore toracico e segni di grave ostruzione e ipertrofia ventricolare sinistra rappresentano fattori di rischio (Cap. 421.5).
Anche le anomalie delle arterie coronarie sono comunemente
associate a morte improvvisa in bambini e adolescenti. Di queste,
la più comune è l’origine della coronaria principale sinistra dal seno
di Valsava destro. L’arteria coronaria perciò decorre tra l’aorta e
l’arteria polmonare, e può essere anche intramurale. L’esercizio
fisico porta a un aumento della pressione polmonare e aortica, che
comprimono la coronaria principale sinistra e causano ischemia
da compressione o attorcigliamento (kinking).
CARDIOMIOPATIE
Tutti e tre i principali tipi di cardiomiopatia (ipertrofica, dilatativa
e restrittiva) sono associati a morte improvvisa nella popolazione
pediatrica. La morte improvvisa può difatti essere proprio la manifestazione iniziale della cardiomiopatia (Cap. 433).
9/29/12 2:22:32 AM