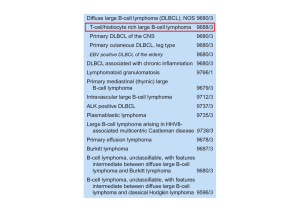
LEUCEMIA A TRICOLEUCOCITI
(Hairy cell leukaemia)
Citologia (su sangue periferico)
1.5-2 volte la taglia di un
linfocita maturo
nucleo occupante i 2/3
della cellula
caratteristica corona di
proiezioni citoplasmatiche
(“cellule capellute”)
possibile rilievo di piccoli
vacuoli (complessi
ribosomiali lamellari)
“Hairy cell”
microscopia
elettronica
Leucemia a tricoleucociti (LTL)
2% dei LNH-B periferici,
età mediana 55 anni
rapporto M/F=5:1
Splenomegalia + pancitopenia (neutropenia, possibile
piastrinopenia, anemia) e monocitopenia + alcuni tricoleucociti circolanti + “dry tap” al mielo-aspirato
Decorso indolente (aumentata suscettibilità alle infezioni)
Remissioni di lunga durata con analoghi delle purine
(cladribrina/2cda, pentostatina)
Organi interessati
Midollo osseo: interstiziale, focale, diffuso
Milza: interessamento della polpa rossa con risparmio e atrofia della
polpa bianca
Fegato: diffusione intrasinusoidale e localizzazione spazi portali
Linfonodo: interessamento dei linfonodi occasionale; in genere
adenopatie dell’asse celiaco, paraortiche alte, retropancreatiche;
con ampie cellule neoplastiche = forma di trasformazione sia nel
linfonodo che nel midollo; si associa a forme di LTL resistenti alla
terapia (Mercieca J et al, Br J Haematol 1992; 82: 547, Br J
Haematol 1996; 93: 409, Leuk Lymph 1994; 14 suppl 1: 79)
Cute:
Cute occasionale localizzazione in paziente pediatrico con nodulo di
2 cm comparso in fase di remissione post terapia (Yetgin et al.
Pediatr Hematol Oncol 2001 18:415)
Midollo osseo
Distribuzione
irregolare
con crescita
infiltrativa o
“patchy”
e risparmio
degli adipociti
No aggregati
paratrabecolari
Focali aree di
aplasia
Midollo osseo
diffusa
sostituzione in
fase avanzata
Midollo osseo
Occasionalmente
LTL mima
un’anemia aplastica
sia clinicamente
(pancitopenia)
sia nell’aspetto
della biopsia
osteomidollare
Soppressione
emopoiesi
da citochine
prodotte da LTL
cellularita’ lassa/depleta
aspetto
“a uovo fritto”
aspetti dovuti al
citoplasma abbondante e
poco evidente e a
deposizione di fibronectina
Fibrosi midollare
Deposizione di matrice
di fibronectina
prodotta e secreta
dagli elementi
neoplastici *
e produzione e
deposizione di fibre
reticoliniche (fibrille
collagene tipo III) da
parte dei fibroblasti
“dry tap”
all’aspirato
* Burthem J et al. Blood 1994; 83: 497
Morfologia
cellulare
Piccola taglia: 1.5-2
volte un linfocita normale
Dimensioni uniformi
(assenza di blasti)
Nucleo di forma
irregolare
ovale, rotondeggiante
reniforme, indentato
fusato, bilobato
Cromatina uniforme,
granulare
Nucleolo assente o
singolo e poco evidente
Mastocitosi
Le caratteristiche nucleari
e l’ aspetto distanziato della
popolazione neoplastica, possono
mimare processi patologici
non linfoidi:
Mastocitosi, LAM-M5b, LAM-M3
Hairy cells
LAM M3
LAM M5b
apl
Hairy cells
Le cellule
neoplastiche
infiltrano e
sostituiscono
l’endotelio
dei seni midollari
provocando la
degenerazione
della membrana
basale e lo
stravaso di eritrociti
Emopoiesi residua costituita da
isole eritroidi
Megacariocitopoiesi
residua
Fenomeni di accompagnamento
Incremento in plasmacellule
policlonali
Frequente incremento
dei mastociti in aree
di infiltrazione
Milza: interessamento polpa rossa
Stravasi emorragici splenici
Pattern di infiltrazione epatica
sinusoidi
Spazi portali
CD20
Reticolo
Linfonodo
CG
FENOTIPO
Su materiale fresco
SIg+(M+/-D, G or A), CD19+,
CD20+, CD22+, CD25+, CD79a+,
CD79b+, FMC7+, CD11c+s,
CD25+s, CD103+
CD20
Su sezioni di routine
CD20+, CD79a+, CD22+,
DBA.44+, Annexin A1+,
CD5 -, CD23 -, CD21 -,
CD25+, CD11c +, CD123 +,
CD45/LCA+ CD45RA+,
CD68/KP1+ , BSAP+,
SIg+(M, D, G or A),
Bcl6-, IRF4-, IRTA1-
espressione markers pan-B
DBA44
milza
midollo
Am J Surg Pathol 2005; 29: 474
DBA44: specifico per HCL, ma anche in LF
(44%), PMBCL (44%), DLBCL, MCL, TCL
TRAP: specifico per HCL, ma anche in LM
(57%), LLC-B (41%), MZL extranodali
(29%), PMBCL (44%), DLBCL
DBA44/TRAP in tutte le HCL
(solo 3% dei non-HCL rappresentati da
LBCL, LLC-B, LM, LF,)
LF, (840 LNH esaminati)
Alta specificità dell’ espressione
combinata di TRAP+/DBA44+
CD23
IRF4/MUM1
CD68KP1
CD103
CD103 non è espresso
dagli elementi B
normali; subunità alfa
di integrina espressa
dai linfociti T della
mucosa intestinale
(Mulliugam SP et al
1990; 76: 959)
Antigeni espressi
da linfociti T
citotossici
T-bet Transcription Factor Detection
Facilitates the Diagnosis of Minimal Hairy
Cell Leukemia Infiltrates in Bone Marrow
Trephines
(Johrens K Am J Surg Pathol 2007; 31:
1181-85)
Polpa bianca
negativa
CD11c: milza
Espressione di recettori per le citochine
CD123/IL3rα
Espressa da NK, neoplasie dei precursori
dendritici, LAL-B
CD25/IL2rα: milza
positivo in citofluorimetria
nel 98% delle LTL
(9% LTL-variante e 3% SLVL)
(Del Giudice I et al Haematologica
2004; 89:303)
Combinazione di CD11c + CD25 + CD103 ± CD123 compongono uno scoring-system
per la diagnosi di LTL
(Matutes E et al Leuk Lymphoma 1994; 14 suppl 1: 57)
CD22
polpa bianca
Possibile target
terapeutico per BL22
CICLINA D1 +
proteina Ciclina D1+
iperespressa in 50-75% dei casi
con reattività variabile > debole
NO anomalia genetica
(no traslocazioni o mutazioni):
meccanismi di attivazione CCND1
diversi rispetto a t(11;14)
Bosch F al. Br J Haematol 1995; 91: 1085
Miranda RN et al Mod Pathol 2000; 13:1308
Marcatori occasionalmente espressi
CD10
espresso nel 10-15% dei casi
non si associa ad espressione di BCL6
morfologia tipica della LTL
clinica tipica di LTL
(Tammy M et al AJCP 2003; 120:228
Chen YH et al AJCP 2006; 125: 251)
CD10
CD5
Positività riportata in un singolo case report
Non influisce su morfologia e clinica
(Usha et al Acta Haematol 2000; 103:210)
Espressione delle catene delle
immunoglobuline
Le “Hairy cells” esprimono frequentemente IgG, in particolare
l’ isotipo IgG3
(Kluin-Nelemans HC Blood 1990; 75: 972)
In una parte dei casi si osserva la coespressione varie IgH sulla
superficie della stessa cellula, fino a 4 tipi di catene pesanti
clonalmente relate (IgM, IgD, IgA, IgG);
(Forconi F et al Blood 2001; 98: 1174, Forconi F et al Blood 2004;
104:3312)
Il rapporto tra LTL che esprimono le catene k e λ è di 1:1;
incremento di casi λ+ rispetto ad altri tipi di linfoma
(Arons E et al Leuk Res 2007; 31: 1231)
gene
proteina
Unsupervised clustering analysis of 11 BM biopsies and 3
PB samples
HCL differisce dalle cellule B normali,
da quelle del CG e dalle memory.
Da queste differisce per espressione
di citochine, chemochine e di
molecole di adesione
N: naïve
LCL: lymphoblastoid
M: memory
MM: multiple myeloma
GC: germinal centre
Similmente alla B-CLL, HCL non ha
translocazioni reciproche bilanciate
(MBC derivation)!
Supervised analysis
Set of 89 deregulated genes:
Adhesion: TIMP-1, TIMP-4, RECK,
CCR7 (↓)
Morphology: LSP1, F-actin, Gas7,
EPB4.1L2
Phagocytosis: Annexin A1, c-Maf
Fibrosis: IL-3αR, FLT3
Therapy: IFαR
Simple diagnostic assay for Hairy Cell
Leukaemia by immunocytochemical
detection of annexin A1
Brunangelo Falini, Enrico Tiacci, Arcangelo
Liso, Katia Basso, Elena Sabattini, Roberta
Pacini, Robert Foa, Alessandro Pulsoni,
Riccardo Dalla Favera, Stefano A. Pileri
The Lancet, 363:1869-70, 2004.
LYMPHOMA TYPE
HCL
HCL variant
B-CLL
Prolymphocytic leukaemia
(N= 500)
ANXA1*
64
62/64**
8
0/8
80
0/80
3
0/3
Splenic MZL***
50
0/50
Nodal MZL
15
0/15
Lymphoplasmocytic
lymphoma
30
0/30
Follicular Lymphoma
65
0/65
Mantle cell lymphoma
14
0/14
DLCL-B
100
0/100
Burkitt lymphoma
10
0/10
Myeloma
50
0/50
HCL: annexin A1: Pre-therapy
HCL: annexin A1: Post-therapy
LYMPHOMA TYPE
HCL
HCL variant
B-CLL
Prolymphocytic leukaemia
(N= 500)
ANXA1*
64
62/64**
8
80
3
0/8
0/80
0/3
Splenic MZL***
50
0/50
Nodal MZL
15
0/15
Lymphoplasmocytic
lymphoma
30
0/30
Follicular Lymphoma
65
0/65
Mantle cell lymphoma
14
0/14
DLCL-B
100
0/100
Burkitt lymphoma
10
0/10
Myeloma
50
0/50
SMZL/BM: Annexin A1
FL/BM: Annexin A1
LPL/BM: Annexin A1
DLBCL/BM: Annexin A1
LYMPHOMA TYPE
HCL
HCL variant
B-CLL
Prolymphocytic leukaemia
(N= 500)
ANXA1*
64
62/64**
8
0/8
80
0/80
3
0/3
Splenic MZL***
50
0/50
Nodal MZL
15
0/15
Lymphoplasmocytic
lymphoma
30
0/30
Follicular Lymphoma
65
0/65
Mantle cell lymphoma
14
0/14
DLCL-B
100
0/100
Burkitt lymphoma
10
0/10
Myeloma
50
0/50
Possibili associazioni con
LLC-B: Ginè et al. Leukaemia 2002 16:1454
LMC: Pajor et al. Cancer Genet Cytogenet 2002, 15:134
LGL: Xie et al. Leuk Lymph 2000, 37:97
Associato ad altre emopatie
Due casi con sviluppo successivo di LGL durante il decorso
della LTL
risposta immune abnorme al tumore primario ?
Evoluzione
Possibile anche se molto rara l’evoluzione verso un LGCBD (spesso
TRAP+)
P53+ verosimilmente coinvolto nella trasformazione
(Sun et al Hum Pathol 2004,11:1423)
Hairy cell leukaemia
“variante”
Wu ML et al. Arch Pathol Lab Med
2000; 124: 1710.
Matutes E et al. Best Pract
Res Clin Haematol 2003; 16:41.
HCL variant / HCL prolinfocitoide
Cawley et al. Leuk Res 1980; 4: 547.
Rara e controversa (caratteristiche che ricordano LTL, LPL,
SMZL)
¾Pazienti più anziani (8° decade), M/F=2/1
¾Sintomi (dolore addominale e/o pancitopenia);
¾85% splenomegalia, 19% epatomegalia, 4% linfoadenopatie;
¾leucocitosi (90%) (34,000/ml) con cellule atipiche (100%);
¾no monocitopenia.
1. Patterns di infiltrazione midollare simili alla LTL classica
2. No “dry tap” per assenza di fibrosi
3. cellule di media taglia con citoplasma chiaro ed ampio, basofilo,
cromatina meno dispersa e nucleolo prominente; occasionali
cellule di grande taglia (tipo blasti trasformati)
4. Fenotipo:
ANNEXIN 1A -, CD25-, CD5-;
CD11c+, FMC7+, CD22+;
CD103+/-, CD72/DBA.44-/+, CD79b-/+, TRAP-/+, CD10rare (Japan), CD38
rare (Japan), IgG + o possibile coespressione di diverse IgH, λ>k
4. Biologia molecolare: espressione del gene VH4-34 legata a
prognosi peggiore. Arons E, Leuk Lymphoma, 2011, June
Storia naturale
Decorso più aggressivo rispetto a LTL classica
Meno responsiva alla terapia
La mediana di sopravvivenza è di 10 anni dalla diagnosi
Nel 5-10% dei casi evolve in forme più aggressive a
grandi cellule mantenendo lo stesso fenotipo (sintomi B,
leucocitosi, breve sopravvivenza) (Matutes et al
Leukemia 2001; 15: 184)
DBA.44
CD20
HCL variant/BM: Annexin A1
Determinazione della malattia minima residua
Nel 15-50% dei pazienti, è dimostrabile una malattia
residua post-terapia
Quando i tricoleucociti non sono
evidenziabili
morfologicamente ma solo con IIC,
citofluorimetria o PCR
si utilizza il termine MALATTIA
MINIMA RESIDUA (MMR)
Diversi studi suggeriscono l’efficacia
della determinazione della MMR nel
predire la “relapse” clinica di malattia,
ma è anche evidente che in parte dei
pazienti con MMR, la LTL non
progredisce o recidiva solo a distanza
di molti anni (Ellison et al Blood 1994;
84: 4319)
Malattia congelata?
VALORE PREDITTIVO DELLA MMR
INCERTO
DETERMINAZIONE DELLA MMR MEDIANTE
IMMUNOISTOCHIMICA SU BOM
Se l’infiltrato neoplastico è <10% della cellularità midollare,
per il pattern interstiziale di crescita e la somiglianza delle
“Hairy cells “ con i monociti e gli elementi mieloidi, la
MMR può non essere visibile all’esame morfologico
Immunoistochimica con CD20/DBA44
(DBA44 può evidenziare i processi citoplasmatici)
N.B.: una piccola quota di elementi B midollari normali
può esprimere DBA44
DBA44: pre-terapia
DBA44: post
DBA44: post
Mhawech et al. Arch Pathol Lab Med 2006; 130:374
Patterns potenzialmente predittivi di malattia minima
residua (con DBA.44 in IIC, in pz. Trattati con cladribrina);
piccola casistica (17 pazienti)
Gruppo 1: “rare scattered suspicious HC cells”<1%
MRD stabile lungo il follow up; RC mantenuta;
Gruppo 2: “1-5% cellule HC”
più eterogeneo con 50% di RC mantenute e 50% di
ricadute
Gruppo 3: “MRD >5%”
prevalgono le ricadute