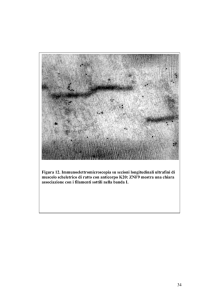
Monoclonal Mouse
Anti-Human Mast Cell Tryptase
Clone AA1
Codice N. M 7052
Edizione 18.12.02
Uso previsto
Per uso diagnostico in vitro.
L’uso del Monoclonal Mouse Anti-Human Mast Cell Tryptase clone AA1, è previsto in immunocitochimica.
L’anticorpo marca i mastociti umani ed è uno strumento utile al riconoscimento di mastociti (MC) molto atipici o
immaturi nella leucemia mastocitaria e alla localizzazione di infiltrati densi focali di MC, piccoli, anche
minuscoli, nelle procedure di stadiazione nei pazienti con mastocitosi cutanea accertata (1). L’identificazione
differenziale è facilitata dai risultati di un gruppo di anticorpi. L’interpretazione spetta a un patologo qualificato,
nel contesto dell’anamnesi del paziente e degli altri test diagnostici.
Introduzione
Le triptasi mastocitarie umane (EC 3.4.21.59) consistono in una famiglia di serino-proteasi neutre tripsino-simili
che vengono espresse prevalentemente nei mastociti (2). Nella sua forma enzimaticamente attiva, la triptasi
mastocitaria esiste come tetramero formato da legami non covalenti di 132 kDa (2,3). La triptasi mastocitaria è
capace di degradare il peptide intestinale vasoattivo e di attivare la precallicreina così come di generare le
chinine, tutti mediatori importanti coinvolti nella broncocostrizione e nell’iperresponsività delle vie aeree, tra le
principali cause concomitanti della broncopneumopatia allergica (2). La triptasi mastocitaria mostra anche un
effetto mitogenico sulle cellule muscolari lisce delle vie respiratorie umane e sui fibroblasti polmonari e cutanei
umani. Sia l’iperplasia, sia le modificazioni fibrotiche del muscolo liscio possono condurre a un ispessimento
della parete delle vie respiratorie e a una riduzione irreversibile del calibro delle stesse (2). Diversi fattori di
stimolo sono in grado di attivare i mastociti, tra gli altri gli antigeni, i superossidi, le proteine del complemento, i
neuropeptidi e le lipoproteine, che ne determinano l’attivazione e la degranulazione. La degranulazione dei
mastociti e il conseguente rilascio di triptasi mastocitaria, così come di istamina, leucotrieni e citochine nel
tessuto circostante è un evento fondamentale in una risposta infiammatoria e sembra giocare un ruolo
importante nella difesa dell’ospite nei confronti dei patogeni (4). I mastociti svolgono un ruolo attivo in patologie
diverse quali l’aterosclerosi, l’asma, l’artrite, la fibrosi del dotto biliare, le neoplasie e la fibrosi polmonare (4, 5).
L’identificazione dei mastociti attraverso la colorazione dei tessuti con anticorpi specifici per la triptasi
mastocitaria umana è risultata utile nell’identificazione di infiltrati di MC focali e diffusi nella malattia
mastocitaria primaria e nella mastocitosi. La dimostrazione della presenza della triptasi mastocitaria è
essenziale per l’identificazione di MC fortemente atipici, con scarsi granuli o perfino non metacromatici, in
particolar modo nella leucemia mastocitaria, e per la localizzazione di infiltrati mastocitari piccoli o minuscoli
(1).
Reagente fornito
Anticorpo monoclonale di topo fornito in forma liquida come supernatante di coltura cellulare dializzato con
Tris/HCl 0,05 mol/L, a pH 7,2 e contenente 15 mmol/L di NaN3.
Clone: AA1 (3). Isotipo: IgG1, kappa.
Concentrazione delle IgG di topo: vedere l’etichetta sulla fiala.
Immunogeno
Triptasi mastocitaria isolata da polmone umano (3).
Specificità
Nel Western blotting di un estratto di polmone umano ricco di triptasi in condizioni riducenti, l’anticorpo marca
una banda di circa 32,5 kDa corrispondente alla triptasi mastocitaria umana (3).
Nel test ELISA indiretto l’anticorpo reagisce con la triptasi mastocitaria umana purificata (3).
Il legame dell’anticorpo con la triptasi mastocitaria non influenza l’attività enzimatica (3).
Il trattamento della triptasi mastocitaria con periodato non ha effetti sulla marcatura anticorpale, indicando che
gli epitopi costituiti da carboidrati non partecipano al riconoscimento dell’anticorpo. Il riconoscimento
dell’anticorpo non viene neppure influenzato dalla presenza di eparina (3).
Precauzioni
1. Per operatori specializzati.
2. Questo prodotto contiene sodio azide (NaN3), sostanza chimica altamente tossica allo stato puro. Alle
concentrazioni indicate, il prodotto non è classificato come pericoloso, ma la sodio azide potrebbe reagire con
le tubature in piombo e rame formando azidi metalliche altamente esplosive. Per lo smaltimento del prodotto è
consigliabile sciacquare abbondantemente per prevenire la formazione di azidi metalliche nelle tubature.
3. Come per ogni prodotto di derivazione biologica, utilizzare procedure di manipolazione adeguate.
Conservazione
Conservare a 2-8 °C. Non utilizzare dopo la data di scadenza stampata sulla fiala. Se i reagenti vengono
conservati in condizioni diverse da quelle specificate, è necessario che l’utilizzatore ne verifichi le condizioni.
Non ci sono segni evidenti che indichino l’instabilità del prodotto. Quindi è necessario effettuare
simultaneamente controlli positivi e negativi con i campioni ottenuti dal paziente. In caso di colorazione inattesa
non spiegabile con modificazioni delle procedure di laboratorio e qualora si sospetti un problema con
l’anticorpo, contattareil nostro Sevizio Tecnico.
Preparazione del campione
Sezioni in paraffina: l’anticorpo può essere utilizzato per marcare sezioni di tessuto incluse in paraffina fissate in
formalina o nel reagente di Carnoy, anche se la fissazione in formalina permette una migliore conservazione
dell’integrità strutturale dei mastociti (6). E’ necessario un pretrattamento dei tessuti con lo smascheramento
termoindotto dell’epitopo. Per i tessuti fissati in formalina si ottengono risultati ottimali con la Soluzione di
riconoscimento bersaglio codice n. S 1700 o con la Soluzione di riconoscimento bersaglio codice n. S 3308,
con tampone citrato 10 mmol/L, a pH 6,0, o con tampone Tris 10 mmol/L, EDTA 1 mmol/L, a pH 9,0. Il
pretrattamento dei tessuti con proteinasi K o con tripsina (6) si è rivelato meno efficiente. Le sezioni di tessuto
(103691-002)
M 7052/IT/SUA/18.12.02 p 1/2
Dako Denmark A/S · Produktionsvej 42 · DK-2600 Glostrup · Denmark · Tel. +45 44 85 95 00 · Fax +45 44 85 95 95 · CVR No. 33 21 13 17
non devono essiccarsi durante il trattamento o durante la successiva procedura di colorazione
immunocitochimica.
Sezioni congelate e preparazioni cellulari: l’anticorpo può essere utilizzato per la marcatura di sezioni
congelate, fissate con il reagente di Carnoy o in acetone/metanolo e di preparazioni cellulari (3).
Procedura di colorazione
Diluizione: l’Anticorpo monoclonale di topo anti-triptasi mastocitaria umana codice n. M 7052, può essere
utilizzato in un intervallo di diluizioni compreso tra 1:100 e 1:200 quando applicato su sezioni di tonsilla umana
fissate in formalina, incluse in paraffina, e utilizzando 20 minuti di smascheramento termoindotto dell’epitopo
con la Soluzione di riconoscimento bersaglio codice n. S 1700, e 30 minuti di incubazione a temperatura
ambiente con l’anticorpo primario. Le condizioni ottimali possono variare in base al campione e al metodo di
preparazione e devono essere stabilite individualmente da ciascun laboratorio. Il controllo negativo consigliato è
l’IgG1 di topo codice n. X 0931, diluito alla stessa concentrazione di IgG di topo dell’anticorpo primario. A meno che
la stabilità dell’anticorpo diluito e del controllo negativo non siano stati accertati nella procedura di colorazione
effettiva, si raccomanda di diluire i reagenti immediatamente prima dell’uso, oppure diluire nel Diluente per
anticorpo codice n. S 0809. I controlli positivi e negativi devono essere effettuati simultaneamente con i campioni
ottenuti dal paziente.
Visualizzazione: si consiglia l’utilizzo del kit DAKO LSAB™+/HRP, codice n. K 0679, e dei kit DAKO
EnVision™+/HRP, codici nn. K 4004 e K 4006. Per le sezioni congelate e le preparazioni cellulari, nei casi in
cui la colorazione con perossidasi endogena crei delle preoccupazioni, una buona alternativa è rappresentata
dal kit Dako APAAP, codice n. K 0670. Seguire le procedure allegate al kit di visualizzazione prescelto.
Limititazioni specifiche
del prodotto
Caratteristiche specifiche
della performance
Una marcatura non specifica di collagene, in campioni fissati con il reagente di Carnoy, è stata riportata in uno
studio (7), ma non in un altro (6).
Le cellule marcate con l’anticorpo mostrano un pattern di colorazione granulare citoplasmatica altamente
specifico, corrispondente ai granuli di secrezione dei mastociti (3).
Tessuti normali: l’anticorpo marca i mastociti (MC) in modo specifico in diversi tessuti umani, tra i quali il
polmone, la tonsilla, il colon, la mucosa gastrica e la cute, mentre nella ghiandola pituitaria è possibile
individuare solo qualche MC (6). L’anticorpo non marca i granulociti basofili, eosinofili o neutrofili, i monociti o i
linfociti così come non è stata osservata alcuna marcatura dei cheratinociti (3).
Tessuti anormali: in uno studio su oltre 150 casi di diversi disturbi a carico dei MC, è stato dimostrato che nella
maggior parte dei casi nel midollo osseo in condizioni normali o reattive venivano marcati <4 MC/mm 2, mentre
nelle sindromi mielodisplastiche ne venivano marcati > 5 ma <100. Più di 100 MC/mm 2 sono stati individuati
nelle neoplasie mastocitarie, e spesso sono stati osservati casi con numeri molto più elevati (massimo 2655
MC/mm2) (1). In uno studio su 7 pazienti con congiuntivite allergica stagionale, l’anticorpo ha dimostrato una
densità media di MC nello stroma congiuntivale di 106/mm 2 rispetto ai 57,4/mm2 in 8 soggetti normali. Nei
soggetti allergici è stata anche dimostrata la presenza di cellule triptasi positive intraepiteliali, mai individuate
nei controlli normali (7). Nella zona circostante il dotto biliare sottolobulare del fegato, il numero di MC marcati
dall’anticorpo in 45 fegati cirrotici è risultato mediamente di 59,0 MC/mm 2, un numero significativamente più
elevato rispetto alla densità media di soli 39,4 MC/mm2 riscontrata in 71 fegati normali (5).
Riferimenti bibliografici
1. Horny H-P, Valent P. Diagnosis of mastocytosis: general histopathological aspects, morphological criteria,
and immunohistochemical findings. Leuk Res 2001:25;543-51.
2. Abraham WM. Tryptase: potential role in airway inflammation and remodelling. Am J Physiol Lung Cell Mol
Physiol 2002;282:L193-L196.
3. Walls AF, Bennett AR, McBride HM, Glennie MJ, Holgate ST, Church MK. Production and characterization of
monoclonal antibodies specific for human mast cell tryptase. Clin Exp Allergy 1990;20:581-9.
4. Krishnaswamy G, Kelley J, Johnson D, Youngberg D, Stone W, Huang S-K, et al. The human mast cell:
functions in physiology and disease. Front Biosci 2001;6:d1109-27.
5. Koda W, Harada K, Tsuneyama K, Kono N, Sasaki M, Matsui O, et al. Evidence of the participation of
peribiliary mast cells in regulation of the peribiliary vascular plexus along the intrahepatic biliary tree. Lab
Invest 2000;80:1007-17.
6. Walls AF, Jones DB, Williams JH, Church MK, Holgate ST. Immunohistochemical identification of mast
cells in formaldehyde-fixed tissue using monoclonal antibodies specific for tryptase. J Pathol 1990:162:11926.
7. Morgan SJ, Williams JH, Walls AF, Church MK, Holgate ST, McGill JI. Mast cell numbers and staining
characteristics in the normal and allergic human conjunctiva. J Allergy Clin Immunol 1991;87:111-6.
Legenda dei simboli
(103691-002)
Numero di catalogo
Limiti di temperatura
Dispositivo medico-diagnostico
in vitro
Codice del lotto
Consultarele istruzioni per
l’uso
Utilizzare entro
Fabbricante
M 7052/IT/SUA/18.12.02 p 2/2
Dako Denmark A/S · Produktionsvej 42 · DK-2600 Glostrup · Denmark · Tel. +45 44 85 95 00 · Fax +45 44 85 95 95 · CVR No. 33 21 13 17