SCLEROSI MULTIPLA, CON ALEMTUZUMAB
ANCHE A 3 ANNI RIDOTTE ATROFIA
CEREBRALE E NUMERO DI NUOVE LESIONI
02 maggio 2014
Al 66esimo Meeting Annuale dell’American Academy of Neurology, sono stati presentati nuovi
risultati emersi dal programma di sviluppo clinico di alemtuzumab che confermano il mantenimento
a 3 anni del rallentamento dell’atrofia cerebrale e della riduzione del numero di nuove lesioni nei
pazienti affetti da sclerosi multipla (SM).
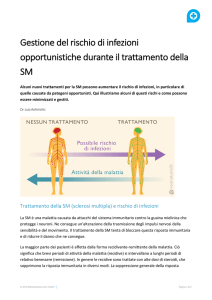
Nei pazienti trattati con alemtuzumab che hanno preso parte ai due studi clinici di Fase III (sia
pazienti che non erano stati precedentemente sottoposti a terapia sia pazienti che manifestavano
attività di malattia anche se in trattamento con altra terapia), i risultati osservati attraverso la RMN
dopo due anni sono stati mantenuti durante il primo anno di estensione dello studio.
Questi dati, che vengono presentati oggi comprendono:
• Coerenza degli effetti riscontrati sui parametri di misurazione dell’attività di malattia (lesioni
attive captanti il gadolinio, iperintense in T2 ed ipointense in T1) ed effetti visibili dopo due anni di
trattamento mantenuti fino al 3° anno;
• Oltre il 70% dei pazienti, durante il terzo anno di follow-up, è rimasto libero da attività indicativa
di infiammazione acuta rilevabile attraverso la RMN, definita come lesione captante il gadolinio o
nuova o più estesa lesione iperintensa in T2.
•I volumi delle lesioni T2, che riflettono il peso combinato delle lesioni cerebrali permanenti e di
quelle di nuova formazione, sono aumentati dall’anno due all’anno tre, ma sono rimasti al di sotto
del livello misurato alla baseline prima del trattamento.
• Il tasso di atrofia, misurato in funzione della frazione parenchimale cerebrale, già ridotto dopo
due anni, ha continuato a diminuire nel terzo anno di follow-up.
• L’80% circa dei pazienti trattati con alemtuzumab non è stato sottoposto ad un terzo ciclo di
trattamento nel primo anno di estensione dello studio.
"La cosa più straordinaria di questi dati è che gli effetti positivi di alemtuzumab rilevati con RMN si
sono mantenuti nello studio di estensione, anche se la maggior parte dei pazienti non era stata
sottoposta ad un ulteriore trattamento con il farmaco. Questo risultato è unico nel panorama attuale
delle terapie per la SM", ha detto Douglas Arnold, MD, NeuroRx Ricerca e Dipartimento di
Neurologia e Neurochirurgia, Montreal Neurological Institute, McGill University. "I nuovi risultati
acquisiti attraverso RMN sono un importante ulteriore contributo al complesso dei dati clinici di
estensione dello studio che ha dimostrato l'effetto di alemtuzumab sui parametri chiave di attività
clinica di malattia, compreso il tasso annualizzato di ricaduta e l'accumulo sostenuto di disabilità."
I più comuni eventi avversi attribuibili ad alemtuzumab sono risultati le reazioni associate
all’infusione (mal di testa, rash, febbre, nausea, affaticamento, orticaria, insonnia, prurito, diarrea,
raffreddamento, vertigini e rossore), le infezioni (alte vie respiratorie e tratto urinario) e linfopenia.
Nei pazienti trattati con alemtuzumab possono presentarsi malattie autoimmuni (comprese
trombocitopenia autoimmune, altre citopenie, glomerulonefriti e tiroiditi autoimmuni) e infezioni
gravi.
Per supportare la precoce individuazione e tempestiva gestione di tali eventi avversi, è stato
predisposto un esauriente programma di gestione del rischio che comprende specifiche iniziative di
formazione e il monitoraggio periodico dei pazienti.
Gli studi di Fase III su alemtuzumab erano randomizzati, prevedevano una durata di 2 anni ed
hanno messo a confronto la molecola con interferone beta-1a ad alto dosaggio somministrato per
iniezione sottocutanea nei pazienti con SM recidivante remittente attiva non sottoposti a precedente
trattamento (CARE-MS I) o che avevano avuto almeno una recidiva durante la terapia
pregressa (CARE-MS II). In questi studi i pazienti trattati con alemtuzumab sono stati sottoposti a
due cicli di trattamento, consistenti nell’infusione endovenosa del farmaco per cinque giorni
consecutivi durante il primo e, a dodici mesi di distanza, in una nuova infusione per tre giorni
consecutivi durante il secondo.
Nel periodo di estensione dello studio, i pazienti trattati con alemtuzumab che avevano continuato
ininterrottamente il follow up, sono stati considerati eleggibili al ri-trattamento qualora avessero
manifestato la comparsa di malattia attiva. Questa analisi ha interessato 349 pazienti trattati con
alemtuzumab nello studio CARE-MS I e 393 pazienti trattati con alemtuzumab nello studio CAREMS II; il 18 ed il 20% di loro, rispettivamente, è stato sottoposto a ri-trattamento. Le scansioni con
RMN sono state effettuate negli studi CARE-MS all’inclusione ed a 12, 24 e 36 mesi.
Alemtuzumab
Alemtuzumab è approvato nell'Unione Europea, in Australia, in Brasile, Canada e Messico. Non è
attualmente approvato negli Stati Uniti. A seguito di discussioni con l’Fda, Genzyme prevede di
ripresentare la richiesta di approvazione di alemtuzumab negli Stati Uniti nel secondo trimestre del
2014.
Alemtuzumab è supportato da un programma di sviluppo clinico completo ed esteso che ha
coinvolto circa 1.500 pazienti e 5.400 pazienti-anno di follow-up.
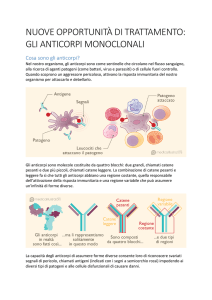
Alemtuzumab è un anticorpo monoclonale che colpisce in modo selettivo la CD52, una proteina
presente in grandi quantità sulla superficie delle cellule T e B. Il trattamento con alemtuzumab
determina la deplezione delle cellule T e B circolanti, ritenute responsabili del dannoso processo
infiammatorio tipico della sclerosi multipla. Alemtuzumab esercita un impatto minimo sulle altre
cellule immunitarie. L’acuto effetto antinfiammatorio di alemtuzumab è seguito immediatamente
dalla comparsa di uno schema distintivo di ripopolamento delle cellule T e B che si protrae nel
tempo, ristabilendo l’equilibrio del sistema immunitario con modalità che riducono potenzialmente
l’attività della malattia.