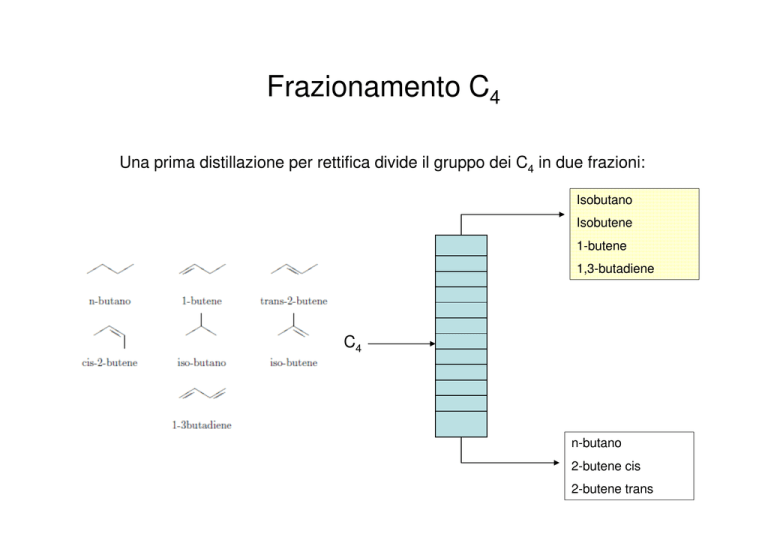
Frazionamento C4
Una prima distillazione per rettifica divide il gruppo dei C4 in due frazioni:
Isobutano
Isobutene
1-butene
1,3-butadiene
C4
n-butano
2-butene cis
2-butene trans
Frazionamento isobutano, isobutene, 1-butene e
1,3-butadiene
I prodotti di testa della prima distillazione vengono sottoposti ad un‘ulteriore
distillazione comune od estrattiva (acetonitrile CH3CN, acetone (CH3)2CO o
furfurolo come solvente):
Isobutano
solvente
Isobutano
Isobutene
1-butene
1,3-butadiene
Isobutene
1-butene
1,3-butadiene
+ solvente
DIOLEFINE
Butadiene
Produzione butadiene
Per steam-cracking
La strada più importante per la produzione di butadiene è rappresentata dallo
steam-cracking realizzato su una carica di alimentazione costituita da nafta: il 9%
di tale carica viene recuperato sotto forma di frazione idrocarburica C4 ed il 45%,
50% di tale quantità è rappresentato da butadiene.
Bisogna a questo punto separare il butadiene dagli componenti (1-butene e
isobutene). Si effettua una distillazione estrattiva
Impiego: distillazione estrattiva
Consiste nell’uso in questo caso di solventi polari, che data la diversa struttura
elettronica dei composti paraffinici ed olefinici (e di conseguenza la polarita
e polarizzabilita), fa si che la volatilita relativa degli idrocarburi olefinici sia
diventi notevolmente differente.
Le caratteristiche che il solvente deve avere sono:
•
l'elevata polarità, (con elevata selettività);
•
una temperatura di ebollizione elevata rispetto al componente
estratto
in modo da facilitare la fase successiva di separazione dell'estratto;
•
una certa stabilità termica per evitare degradazione nei diversi
cicli di utilizzo;
•
un costo sufficientemente basso da giustificarne l'impiego.
Recupero butadiene
Si ha quindi una prima operazione di distillazione estrattiva usando una
colonna dalla cui testa viene inserita la soluzione cuproammoniacale, mentre
dalla coda viene alimentato il gas di partenza.
Sul fondo della colonna viene alimentata
anche una ridotta quantità di butadiene,
utile al fine di strippare dalla soluzione
liquida le minime quantità degli altri
idrocarburi insaturi trattenute da questa
sulla base dei valori di equilibrio della
loro solubilità.
Il processo Esso sfrutta una soluzione cuproammoniacale. La diolefina forma con
questo un complesso labile che può essere facilmente decomposto per semplice
riscaldamento, si ha quindi una prima operazione di estrazione usando una colonna
dalla cui testa viene inserita la soluzione cuproammoniacale, mentre dalla coda viene
alimentato il gas di partenza. All'uscita della colonna di estrazione si ottengono 1-butane
e isobutene dalla testa, mentre la soluzione contenente butadiene viene dapprima
riscaldata per ottenere la dissociazione del complesso e successivamente inviata ad
una serie di colonne di distillazione per il recupero del solvente dal butadiene. L'intero
impianto opera a bassa pressione e permette la separazione anche con piccole
percentuali di 1,3-butadiene.
1-butene e isobutene
(CH3COO)2Cu(NH4)4
1-butene,
isobutene
1,3-butadiene
Complesso acetato +
butadiene allo
strippaggio con H2O
vapore
Recupero isobutene
La fase successiva alla separazione del butadiene dalla miscela alimentata prevede la
separazione dell'isobutene dalla miscela rimanente. L'isobutene può essere separato in
maniera selettiva da 1-butene per semplice estrazione con una soluzione di acido
solforico al 40-50%.
1-butene
H2SO4
Isobutene
1-butene
Solfato di
terzbutile
Recupero isobutene
La reazione è esotermica e viene dunque condotta a una temperatura bassa, in
genere tra 20 e 50 °C. La reazione è la seguente:
Una volta effettuato l'assorbimento i due componenti possono essere rigenerati per
semplice riscaldamento:
e successivamente separati mediante lavaggio con acqua. L'acido solforico così
ottenuto viene concentrato tramite rettifica e rinviato nella colonna di estrazione.
Recupero isobutene
Il solfato di terzbutile non deve venire a contatto con acqua perché
altrimenti si rigenera l’acido solforico ma si produce isopropanolo
come prodotto, piuttosto che liberarsi isobutene
Recupero isobutene
Altri solventi usati nella distillazione estrattiva dell’isobutene sono:
Produzione butadiene
Una certa quantità di 1,3-butadiene viene
prodotta dai processi di cracking termico con
vapor d’acqua.
Tuttavia la forte richiesta di questo
idrocarburo, specialmente come monomero
per gomme sintetiche, determina una
produzione propria rilevante.
Produzione butadiene
Per deidrogenazione
Alla produzione di butadiene sono destinate gran parte dell’n-butano
e degli n-buteni di provenienza petrolifera realizzandone adeguate
deidrogenazioni catalitiche
La procedura di ottenimento di butadiene da n-butano e da n-buteni
risponde allo schema:
I procedimenti differiscono a seconda che si parta da n-buteni o dal n-butano
Butadiene da n-buteni
La deidrogenazione degli n-buteni a butadiene si conduce a 600 –
650 °C in presenza di eccesso di vapore in presenza di
catalizzatori per limitare il cracking termico.
-H2
Butadiene da n-buteni
Catalizzatori.
Si impiegano:
• il fosfato di calcio e nichel (cat. Dow);
• ossidi di magnesio e ferro, attivati da CuO + Cr2O3 e
stabilizzati con K2O (cat. Esso);
• ossido di cromo su allumina (cat. Phillips).
Butadiene da n-buteni
Pressione. La reazione avviene con aumento di volume (si sviluppa H2) e quindi è
favorita da bassa pressione.
In pratica si lavora a 1.5-2 atm con un forte quantitativo di vapor d’acqua che abbassa
ulteriormente la pressione parziale dei reagenti (favorendo la deidrogenazione).
• Il vapore inoltre riduce la tendenza del butadiene a polimerizzare (diluisce il sistema),
• serve ad apportare il calore per la reazione endotermica,
• riduce la formazione del coke e quindi la necessità di rigenerare il catalizzatore.
Tempo di contatto. Un maggior tempo di contatto fa aumentare l’entità della
deidrogenazione, ma anche quella del cracking termico e della polimerizzazione.
Butadiene da n-buteni
Le rese sono in media sul 45% a causa di inevitabili isomerizzazioni
e dimerizzazioni del reagente e di degradazione del prodotto in coke
Butadiene da n-buteni
Gli n-buteni ed il vapore vengono scaldati separatamente in forni tubolari sui 700 °C
e poi inviati sul catalizzatore con brevissimi tempi di contatto (0.2 s) per evitare il
cracking.
Essendo la reazione endotermica, la temperatura si porta intorno a 630 °C e
i prodotti, in uscita dal reattore, vengono raffreddati repentinamente ed inviati a
colonne di assorbimento alimentate in controcorrente con una soluzione di
acetato di cuproammonio: è la fase di purificazione del butadiene già studiata.
Butadiene da n-butano
La conversione del n-butano a butadiene è essenzialmente un processo
discontinuo ma viene reso in continuo dotando l’impianto di più reattori soggetti
contemporaneamente a fasi operative diverse.
Il catalizzatore è costituito da Al2O3 all’80% e da Cr2O3 per il resto
La pressione, non potendosi usare vapor d’acqua per abbassare le pressioni
parziali dei reagenti per la sua incompatibilità con il catalizzatore, viene mantenuta
bassa (a circa 0.2 atm).
La temperatura non viene spinta oltre i 650 °C per ridurre il contributo delle
reazioni di cracking, infatti come si può vedere dal diagramma di Francis, che
mostra gli intervalli di stabilità di idrocarburi C4 e C5, a temperatura ordinaria sono
instabili termodinamicamente e tenderebbero a trasformarsi in grafite, eccetto il 2metilbutano che lo diventa (instabile) sui 40 °C.
Le deidrogenazioni studiate
sono termodinamicamente
favorite a temperatura
superiori a 600 °C come si
vede dal diagramma di
Francis
Si intravede che l’incontro delle curve dei relativi ∆G°si verifica a temperature
inferiori per la coppia reagente buteni-butadiene rispetto a quella dei reagenti
butano-butadiene.
Ciò indica che a parità di resa,la prima conversione si può realizzare a temperatura
inferiore a quella alla quale viene condotta la seconda.
Modalità di conduzione del processo
Occorre eliminare le particelle carboniose che in queste
condizioni sono inevitabili.
Il processo, pertanto si sviluppa in 3 fasi:
Reazione: Il butano, alla T e P di reazione, entra nel
reattore dove subisce la deidrogenazione; si verifica anche
cracking con sviluppo di idrocarburi leggeri e coke.
Riattivazione: Si interrompe la carica e si immette aria che
brucia il coke riattivando il catalizzatore.
Spurgo (rapido per evitare disattivazione catalizzatore): Si
interrompe l’immissione di aria e si inietta una corrente di
vapore che asporta tutte le sostanze rimaste.
Schema di processo
Il processo comporta due fasi: una di reazione ed una di rigenerazione. Per rendere
continuo il il processo si mettono in funzione i reattori in modo che se ne abbiano
contemporaneamente di quelli in reazione e di quelli di rigenerazione
Il butano viene scaldato a 650 °C in B e poi passa attraverso la valvola VRP a due
dei deidrogenatori R1, R2, R3 e R4 contenenti il catalizzatore. I prodotti in uscita,
Insieme al n-butano, parzialmente convertito, passano al quench in C1.
Finita la fase attiva in una coppia di reattori inizia quella rigenerativa che consiste nel
mandare aria che brucia il deposito carbonioso sul catalizzatore e poi rapidamente
del vapore. Dopo la fase rigenerativa, i due reattori riprendono la fase attiva e si
manda in rigenerazione l’altra coppia.
Il quench in C1 viene fatto con oli minerali pesanti preraffreddati in E1 e E3.
La frazione C4 in uscita in testa da C1 viene compressa in P e poi adsorbita con altro
olio minerale in C2, dalla cui testa sfiatano i prodotti gassosi più leggeri.
I prodotti C4 vengono recuperati dall’olio adsorbente in C3 tramite vapore e l’olio
rinviato a in ciclo a C2
Il prodotto di testa C3 dopo separazione dal vapore nel separatore SV1 e refrigerato in
E6 viene inviato alla colonna C4 dove si raccolgono in testa butano e 2-buteni e in coda
1-butene e butadiene.
I prodotti di testa riciclano ai reattori mentre quelli di coda sono inviati a DC dove il
butadiene viene estratto con acetato di cuprammonio. L’1-butene si separa come
surnatante e ricicla mentre il butadiene viene liberato dal suo complesso in C5 con
vapore.
PRODUZIONE ISOPRENE
Isoprene
Un’altra diolefina di notevole importanza industriale è l’isoprene, ricavato dalla
frazione C5: tale composto rappresenta il monomero di base per la produzione
naturale di caucciù, successivamente vulcanizzato per la produzione di gomma. La
gomma naturale può essere considerata come un polimero di addizione 1,4
dell’isoprene. Il calore degrada la gomma naturale fino ad isoprene, purché il
riscaldamento sia fatto in assenza di aria. Le unità isopreniche della gomma naturale
sono saldate tra loro e tutti i doppi legami hanno la configurazione cis. Per questo
motivo la gomma naturale viene definita cis -1,4-poliisoprene e la sua struttura è
rappresentata di seguito:
PRODUZIONE ISOPRENE
Come si può osservare dal diagramma di Francis, la deidrogenazione di 2metilbutano ad isoprene risulta termodinamicamente favorita per temperature
superiori a 900 K:
Quindi la trasformazione è termodinamicamente fattibile
Infatti un modo di preparare l’isoprene consiste del deidrogenare il 2-metlbutano
(C5 ottenuto dal topping) e i 2-metilbuteni (C5 ottenuti dal cracking).
Nel caso della deidrogenazione delle olefine C5, la prima operazione da
compiere consiste nella separazione degli idrocarburi insaturi a catena lineare
da quelli a catena ramificata; tale operazione è necessaria in previsione del
successivo stadio che prevede la deidrogenazione delle monolefine mirata
alla produzione di un diene.
Se la deidrogenazione fosse sviluppata sull’intera miscela di idrocarburi
insaturi avremmo in seguito una certa difficoltà a separare l’ isoprene dal
corrispondente diene a catena lineare:
PRODUZIONE ISOPRENE
Le monolefine C5 a catena ramificata contenute nella miscela provenienti
dal cracking e successive distillazioni e purificazioni sono le seguenti:
La miscela degli idrocarburi insaturi a catena ramificata viene quindi trattata con una
soluzione acquosa di acido solforico al 65% in peso. L’azione dell’acido è quella di
garantire l’isomerizzazione del doppio legame.
Processo Shell
Nella soluzione acida le prime due specie isomerizzano nella terza (in accordo con la
regola di Saytzeff), in definitiva, da una miscela di idrocarburi insaturi a catena
ramificata otteniamo un unico prodotto. Questa specie è favorita rispetto alle altre in
quanto, addizionando ioni H+, garantisce la formazione di un carbocatione terziario.
PRODUZIONE ISOPRENE
L’alchene in questione resta solubilizzato nella miscela di acqua ed H2SO4, e
viene recuperato mediante una successiva operazione di distillazione.
L’ultima fase prevede la deidrogenazione dell’alchene ottenuto su un
catalizzatore al Ferro o al Cromo a 600 °C, con l’obbiettivo finale rappresentato
dalla produzione di isoprene.
I quantitativi di isoprene recuperati al termine dei processi di steam-cracking sono
inferiori ai corrispondenti quantitativi di butadiene, ed insufficienti a soddisfare le
esigenze di mercato. Per questo motivo, è necessario ricorrere a processi di sintesi
diretta dell’isoprene: le sintesi sfruttate a livello industriale sono essenzialmente
tre, cui se ne aggiunge una quarta che ha trovato applicazione solo dopo il 1995.
Isoprene: Processo SNAM
Isoprene: Processo GOOD-YEAR
Isoprene: Processo PRINS
Isoprene: Processo SNAM (Sintesi da acetone e acetilene)
Si parte da acetilene di acetone e sfrutta come catalizzatore in fase omogenea KOH.
Il processo è condotto in ammoniaca liquida mantenuta liquida sotto pressione (25
atm e 10-30 °C circa). Il primo stadio di reazione prevede la formazione dello ione
acetiluro che fungerà da nucleofilo nel successivo stadio di addizione al carbonio
carbonilico
Isoprene: Processo SNAM
Il processo descritto passa attraverso il consumo ed il ripristino del catalizzatore e
viene realizzato in ammoniaca liquida a temperatura compresa tra i 10 °C ed i 30 °C e
ad una pressione di 25 atm. Per favorire ulteriormente la formazione dello ione
acetiluro, si aggiunge al sistema reagente dell’idrossido di potassio KOH, in grado di
sostenere le caratteristiche acide degli idrogeni acetilenici. L’intermedio (2metilbutinolo) ottenuto al termine di questi stadio viene sottoposto ad un’operazione di
idrogenazione catalitica (5 atm e 75-80 °C) e ad una successiva disidratazione
catalizzata da allumina (1 atm e 280 °C) al fine di ottenere isoprene
Isoprene: Processo GOOD-YEAR
3 steps
• dimerizzazione del propene, catalizzata da un trialchilalluminio,
a 2-metil-1-pentene;
• isomerizzazione del 2-metil-1-pentene a 2-metil-2-pentene;
• pirolisi del 2-metil-2-pentene, con acido bromidrico catalizzatore, a isoprene
Isoprene: Processo GOOD-YEAR
Questo processo sfrutta le reazioni di sintesi delle olefine con doppio legame in
proporzione terminale a partire da etilene messo a reagire con alluminio tripropile. In
questo caso, però, si fa uso di alluminio tripropile, ed il reagente principale è il
propilene
1) Dimerizzazione (150-200 °C; 20⋅⋅106 Pa)
il complesso σ si modifica, ripristinando la neutralità dell’alluminio:
Isoprene: Processo GOOD-YEAR
L’addizione di un’altra molecola di propilene comporta la formazione di un complesso σ
che si comporta in maniera differente al caso appena descritto:
In questo caso non si riscontra la migrazione di un intero gruppo alchilico sul carbonio
che reca la carica positiva, bensì il trasferimento di uno ione H- che porta alla
formazione di un carbocatione terziario. È proprio la natura del carbocatione formatosi e
la sua stabilità, a giustificare il meccanismo di reazione: infatti, l’energia di attivazione
legata al distacco dello ione H- dal carbonio terziario risulta inferiore a quella che
caratterizza il fenomeno di migrazione di un gruppo alchilico.
L’addizione di propileni si sviluppa fino a garantire un processo di dimerizzazione,
con l’impossibilità di favorire un ulteriore accrescimento della catena alchilica.
Isoprene: Processo GOOD-YEAR
2) Isomerizzazione (150-300 °C)
L’alchene prodotto al termine del processo descritto presenta un atomo di
carbonio in più rispetto allo scheletro dell’isoprene, e viene isomerizzato con
l’ausilio di acido solforico, o fosforico, supportato, o per mezzo di resine
scambiatrici di ioni, a carattere acido.
Al termine dell’isomerizzazione otteniamo:
Isoprene: Processo GOOD-YEAR
3) Pirolisi
Il 2-metl-2-pentene viene sottoposto a reazioni radicaliche che avvengono a temperature
dell’ordine di 650 – 800°C, in presenza di HBr. Le condizioni di reazione sono tali da
determinare la formazione del radicale Br., che potrebbe interagire con uno qualunque
degli atomi di idrogeno dell’alchene. È chiaro che la suddetta interazione sarà tale da
garantire la formazione del radicale più stabile, che quello allilico: questo radicale può
formarsi per effetto del distacco di un atomo di H da uno dei due gruppi metilici legati al
carbonio insaturo, o di un tale radicale di un gruppo CH2.
T
steam
Isoprene: Processo GOOD-YEAR
Nei due casi otteniamo un radicale allilico, stabilizzato per risonanza:
L’attacco del radicale Br. è di tipo statistico: la probabilità di un attacco ai 6 idrogeni
primari è certamente superiore a quella di un attacco ad uno dei due idrogeni
secondari, per cui la percentuale che viene a formarsi del secondo radicale è più alta
di quella caratterizzante il primo.
Isoprene: Processo GOOD-YEAR
Una volta formato il radicale allilico, assistiamo ad una reazione di β-scissione:
Il radicale CH3 si comporta alla stessa maniera di Br., al fine di stabilizzarsi
formando metano.
Globalmente
Isoprene: Processo PRINS
i reagenti per questo processo sono l’isobutene, ricavato in buone quantità dalla
distillazione della frazione idrocarburica C4 (come visto), e la formaldeide, ottenuta per
ossidazione del metanolo. La reazione prevede un attacco nucleofilo dell’isobutene al
carbonio carbonilico della formaldeide (65-70 °C e 1 atm):
L’ossigeno sul quale è concentrata la carica negativa garantisce l’attacco nucleofilo
ad una seconda molecola di formaldeide:
Isoprene: Processo PRINS
Il composto ciclico ottenuto è un diossano, che viene riscaldato (240-400°C) in presenza
di acido solforico supportato opportunamente, o di un catalizzatore supportato su fosfato
tricalcico. Questo stadio garantisce la liberazione di una prima molecola di formaldeide:
Globalmente
Processo endotermico












