Cinetica chimica
E’ lo studio della velocità delle reazioni chimiche,
delle leggi di velocità e dei meccanismi di
reazione.
Es.
2H2(g) + O2(g) d 2H2O(l)
Keq(25°C)=1083 (ricavato da lnK=-ΔG°/RT)
•
•
•
In assenza di catalizzatori, la reazione può
essere molto lenta.
Solitamente le reazioni fra ioni sono
immediate, quelle fra molecole sono lente.
Le redox possono essere sia lente che veloci.
Meccanismo di reazione
Descrizione dettagliata di una reazione chimica
“globale” come una serie di processi.
Il meccanismo deve essere in accordo con:
1.
la stechiometria della reazione globale
2.
il valore di velocità sperimentalmente
determinato.
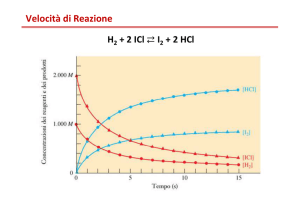
Velocità di reazione
aA+ bBîcC + dD
v=-1/a*d[A]/dt = -1/b*d[B]/dt =1/c*d[C]/dt
=1/d*d[D]/dt
La velocità di una reazione chimica dipende
essenzialmente da:
1. concentrazione dei reagenti
2. temperatura
3. catalizzatori
1-Effetto della concentrazione
Per una reazione in fase omogenea:
V =k[A]α[B]β
con α + β ≡ ordine di reazione (α rispetto ad A e
β rispetto a B).
• α e β non sono necessariamente eguali ai
coefficienti stechiometrici a e b: devono essere
ricavati sperimentalmente.
• E’ questo il primo passo per determinare il
meccanismo di reazione.
Esempio
A+2B î C reazione globale
1) A+B î In prodotto intermedio V =k[A][B]
2) B + In î C processo veloce (non influenza v)
Lo stadio 1 è detto “lento e determinante”
1. Una reazione è di solito la somma di più
stadi.
2. E’ lo stadio più lento quello che determina la
velocità di reazione.
3. Un meccanismo di reazione corretto deve
giustificare l’espressione della velocità di
reazione
2-Effetto della temperatura
In generale la velocità di reazione aumenta con
l’aumentare di T.
Energia di attivazione
La minima energia cinetica totale che le molecole
debbono fornire alle loro collisioni affinché possa
verificarsi una reazione chimica.
Fattore sterico
Le molecole devono urtarsi secondo opportune
condizioni geometriche.
-E /RT
K=A*e
A
Equazione di Arrhenius
(A= fattore preesponenziale)
E’ possibile calcolare graficamente il valore
dell’energia di attivazione, mediante misure di k a
diverse T.
k =A*e-(EA/RT)
⇓
lnk = lnEA EA/RT
L’intercetta
individua il
valore di A,
dalla
pendenza si
ricava EA
Distribuzione delle energie cinetiche molecolari
(Maxwell-Boltzmann)
Teoria delle collisioni
La reazione avviene quando le molecole:
1. si urtano
2. l’urto è efficace
Teoria del complesso attivato
La differenza di energia fra reagenti e prodotti
corrisponde al ΔH solo se la reazione avviene in
un unico stadio.
Andamento della reazione
1. Stato iniziale (reagenti)
2. Stato intermedio
3. Stato finale (prodotti)
Molecolarità
Numero di molecole “coinvolte” in uno stadio del
meccanismo di reazione.
Attenzione: non confondere con l’ordine di
reazione.
Processo a due stadi
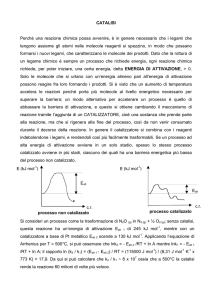
3-Catalizzatori
• Sostanze che, pur restando invariate alla fine
della reazione, fanno aumentare la velocità
della reazione stessa.
• Il valore della costante di equilibrio non varia.
• La catalisi può essere omogenea od
eterogenea.
• Nella catalisi eterogenea la velocità dipende
dalla superficie del catalizzatore: la reazione
avviene all’interfaccia col catalizzatore.
• Avvelenamento dei catalizzatori.
Enzimi
Lattasi
Catalizzatore enzimatico
Lattosio d glucosio + galattosio
Pepsina
Idrolizza le proteine
Catalasi
Distrugge H2O2 (H2O2 dH2O + ½ O2), che si
forma in processi cellulari redox.
H2O2 potrebbe essere dannosa per le cellule
stesse
Ptialina
Idrolizza l’amido
Esempi di processi catalitici
1)
2 SO2(g) + O2(g) î 2 SO3(g)
ΔH<0 ⇒ reazione esotermica
p2(SO3)
Kp= _____________________
Kp=Kp(T)
p(O2)*p2(SO2)
• Per spostare la reazione verso destra occorre
abbassare T(⇒termodinamica), ma questo
causa una diminuzione di velocità (⇒cinetica).
• Tramite un catalizzatore, la reazione avviene
con un meccanismo alternativo, che permette di
ottenere una velocità sufficientemente alta alle
basse temperature.
2)
N2(g) + 3 H2(g) î 2NH3(g)
ΔH°= -92.22 Kcal
p2(NH3)
Kp=Kp(T)
Kp= ____________________
3
p(N2)*p (H2)
reazione esotermica ⇒ occorre catalisi
Catalizzatore: Fe3O4 fuso con promotori (Al2O3,
SiO2, K2O, ZrO2), che in ambienti riducente di H2
dà luogo a Fe metallico con struttura altamente
porosa.
Catalisi enzimatica
1. il substrato (sostanza reagente) si lega ad un
sito attivo di una molecola di enzima
2. formazione del complesso attivato
3. Distacco dei prodotti dal sito attivo ⇒
liberazione della molecola di enzima
E + S î ES î E+P
S = substrato
E = enzima
P = prodotto
Le reazioni catalizzate da enzimi sono l’esempio
più significativo di reazioni con ordine zero, cioè:
V = - d[S]/dT=k[S]=k (costante)