CATALISI
L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza
intervenire sulla T, è di enorme importanza in alcuni tipi di reazione.
Ad esempio le proteine reagiscono velocemente e selettivamente in presenza
di catalizzatori (enzimi), la stessa velocità non si potrebbe realizzare alzando
la T poiché subirebbero denaturazione.
Il catalizzatore è una specie chimica che fa variare la velocità di reazione
senza alterare l'equilibrio e la relativa costante d'equilibrio K.
La parola catalisi viene dal greco slegare. I catalizzatori di norma accelerano
la reazione. Vi sono alcuni casi in cui essi la inibiscono (catalizzatori negativi,
inibitori): molti esempi nella fisiologia umana
inibitore lattato deidrogenasi; inibitore dell'anidrasi carbonica.
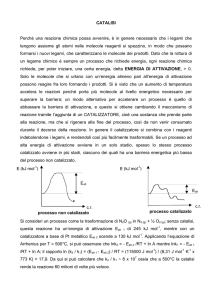
L'azione si esplica nell'abbassamento dell'Ea della reazione e questo può
prevedere anche la formazione di intermedi diversi da quelli che si
avrebbero in assenza di catalizzatore.
Questa diminuzione di Ea porta direttamente un aumento di velocità e
quindi della costante di velocità (k).
Se ci troviamo in una reazione all'equilibrio la K dell'equilibrio non viene
influenzata e quindi, a prescindere dalla natura del complesso attivato,
vale sempre al relazione ∆G°= RTlnK ed il calcolo del ∆E di reazione è
indipendente dalla reazione.
Per la stessa reazione possono essere utilizzati catalizzatori diversi.
es.
HCOOH
H2 + CO2
viene catalizzata da Ni,
Cd, Pt , Cu.
Tutti i catalizzatori rispecchiano regole basilari e comuni.
- Il catalizzatore compare chimicamente inalterato alla fine della reazione.
- agisce in piccole quantità.
- non altera l'equilibrio nelle reazioni reversibili.
- possiede maggiore o minore specificità nell'agire con sistemi diversi .
Il catalizzatore può essere
• in un unica fase con i reagenti,
es.: un gas su una miscela di gas, un liquido in soluzione,
catalizzatore omogeneo;
• in fase diversa,
es.: solido in soluzione, catalizzatore eterogeneo.
Consideriamo la catalisi eterogenea l'esempio più comune in quanto di
maggior uso è la catalisi solida di specie gassosa.
1a fase adsorbimento del gas sulla superficie del catalizzatore questo
presenta dei centri attivi proporzionali allo sviluppo superficiale ed ai
difetti nel reticolo del catalizzatore. Tanto più la superficie è
difettosa tanto maggiore è lo sviluppo superficiale e quindi la
superficie di azione. Gli atomi del gas si concentrano sul
catalizzatore, aumentano la concentrazione e formano complessi
attivati la cui energia di attivazione è minore di quella dei complessi
attivati.
Es.: nella decomposizione dell'NH3:
Ea = 335 KJ senza catalizzatore e 165 KJ con catalizzatore.
2a fase
dal catalizzatore le specie si devono staccare facilmente
senza alterarlo.
E' quindi importante l’uso di catalizzatori specifici per ciascuna reazione.
es: CH3CH2OH si decompone:
in presenza di Ni si ottiene
H3CCHO + H2
in presenza di Al2O3 si ottiene
H2C=CH2 + H2O
Su Ni si rompe il legame
Su Al2O3 si rompe il legame
OH
CO
I catalizzatori più usati sono Pt , Ni, Pd, Fe, Al2O3, ZnO, V2O5, ad
esempio nella marmitta catalitica CO, NO ed idrocarburi vengono
trasformati in CO2, H2O, N2 con catalizzatori al Pt, Pd, Ru , Rh, o
metalli di transizione.
L'avvelenamento del catalizzatore avviene quando qualche
sostanza si adsorbe sulla superficie in modo irreversibile (il Pb
presente nella benzina super danneggia il catalizzatore
avvelenandolo)
H2S, HCN, Hg, CO sono sostanze che avvelenano i catalizzatori e
con uguali meccanismi avvelenano il corpo umano.
Catalisi omogenea
Svariati meccanismi, possono richiedere passaggi per reazioni intermedie
es:
2SO2+O2
2SO3
lenta
2NO + O2
2NO2
veloce
2SO2 + 2NO2
2SO3+ 2NO
veloce
2SO2 + O2
2SO3
veloce
con catalizzatore:
Il catalizzatore NO si rigenera e la reazione risulta più veloce perché veloci i
suoi passaggi intermedi, in questo caso si hanno veri atti reattivi e quindi il
catalizzatore si comporta contemporaneamente da reagente e prodotto.
Catalisi enzimatica
Enzimi catalizzatori molto specifici ed efficienti aumentano la velocità fino
ad 1·1012 volte.
Importanti nella vita, vengono usati anche in campo industriale pesano
104 ÷ 106 sono molto sensibili alla T come tutte le proteine si dissociano a
T comprese tra 50° e 120°C.