SCIENZE CHIMICHE | SCIENZE E RICERCHE • N. 31 • 15 GIUGNO 2016
Breve storia della gomma:
da Faraday a Natta
VINCENZO VILLANI
Dipartimento di Scienze, Università della Basilicata
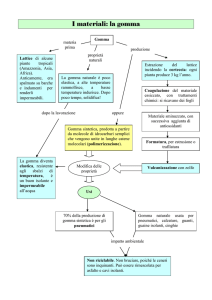
La gomma è utilizzata dall’Uomo dalle epoche più remote: abbiamo prove che gli Indios d’America ne
facevano manufatti già 4000 anni fa! E’ nota agli europei dal 1496, importata durante il secondo viaggio di
Cristoforo Colombo. Tuttavia, in questo excursus ci occuperemo dell’evoluzione propriamente chimica della
gomma a partire dall’800.
La gomma naturale si ottiene dall’Hevea Brasiliensis (albero della gomma) sotto forma di un lattice ricco di
cis-1,4-poliisoprene:
Si deve al genio di Michael Faraday nel 1826 la determinazione della sua formula minima, C5H8. Faraday era
consapevole che anche C10H16, C15H24, … potevano essere le formule molecolari, mai avrebbe pensato che la
formula corretta era del tipo C50000H80000 (infatti, la gomma ha un peso molecolare medio di circa 5 · 105), l’idea
di macromolecola non era ancora stata scoperta!
Nel 1839 Charles Goodyear scoprì la reazione di vulcanizzazione, in cui la gomma naturale trattata con zolfo, biacca (carbonato basico di piombo, 2PbCO3·Pb(OH)2) e calore → a 130°C è trasformata in un materiale
elastico e tenace, resistente all’invecchiamento. Si tratta di una reazione di reticolazione in cui le catene macromolecolari sono unite da forti legami disolfuro (detti cross-link) mediante un accelerante ad alta temperatura:
Fino al 1920 per spiegare l’alto peso molecolare dei polimeri naturali o di sintesi era in auge la ‘Teoria micellare’, sviluppata a partire dagli studi di Graham del 1861. Veniva ipotizzata l’esistenza dei ‘colloidi’, aggregati
di molecole a basso peso molecolare (filtrati da una membrana semipermeabile di pergamena) tenute insieme
da deboli forze intermolecolari (strutture supramolecolari, diremmo oggi), in modo analogo a come un lungo
filo di spago è tenuto assieme dall’aggrovigliamento di fibre corte.
Gli alti pesi molecolari stimati mediante le proprietà colligative (abbassamento crioscopico, innalzamento
ebulloscopico e pressione osmotica) erano ritenuti una conseguenza di quest’aggregazione.
Sulla struttura della gomma naturale il dibattito era molto intenso, veniva stimato (correttamente) un peso
molecolare M>100 000 uma. Nel 1905 il chimico tedesco Dietrich Harries, elaborò una teoria secondo cui la
18
SCIENZE E RICERCHE • N. 31 • 15 GIUGNO 2016 | SCIENZE CHIMICHE
Sergei Vasiljevich Lebedev (1874 –1934)
gomma consisteva di molecole ad anello di 8 termini risultanti dalla combinazione di due molecole di isoprene;
queste avrebbero formato grandi aggregati colloidali mediante deboli interazioni intermolecolari tra i doppi
legami (anticipando le interazioni π-π):
Il chimico inglese Samuel Pickles criticò l’ipotesi di Harries e propose, un modello ad anelli interconnessi
(come i catenani, diremmo oggi) costituiti da almeno 8 unità isopreniche ciascuno.
Finalmente, negli anni ‘30 Wallace Carothers in America ed Hermann Staudinger in Germania, svilupparono
la ‘Teoria delle macromolecole’.
La possibilità di disporre di gomma di sintesi (di importanza strategica) rimase frustrata fino al 1910 quando
il chimico russo Sergei Lebedev ottenne la prima gomma di sintesi, l’1,4-polibutadiene, trattando il butadiene
(ottenuto dall’etanolo a partire dalla fermentazione delle patate…) con sodio metallico come catalizzatore:
Fino agli ’40 l’Unione Sovietica fu il più grande produttore di gomma sintetica, quando il butadiene divenne
un derivato del petrolio.
Nel 1916 in Germania fu polimerizzato il 2,3-dimetilbutadiene
ottenendo la gomma metile; tuttavia, a causa della cinetica di reazione troppo lenta, questa polimerizzazione
fu abbandonata.
19
SCIENZE CHIMICHE | SCIENZE E RICERCHE • N. 31 • 15 GIUGNO 2016
Nel 1926 alla Farben (che riuniva l’industria chimica tedesca), la polimerizzazione del butadiene (processo
Lebedev) fu perfezionata inventando la polimerizzazione in emulsione. Il polibutadiene ottenuto fu detto Buna
(Bu per butadiene e Na per sodio, il catalizzatore).
In generale, abbiamo quattro tipi di polimerizzazione: in massa, in soluzione, all’interfaccia e in emulsione.
La reazione in emulsione è una reazione radicalica condotta in acqua in presenza di un tensioattivo e di un
iniziatore. In questo modo, la polimerizzazione in emulsione rientra nella ‘Green Chemistry’ in quanto non usa
solventi organici e solo il tensioattivo è da recuperare.
La reazione può essere così schematizzata. Il tensioattivo (ad es. dodecil-benzensolfonato di sodio) in acqua
forma micelle di 10-20 nm (al di sopra della concentrazione micellare critica, cmc) (1);
H3C
O
S
-
+
O Na
O
il monomero è disperso in acqua per agitazione sotto forma di gocce stabilizzate dal tensioattivo (2); il monomero diffonde dalle gocce nel mezzo acquoso e quindi nelle micelle dall’enorme superficie interfacciale (3);
l’iniziatore radicalico (ad es. persolfato di potassio) idrosolubile
O
+ -
K O
S
O
O
,
reagisce con il monomero nelle micelle (l’iniziatore ha probabilità piccola ma non trascurabile di entrare
nella micella) (4); la polimerizzazione si propaga fino alla reazione di terminazione dovuta all’arrivo di un
nuovo radicale (con resa altissima) (5). In questo modo, la polimerizzazione procede dalle ‘gocce-serbatoi’ alle
‘micelle-reattori’ fino ad esaurimento del monomero. La reazione è descritta da un’equazione differenziale di
diffusione-reazione del tipo:
Dove u è la concentrazione del monomero ed f il termine che definisce la cinetica di reazione. La soluzione
dell’equazione permette l’accurata simulazione della polimerizzazione in emulsione.
Negli anni ’30 alla Farben, si scoprì che copolimerizzando in emulsione il butadiene con lo stirene (fino al
30%) si otteneva una gomma particolarmente resistente all’abrasione e all’invecchiamento, la Buna S, oggi
SBR:
20
SCIENZE E RICERCHE • N. 31 • 15 GIUGNO 2016 | SCIENZE CHIMICHE
Giulio Natta (1903 – 1979)
Quindi, fu sviluppata la Buna N (oggi, NBR) dalla copolimerizzazione a blocchi random di butadiene e
acrilonitrile (fino al 30%) particolarmente resistente a acidi, oli, carburanti,… essenziale per sigillare le parti
del motore:
In America negli anni ’30 Carothers e Nieuwland avevano sintetizzato il policloroprene (neoprene) resistente
all’ossidazione, agli idrocarburi e alla temperatura (oggi è utilizzata per le mute subacquee, ad es.).
Il cloroprene è ottenuto dall’acetilene e quindi dall’ acetilene monovinilico trattato con acido cloridrico:
Tuttavia, durante la WW II l’America ‘forzò’ il brevetto tedesco e produsse Buna S per polimerizzazione in
emulsione.
In Italia sin dal 1872 la Pirelli produce articoli in ‘caucciù vulcanizzato’. Oggi è la V azienda al mondo nel
settore dei pneumatici (19 stabilimenti in 13 paesi).
Un’interessante curiosità. Nel 1937 VItale BRAmani inventa la suola VIBRAM a base di gomma naturale
(NR detta para) e dotata di battistrada a carrarmato: in questo modo è assicurata un’aderenza eccellente sulle
superfici miste (sterrate o rocciose) e il drenaggio dell’acqua. D’allora è diventato un marchio di eccellenza.
A partire dagli anni ’50 sono state inventate le gomme più diverse.
Il poliisobutilene (gomma butilica), 98% isobutene, 2% isoprene:
21
SCIENZE CHIMICHE | SCIENZE E RICERCHE • N. 31 • 15 GIUGNO 2016
E’ una gomma morbida, ideale per i guanti.
La gomma Etilene-Propilene (EPR, copolimero a blocchi random) con alto potere dielettrico, ideale per i
cavi elettrici:
Gomme siliconiche,
acriliche, uretaniche, fluorurate…
Nel 1953 Paul John Flory pubblica Principles of Polymer Chemistry in cui espone un’elaborata teoria statistica dell’elasticità della gomma che diventerà una milestone: l’elasticità è di tipo entropico e dovuta all’allontanamento sotto sforzo dallo stato d’equilibrio di massima entropia; un’elegante equazione dello sforzo σ in
funzione della deformazione λ in accordo coi dati sperimentali è dedotta:
dove ν è la densità dei cross-link.
Nel 1962 Giulio Natta e i suoi collaboratori, grazie ai catalizzatori stereoselettivi Ziegler-Natta (TiCl - AlEt ),
3
3
ottennero il cis-1,4-poliisoprene sintetico (con una resa cis all’98%): la gomma naturale era stata finalmente
prodotta in laboratorio.
22