Carboidrati
• Aldeidi o chetoni con almeno due ossidrili
• Formula generale Cn(H2O)n
• Presenti in tutti gli organismi viventi: amido,
cellulosa, carboidrati di membrana, acidi nucleici
• Sintetizzati dalle piante durante la
fotosintesi, fungono da fonte energetica per
gli organismi superiori
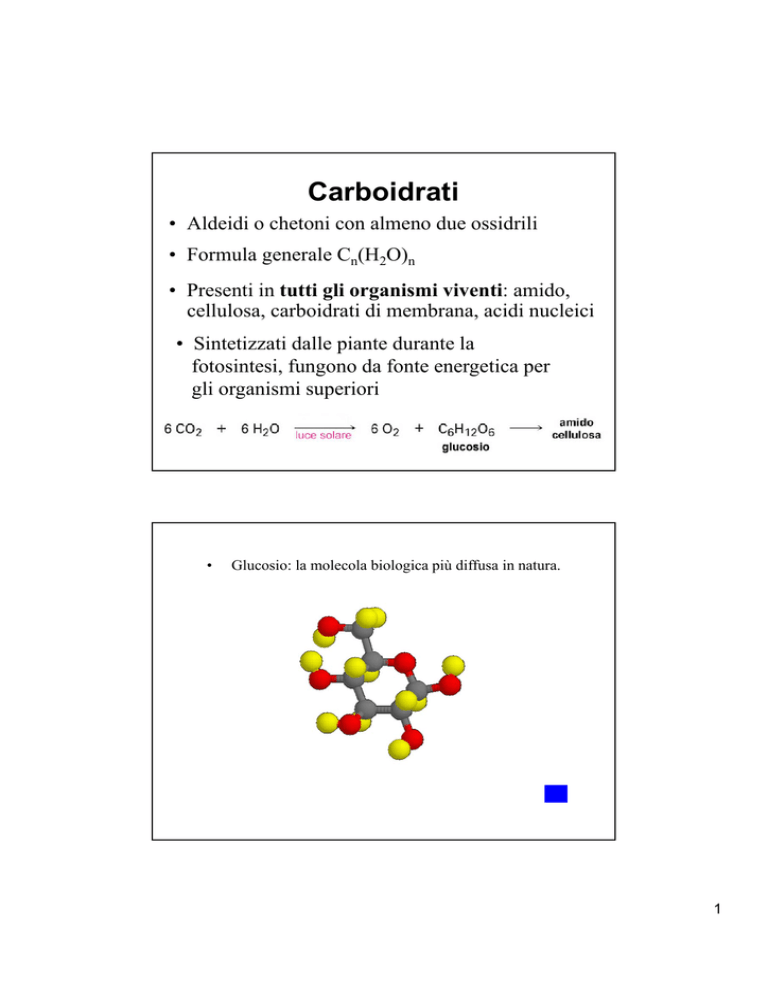
•
Glucosio: la molecola biologica più diffusa in natura.
1
• Monosaccharides - simple sugars with multiple
OH groups. Based on number of carbons (3, 4,
5, 6), a monosaccharide can be a triose, tetrose,
pentose or hexose.
• Disaccharides - 2 monosaccharides covalently
linked.
• Oligosaccharides - a few monosaccharides
covalently linked.
• Polysaccharides - polymers consisting of
chains of monosaccharide or disaccharide
units.
Monosaccharides
Aldoses (e.g., glucose)
Ketoses (e.g., fructose)
have an aldehyde group at have a keto group, usually
one end.
at C2.
H
C
O
CH2OH
C
O
HO
C
H
OH
H
C
OH
OH
H
C
OH
H
C
OH
HO
C
H
H
C
H
C
CH2OH
CH2OH
D-glucose
D-fructose
2
D vs L Designation
CHO
CHO
D & L designations
are based on the
configuration about
the single
asymmetric C in
glyceraldehyde
H
C
OH
HO
L-glyceraldehyde
CHO
H
C
OH
CH2OH
D-glyceraldehyde
H
CH2OH
CH2OH
D-glyceraldehyde
C
CHO
HO
C
H
CH2OH
L-glyceraldehyde
Sugar Nomenclature
For sugars with more
than one chiral center,
D or L refers to the
asymmetric C farthest
from the aldehyde or
keto group.
Most naturally occurring
sugars are D isomers.
O
H
C
H – C – OH
HO – C – H
H – C – OH
H – C – OH
CH2OH
D-glucose
O
H
C
HO – C – H
H – C – OH
HO – C – H
HO – C – H
CH2OH
L-glucose
3
D vs L Designation
O
C
H
CHO
CHO
H C OH
H
HO C H
C
OH
HO
H C OH
H C OH
L-glyceraldehyde
CHO
H
CH2OH
H
CH2OH
CH2OH
D-glyceraldehyde
C
CHO
OH
HO
CH2OH
D-glyceraldehyde
H
CH2OH
L-glyceraldehyde
D vs L Designation
O
C
H
HO C H
H C OH
HO C H
HO C H
CH2OH
CHO
CHO
H
C
OH
HO
L-glyceraldehyde
CHO
H
OH
CH2OH
D-glyceraldehyde
H
CH2OH
CH2OH
D-glyceraldehyde
C
CHO
HO
H
CH2OH
L-glyceraldehyde
4
D(+) glucosio ed L(-) glucosio sono enantiomeri
O
C
H
H C OH
HO C H
O
C
H
HO C H
H C OH
H C OH
HO C H
H C OH
HO C H
CH2OH
D(+) glucosio
CH2OH
L(-) glucosio
5
Non esiste una relazione diretta fra
configurazione e segno della rotazione ottica.
Ad esempio, alcuni zuccheri della serie D
sono destrogiri (+) mentre altri sono
levogiri (-).
6
O
OH
SOLO IN AMBIENTE ACIDO perché OH deve essere
trasformato in un buon gruppo uscente (H2O)
OH
OH
Addizione della
seconda molecola di alcol
- H2 O
Perdita di H2O:
eliminazione
dell’ossigeno
carbonilico
Pentoses and
hexoses can cyclize
as the ketone or
aldehyde reacts
with a distal OH.
Glucose forms an
intramolecular
hemiacetal, as the
C1 aldehyde &
C5 OH react, to
form a 6-member
pyranose ring,
named after pyran.
1
H
HO
H
H
2
3
4
5
6
CHO
C
OH
C
H
C
D-glucose
(linear
form)
OH
C
OH
CH2OH
6 CH2OH
6 CH2OH
5
H
4
OH
O
H
OH
3
H
H
2
OH
-D-glucose
H
1
OH
5
H
4
OH
H
OH
3
H
O
OH
H
1
2
H
OH
-D-glucose
These representations of the cyclic sugars are called
Haworth projections.
7
conformazione a sedia
Nella ciclizzazione, C1 diventa uno stereocentro
8
β
α
6 CH2OH
6 CH2OH
5
H
4
OH
O
H
OH
3
H
H
2
OH
-D-glucose
H
1
OH
5
H
4
OH
H
OH
3
H
O
OH
H
1
2
H
OH
-D-glucose
Cyclization of glucose produces a new asymmetric center
at C1. The 2 stereoisomers are called anomers, α and β.
Haworth projections represent the cyclic sugars as having
essentially planar rings, with the OH at the anomeric C1:
α (OH below the ring)
β (OH above the ring).
9
1
H
HO
H
H
2
3
4
5
6
CHO
C
OH
C
H
C
OH (linear form)
C
OH
D-glucose
CH2OH
6 CH2OH
6 CH2OH
5
H
4
OH
O
H
OH
3
H
H
2
OH
-D-glucose
H
1
OH
5
H
4
OH
H
OH
3
H
O
OH
H
1
2
H
OH
-D-glucose
β-D-glucosio, 63%
α-D-glucosio, 37%
p.f. 146°C, [α]D +112° p.f. 150°C, [α]D +19°
Una soluzione di D-glucosio è una miscela delle forme α e β in
equilibrio fra loro con MUTAROTAZIONE [α]D di +52.6°
ax
eq
10
H OH
4
HO
HO
H OH
6
H O
5
3
H
H
2
OH 1
OH
-D-glucopyranose
H O
HO
H
HO
H
H
OH
OH
H
-D-glucopyranose
Because of the tetrahedral nature of carbon bonds,
pyranose sugars actually assume a "chair" or "boat"
configuration, depending on the sugar.
The representation above reflects the chair configuration of
the glucopyranose ring more accurately than the Haworth
projection.
11
CH2OH
1
HO
H
H
2C
O
C
H
C
OH
C
OH
3
4
5
6
CH2OH
D-fructose (linear)
Fructose forms either
• a 6-member pyranose ring, by reaction of the C2
keto group with the OH on C6, or
• a 5-member furanose ring, by reaction of the C2
keto group with the OH on C5.
Glucosio e fruttosio hanno la STESSA configurazione dei carboni 3, 4, 5
O
C
H
H C OH
HO C H
CH2OH
C O
HO C H
H C OH
H C OH
H C OH
H C OH
CH2OH
CH2OH
D-glucosio
D-fruttosio
12
fruttosio
Il fruttosio è un cheto-esoso. È uno dei
tre zuccheri più importanti del sangue,
insieme a Glu e Gal.
α-D-Fructose
Si lega a Glu per formare il saccarosio.
È consigliato ai diabetici, perché la sua
degradazione è più lunga di quella di
Glu.
β-D-Fructose
Ribosio
D-ribosio, è un aldo-pentoso.
Ha struttura furanosidica.
È componente del RNA.
Il 2-deossiribosio è componente
del DNA
13
GALATTOSIO
Il galattosio è un EPIMERO del
glucosio, differisce per la configurazione del C4.
Gal e Glu formano il disaccaride
lattosio
α-D-Galattosio
È sintetizzato dall’organismo e fa
parte dei glicolipoidi e glicorpoteine
È meno dolce e meno solubile del Glu
α-D-Glucosio
glucosio e galattosio sono epimeri al C4
O
H
C
H C OH
HO C H
4
H C OH
O
H
C
H C OH
HO C H
4
HO C H
H C OH
H C OH
CH2OH
CH2OH
D(+)-glucosio
D(+)-galattosio
14
MANNOSIO
Il mannosio è un epimero del Glu
al C2.
È coinvolto nella glicolisi, ed è
trasformato in fruttosio 6-fosfato
α-D-Mannosio
Il nome deriva dalla manna, una
secrezione di alcuni alberi
α-D-Glucosio
glucosio e mannosio sono epimeri al C2
O
H
C
2
H C OH
HO C H
O
C
H
2
HO C H
HO C H
H C OH
H C OH
H C OH
H C OH
CH2OH
D(+)-glucosio
CH2OH
D(+)-mannosio
15
Disaccaridi
I disaccaridi sono carboidrati che contengono due molecole
(uguali (omo-disaccaridi) o diverse) di monosaccaridi che si legano
insieme attraverso due gruppi ossidrilici per eliminazione di una
molecola di acqua.
Il gruppo –OH emiacetalico di una molecola di monosacc. può reagire
con un –OH di un’altra molecola e formare un legame O-glicosidico.
Disaccaridi
•Omo-disaccaridi:
–Maltosio (α-Glu-(1→4)-Glu)
–Cellobiosio (β-Glu-(1→4)-Glu)
•Etero-disaccaridi
–Lattosio (β-Gal-(1→4)-Glu)
–Saccarosio (α-Glu-(1→2)-β-Frut)
16
legame glicosidico 1α-Glu 4α-Glu
α-Glu
α-Glu
legame glicosidico 1α-Glu 2β-Fru
Maltosio
β-Fru
α-Glu
Saccarosio
DISACCARIDI: saccarosio
viene estratto dalle barbabietole e dalla canna da zucchero
Legame glicosidico tra una
molecola di α-D-glucosio ed
una di β-D-fruttosio
(α-D-glucopiranosil-(1→2)β-D-fruttofuranoside)
Per idrolisi (es. INVERTASI) il saccarosio, [α] = +66°, diventa una
miscela EQUIMOLECOLARE di glucosio e fruttosio con [α] = –20°.
La miscela di anomeri del D-glucosio ha [α] = 52°, mentre quella del Dfruttosio ha [α] = –92°
17
Disaccaridi: maltosio
α-Glu
α-Glu
Nel maltosio il legame glicosidico è
1α → 4α
Maltosio: α-D-glucopiranosil-(1→4)-β-glucopiranosio
Disaccaridi
Nel
maltosio il legame glucosidico si contrae fra due molecole di α-DH
HOH2C
HO
O
glucopiranosio
H
HO
H
H
OH
HOH2C
HO
OH
H
O
H
HO
H
HOH2C
HO
HO
H
H
α-D-glucopiranosil-4-D-glucopiranosio
H
HOH2C
O
1α-4α
MALTOSIO
OH
OH
H
O
OH
H
H
HO
O
H
H
OH
OH
H
18
H
HOH2C
HO
HO
O
H
H
OH
H
HOH2C
O
H
HO
O
H
H
OH
OH
H
il maltosio ha proprietà riducenti
presenta mutarotazione
Cellobiosio
•Prodotto dalla digestione
della cellulosa.
•Dimero di glu con
legame β(1→4) che è
idrolizzato dai batteri.
19
CH2OH
Legame
1,4-β-glicosidico
H
CH2OH
O
H
OH
OH
H
O
O
H
OH
H
H
OH
H
OH
H
OH
H
cellobiosio
β-D-glucopiranosil-4-D-glucopiranosio
Disaccaridi: lattosio
Si trova nel latte umano e
in quello di molti animali.
Intolleranza al lattosio è
causata dalla perdita
dell’enzima lattasi nella
maturità.
β-D-Galattosio
D-Glucosio
•Lattosio: β-D-galactopyranosyl-(1→4)-Dglucopyranoside, o β-D-Gal-(1→4)-D-Glu
20
CH2OH
Legame
1,4-β-glicosidico
H
CH2OH
O
OH
H
Gal
OH
H
O
O
H
OH
H
H
OH
OH
Glu
H
OH
H
H
lattosio
β-D-galattopiranosil-4-D-glucopiranosio
Polisaccaridi del Glu
•Amido: legame α (1→4)
–Amilosio (lineare)
–Amilopectina (ramificata)
–Glicogeno (più ramificata)
•Cellulosa: legame β (1→4)
21
Amilosio
•Amilosio: catena lineare di
migliaia di unità (300-3000).
•Il legame α(1 → 4) fa
assumere alla molecola una
struttura ad elica.
•È più compatto, ma meno
digeribile della amilopectina.
Nelle piante è circa il 20%
dell’amido
Amilopectina
•Composta da 2000-20.000 unità di
Glu, con ramificazioni (legami
α(1→6)) ogni 24-30 Glu.
•Circa 80% dell’amido
•Digerita dell’amilasi
22
Glicogeno
•“amido animale”, si trova nel
fegato, muscoli e reni.
•Molecola molto ramificata
(dendrimero). Circa 60.000 unità
di glucosio con ramificazioni
ogni 12 glu.
•È normalmente legato alle
proteine (glicigenina)
Cellulosa
•Molecole lineari di con legami β (1→4) tra
molecole di glucosio.
•Questo determina una struttura lineare, e non ad
elica come l’amido. Assume una conformazione
estesa di microfibrille che si associano intra- e
inter-catena con legami a idrogeno.
•È più cristallina dell’amido.
23
Cellulosa
Schematic of arrangement of
cellulose chains in a microfibril.
6CH OH
2
5
O
CH2OH
H
O
H
OH
H
1
H
O
OH
H
H
H
4 OH
H
OH
1
H
O
H
OH
H
H
OH
CH2OH
OH
H
OH
H
OH
H
OH
H
H
O
H
H
OH
O
O
H
OH
H
H
OH
H
O
H
O
H
OH
H
H
OH
O
H
OH
H
H
H
O
H
OH
O
H
OH
H
H
OH
H
OH
amylose
CH2OH
O
H
OH
H
H
CH2OH
O
OH
H
O
2
3
CH2OH
H
H
CH2OH
CH2OH
CH2OH
H
H
H
O
4
amylopectin
H
1
O
6 CH2
5
H
OH
3
H
CH2OH
CH2OH
O
H
2
OH
H
H
1
O
O
H
4 OH
H
H
OH
H
H
O
O
H
OH
H
H
OH
H
OH
24
CH2OH
CH2OH
O
H
H
OH
H
H
H
H
H
O
OH
O
H
OH
H
H
H
O
6CH OH
2
5
O
H
OH
H
H
OH
OH
H
1
O
H
H
O
OH
CH2OH
H
OH
CH2OH
O
H
H
H
OH
H
CH2OH
H
OH
H
OH
O
OH
H
O
H
4
H
4 OH
3
H
2
6 CH2
5
H
OH
CH2OH
O
H
H
H
1
O
O
CH2OH
O
H
4 OH
2
OH
H
H
H
O
H
O
O
H
OH
H
H
OH
H
O
cellulose
H
H
OH
CH2OH
O
H
OH
H
H
OH
H
O
O
H
OH
H
H
OH
OH
H
H
H
H
H
H
OH
OH
OH
CH2OH
CH2OH
H
H 1
OH
1
O
3
H
OH
glycogen
H
25









