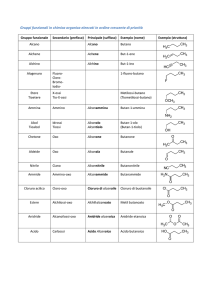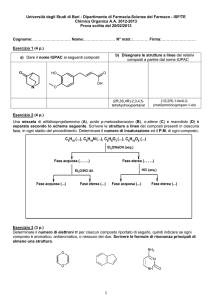
CHIMICA ORGANICA I
Corso di laurea in CHIMICA
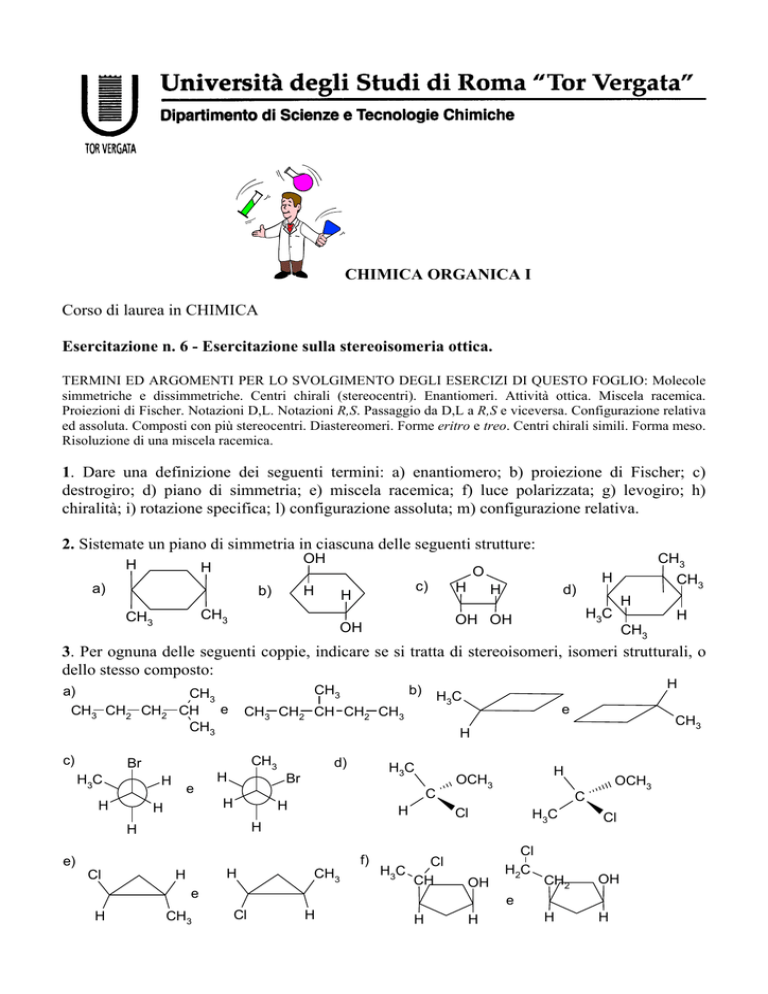
Esercitazione n. 6 - Esercitazione sulla stereoisomeria ottica.
TERMINI ED ARGOMENTI PER LO SVOLGIMENTO DEGLI ESERCIZI DI QUESTO FOGLIO: Molecole
simmetriche e dissimmetriche. Centri chirali (stereocentri). Enantiomeri. Attività ottica. Miscela racemica.
Proiezioni di Fischer. Notazioni D,L. Notazioni R,S. Passaggio da D,L a R,S e viceversa. Configurazione relativa
ed assoluta. Composti con più stereocentri. Diastereomeri. Forme eritro e treo. Centri chirali simili. Forma meso.
Risoluzione di una miscela racemica.
1. Dare una definizione dei seguenti termini: a) enantiomero; b) proiezione di Fischer; c)
destrogiro; d) piano di simmetria; e) miscela racemica; f) luce polarizzata; g) levogiro; h)
chiralità; i) rotazione specifica; l) configurazione assoluta; m) configurazione relativa.
2. Sistemate un piano di simmetria in ciascuna delle seguenti strutture:
H
OH
H
a)
H
b)
c)
H
CH3
CH3
CH3
O
H
H
d)
CH3
H
H3C
OH OH
OH
H
H
CH3
3. Per ognuna delle seguenti coppie, indicare se si tratta di stereoisomeri, isomeri strutturali, o
dello stesso composto:
CH3
a)
CH3
CH3 CH2 CH2 CH e
CH3
c)
H
e
H
d)
H3C
Br
H
H
C
H
H
f)
e)
H
H
CH3
Cl
H3C
CH
CH3
OCH3
C
Cl
e
H
CH3
H
OCH3
H3C
H
H
Cl
e
H
CH3
H
H3C
CH3 CH2 CH CH2 CH3
Br
H3C
H
b)
OH
Cl
H2C
Cl
CH2
OH
H
H
e
Cl
H
H
H
4. Per ognuna delle seguenti coppie di strutture dire se sono enantiomeri o identiche.
Br
Br
a)
C
C
CH3 CH2 H
c)
CH3
H
Cl
CH2 CH3
CH3
H3C
CH2CH3
H
C
H
CH3
CH2CH3
H
CH2CH3
H
OH
H3C
Cl
d)
CH2CH3
C
H3C
Cl
CH3
CH2CH3
H
H
HO
b)
CH3CH2
Cl
CH3
5. Indicare con un asterisco gli atomi di carbonio chirali (se ce ne sono) nei seguenti composti:
a) CH3 CHBrCH3
b) CH3 CH2 CHBr CH3
e) CH3 CH2 CH2 CH(OH) CH2 CH3
d)
CH2 CH2
f) H2N CH(CH3) CO2H
h) CH3 CClBr CH2 CH
g) CH3 CHBr CHBr CH2 CH3
i)
c) (CH3)2CH CHBr CH3
CH CH3
l) CH3 CH(CH2CH3) CO2H
H2N CH2 CO2H
6. Quali tra i seguenti composti sono chirali? (indicare gli stereocentri); a) 2-metileptano; b) 3metileptano; c) 4-metileptano; d) 1,1-dibromopropano; e) 1,3-dibromopropano; f) 1,2dibromopropano; g) etene; h) etino; i) benzene;
l)
H3C H OH
C
O
m)
OH
CH
CH2 NH CH3
HO
HO
O
CH3
C CH2 C CH2 CO2H
n)
O
H
HO
OH
HO
O
H
H
C
OH
p)
o)
H3C
H3C N
C CH3
CH3
C
O
OCH2CH3
7. a) Scrivere le strutture degli alcooli di formula molecolare C5H10O, indicando gli
stereoisomeri. b) Un acido carbossilico, di formula molecolare C3H5O2Br, è otticamente attivo.
Quale è la sua struttura?
8. Scrivere la struttura dell'alcool chirale (contenente solo atomi di C, H, O) con il più basso
peso molecolare possibile.
9. Delle strutture scritte sotto, una è chirale. Quale?
H
H
O
H
H
CH3
H
H
H
H
H
CH3
H
H
H
H
H
10. La molecola scritta a destra non è chirale. Perché?
Br
Cl
Cl
Br
11. Spiegare perché il trans-1,3-diclorociclobutano non è chirale, mentre il trans-1,3-diclorociclopentano lo è.
12. Sistemate tutti i possibili piani di simmetria per gli acidi 1,3-ciclobutandicarbossilici cis e
trans.
13. Quali tra i seguenti derivati del cicloesano sono chirali? (Per la determinazione della
chiralità, l'anello può essere trattato come se fosse planare):
a)
H3C
O
c) CH3
O
b)
CH3
d)
e) CH3
CH3
CH3
CH3
H3C
CH3
CH3
O
O
CH3
f)
CH3
14. Trovare, per ciascun composto della prima riga, lo stereoisomero (se c'è) nella seconda riga.
a)
b)
CH2OH
H
O
c)
CO2H
NH2
d)
H
CH3 CH2 CH2
CH3
H
CH3
CO2H
I)
H2N
O-CH3
III)
CH2OH
H
H
IV)
CH3
C
O
CH3
H
OH
II)
H
C
CH3
OH
CH3 O
H3C
C
OH
H
CH2 CH2 CH3
OH
15. Quali, tra le seguenti coppie, rappresentano una coppia di enantiomeri?
CH2OH
CH2OH
O OH
O H H
H
H
H
OH H
OH H
H
HO
OH OH
H
OH
H HO
b)
H
CO2H
NH2
e)
a)
d)
CO2H
NH2
H
H
H3C
CH
CH2
CH2
H3C
O
CH2OH
H
H
H
HO
OH
OH
c)
CH2OH
H
O H
H
H
H
OH
HO
OH OH
CH3
CH
CH3
CH3
CH3
H
H
H
OH
CH2OH
H3C
D
H
OH
Cl
H
OH
H
Cl
H
HO
16. Assegnare alle seguenti strutture la configurazione, secondo la notazione R,S:
c)
H
a)
d)
CHO
Br
b)
CH3 CH2
H
Cl Cl
CO2H f)
H
CO2H
NH2 H2N
H
H
CH3
NH2
H3C
H
CO2H
NH2
17. Scrivere gli enantiomeri di: a) 2-butanolo; b) 1-bromo-1-feniletano; c) 3-bromo-3metilepta-no; assegnare a ciascun enantiomero la notazione R,S.
18. Alcune delle molecole elencate di seguito sono chirali, altre no. Scrivere le formule
tridimensionali e quelle proiettive (Fischer) per gli enantiomeri delle molecole con C chirale,
attribuendo a ciascun enantiomero la configurazione, secondo la notazione R,S: a) 1-cloropropano; b)1-bromo-1-cloropropano; c) bromocloroiodometano; d) 1-cloro-2- metilpropano; e)
2-cloro-2-metilpropano; f) 2-cloro-2-metilbutano; g) 2-bromobutano; h) 1-cloropentano; i) 2cloropentano: l) 3-cloropentano.
19. Scrivere ciascuno dei seguenti composti secondo la proiezione di Fischer ed assegnare a
ciascuno stereocentro la configurazione, secondo la notazione R,S:
CH3
a) CO H
CH3
CH OH
c)
e)
b)
2
H
H
H
Br
CH3
H
H
CH3
Br
H
Cl
CH3
d)
H
2
H
CH2Cl
Cl
Cl
H
CH3
CH2CH3
CH3
H
CH3
H
Cl
Cl
20. Scrivete le seguenti strutture servendovi delle formule proiettive di Fischer. Assegnare poi a
ciascuno stereocentro la configurazione, secondo la notazione R,S:
a)
CH3
H2C
H
C
Br
CH3
H3C
b)
C
Cl
Cl
H
H
C
c)
HC
C
C CH(CH3)2
Br
f)
CH2 CH3
CH3
H
H3C
C
CH3
HC
HO
CH CH CH3
e)
d)
C
Cl
Cl
H
CH2
F
C
OH
C
H
CH3
HO
21. Data la proiezione di Fischer scritta a destra, dire se è di serie R o S.
CH3
H
Br
CH2CH3
Determinare se le strutture scritte sotto con una simbologia diversa, corrispondono di volta in
volta alla struttura inizialmente scritta o al suo enantiomero.
H
CH2CH3
H
Br
CH3
(a)
CH3
CH2CH3
Br
(b)
H
H3C
Br
CH3
(c)
CH3
H
H
CH3
H
Br
H
H
H
H3C
H
(d)
22. Quanti stereocentri contiene ciascuno dei seguenti composti?
H3C
CH3
(e) H
Br
H
CH3
Br
H
(f)
H
a)
b)
OH
H
OH
e)
H
CH3 CH2 CHDCl
H
H
H
OH
CO2H
f)
CH3 CH2 O
O
CH3
CH3 CH2 O
CO2H
CH3
c)
CO2H
H
HO
H3C
d)
OH
H
CO2H
O
g)
O
23. Quanti stereoisomeri ha ciascuna delle seguenti strutture? Scrivete le strutture meso che
trovate:
a)
b)
CH3 CH2 CHBr CO2H
d)
CH3 CH Br
CH3
CH3
e)
SH CH3
g)
f)
H
O
CH
CH3
CH2
CH3
j)
NH2
HO
CH2 CH3
H3C
CH
CH3 CH2
i)
CH3
OH
H
O
CH3 CH2 CH CH2 CH2 CH OH
CH3 CH2 CH2 CH CH CH3
CH3
O
h)
c)
O CH CH2 CH3
CH CH2
CO2H
CH CO2H
CH2 CH3
24. Indicare, per ciascuna delle seguenti coppie, se si tratta di una coppia di enantiomeri, di
diastereomeri o di isomeri strutturali:
(a)
CO2H
H
H2N
CO2H
NH2
H
(c)
CHO
CHO
CH2OH
CH2OH
(b)
H3C
CH3 H3C
C
C
H
H
H
OH
H
H
OH
HO
H
OH
H
CH2OH
CH2OH
H
C
(d)
CHO
CHO
H
OH HO
H
H
OH HO
H
H
OH HO
H
H
OH HO
H
CH2OH
CH2OH
C
CH3
25. Indicare se le seguenti coppie sono strutture enantiomere, diastereomere o identiche:
H3C
F
(a)
C
Br F
CH3
C
Cl
H3C
H
(b)
C
CO2H H3C
H
OH
C
CO2H
(c)
Cl
H
Cl
Cl
Cl
Br
OH
H
H
Cl
H
OH
d)
CH3 CH2
OH
CH2
C
C
H
H
CH3
C
OH
H
CH2
C
CH2
C
CH3 CH2
H
CH2
e)
CH3
CH2
H
CH2
CH3
CH3
CH2
H
OH
H2C
CH2
C
C
CH3
CH2
CH2
CH2
C
CH3
H
H
26. Quanti stereoisomeri possono esistere per ciascuno dei seguenti composti? Servirsi delle
formule proiettive di Fischer: a) 2,3-butandiolo; b) 2,3-pentandiolo; c) 3-cloro-2-butanolo; d)
2,3,4-tricloroesano; e) 2,3,4-tricloropentano; f) 1,2-dimetil ciclopropano; g) 2,2-diclorobutano;
h) 2,3-diclorobutano; i) metilciclopentano; l) 1,1-dimetilciclopropano; m) 1-cloro-1-metilciclopropano; n) 1-cloro-2-metilciclopropano.
27. Specificare la configurazione (R o S) di ciascun centro chirale delle seguenti strutture:
a)
H
b)
C
H3C
OH
CH2CH3
CHO
H
c) Cl
H
H
Cl
OH
CH2OH
28. Quanti stereoisomeri possono esistere per un composto con tre diversi centri chirali? Se
indichiamo con 1,2 e 3 i centri chirali, quali possono essere le configurazioni degli stereoisomeri? (ad esempio, 1R,2R,3R).
29. Completare la formula proiettiva di Fisher della struttura qui sotto:
CHO
H
CHO
HO
C
CH2
OH
C
H
OH
CH2OH
30. Scrivere le formule proiettive di Fischer dei seguenti enantiomeri: a) acido D-(-)-lattico (=
acido 2-idrossipropanoico); L(-)-alanina (= acido 2-amminopropanoico); c) D-(-)-eritrosio (=
2,3,4-triidrossibutanale); d) L-(+)-eritrosio; e) D-(+)-gliceraldeide; f) (R)-3-bromoeptano; g)
(S)-2-pentanolo.
31. Assegnare la configurazione, secondo la notazione R,S, agli stereoisomeri dell'1-bromo2,3-difenilpropano.
32. L'(S)-2-butanolo ha potere rotatorio specifico di +13.5°. Quale è il potere rotatorio specifico
dell'(R)-2-butanolo?
33. L'(S)-2-iodobutano ha un potere rotatorio specifico di +15.9°. Quale è la rotazione osservata
per una miscela equimolare di (R)- e di (S)-2-iodobutano?
34. Ciscuno dei seguenti composti viene sciolto in un solvente otticamente inattivo. Quale
soluzione provocherà una rotazione del piano di vibrazione della luce polarizzata?: a) (2S,3R)2,3-diamminobutano; b) (2S,3S)-2,3-diamminobutano; c) una miscela equimolare di (a) e (b);
d) una miscela equimolare di (b) e di (2R,3R)-2,3-diamminobutano.
35. Sapendo che il potere rotatorio specifico dell'acido (+)-tartarico (acido 2,3-diidrossibutandioico) è +12.0°, calcolare la rotazione specifica di: a) una miscela equimolare di acido (-)-tartarico e meso-tartarico; b) una miscela equimolare di acido (-) e (+)-tartarico.
36. a) Quale degli stereoisomeri dell'acido 1,2-ciclopropandicarbossilico esiste in forme enantiomere? b) Fra gli isomeri dell'acido 1,3-ciclobutandicarbossilico, ve ne può essere uno
risolvibile in forme enantiomere? c) Quale degli isomeri geometrici dell'1,2-cicloesandiolo
esiste in forme enantiomere?
37. a) Perché il 2,2'-dicarbossi-6,6'-dinitrobifenile dà luogo ad isomeria ottica, pur non avendo
atomi di carbonio chirali? b) Pensate che il 3,3'dicarbossi-5,5'-dinitrobifenile si comporti allo
stesso modo e perché?
38. Scrivere tutti gli stereoisomeri dei seguenti composti, indicando le relazioni di enantiomeria
e distereomeria e gli isomeri otticamente attivi: a) 3-cloro-2,4-difenilpentano; b) 2,4-pentandiolo; c) 1,3-butandiolo; d) 1,3-dibromociclopentano; e) 2-metilciclobutanolo; f) 3-metilciclobutanolo; g) 2-amminocicloesancarbaldeide; h) 1,2-cicloesandiolo; i) 1,3-cicloesandiolo; l) 1,4cicloesandiolo.
39. Dire quali dei seguenti composti possono essere risolti in forme otticamente attive: a) 1,3dimetilciclobutano; b) acido 2-metilpentanoico; c) 3-ammino-1-butene; d) cis-1,3-dimetilciclopentano; e) trans-1,3-dimetilciclopentano; f) cis-1-cloro-2-metilciclobutano.
40. Scrivere i seguenti composti con le notazioni di Fischer: a) eritro-2,3-di-fenil-1-butanolo;
b) treo-2,3-difenil-2-butanolo; c) treo-3-fenil-2-pentanolo; d) acido eritro-2,3dibromobutanoico; e) acido meso-2,3-dimetilbutandioico; f) acido treo-2,3-di-idrossibutanoico;
g) eritro-3-bromo-2-butanolo; h) (S)-2-butanolo; i) (R)-2-metil-1-butanolo; l) (R)-1-cloro-2metilbutano; m) (S)-1-bromo-2-metilbutano; n) (2S,3R)-2,3-dibromopentano; o) (2S,3S)-3bromo-2-metilpentanale.
41. Il composto scritto sotto è uno zucchero, di nome (-)-arabinosio, il cui potere rotatorio specifico è -105°.
CHO
HO
H
H
OH
H
OH
CH2OH
a) Assegnare la configurazione secondo la notazione D,L. b) Assegnare la configurazione
secondo la notazione R,S. c) Scrivere un enantiomero del (-)-arabinosio. d) Ce ne sono altri? e)
Scrivere un diastereomero del (-)-arabinosio. f) Ce ne sono altri? g) Se possibile, prevedete il
potere rotatorio specifico della struttura scritta al punto (c). g) Se possibile, prevedete il potere
rotatorio specifico della struttura che avete scritto al punto (e). h) Il (-)-arabinosio ha
stereoisomeri otticamente inattivi? In caso di risposta affermativa, scrivetene uno.
42. Scrivere con le formule proiettive di Fischer i seguenti composti, assegnando a ciascuno
stereocentro la configurazione, secondo la notazione R,S: a) acido D-2-bromo-butanoico; b) L2-cloropropanale; c) D-3-ammino-1,2-butandiolo; d) L-2,3,4-tribromobutanale; e) L-2,3dibromopropanale.
43. a) Scrivere la formula proiettiva di Fischer ed una conformazione alternata a cavalletto del
treo-2-cloro-2,3-difenilbutano. b) Scrivere la proiezione di Newman per la conformazione più
stabile dell'(1S,2R)-1,2-dibromo-1,2-difeniletano. c) Scrivere le formule a cavalletto di tutti gli
stereoisomeri dell'1-bromo-1,2-difenilpropano in cui l'H sul C2 ed il bromo siano in posizione
anti.
44. L'acido citrico (1,1,2-tricarbossi-1-idrossietano) è il principale componente degli agrumi.
Presenta attività ottica? Se consideriamo i suoi mono- di- e tri-metil esteri, è possibile avere
isomeri ottici?
Esercitazione n. 7 - Risonanza.
TERMINI ED ARGOMENTI PER LO SVOLGIMENTO DEGLI ESERCIZI DI QUESTO FOGLIO: Regole
con cui si scrivono le strutture di risonanza. Aromaticità.
1. a) Quale delle strutture di risonanza per ognuna delle seguenti serie contribuisce di più alla
descrizione della struttura reale?
a)
..
NH2
H
..
H + NH2
C
O
O
O
c)
+ ..
CH3-CH-OH
..
CH3
CH2
+
; b)
H
_
CH2
H
O
CH2
O
+
CH3CH=OH
..
O
d)
+
NH2
H
CH3
O
C+
O
CH2
CH3
CH2
2. Quale delle strutture di risonanza per ognuna delle seguenti serie contribuisce di meno alla
descrizione della struttura reale?
O
+ N O
a)
H3C
O2+
N
H3C
O
+
N O
OH3C
b) H3C C NH2
O
H3C
C
+
NH2
H3C
O-
+
C
NH2
O-
3. Quali dei seguenti composti sono stabilizzati per risonanza? Scrivere le strutture
corrispondenti:
CH3CH2CH3 ; CH2=CH2 ; CH3OSO3- ; CH3CO2H ; CH3-O-CH3 ; CH2=CH-O-CH3;
CH3CN ; CH2=CH-CN
4. Scrivere le strutture canoniche di risonanza dei seguenti composti: a) acetammide (=
etanammide); b) acetonitrile (= etanonitrile); c) 2-butenenitrile; d) butanone; e) 3-buten-2-one;
f) butadiene; g) metil vinil etere; h) 1-nitropropano; i) propanoato di metile.
5. Dare il nome ai seguenti composti. Sulla base della regola di Hückel, indicare quali sono
aromatici e quali no. Spiegare i motivi della scelta.
6. Provate a dare il nome ai seguenti composti. Sulla base della regola di Hückel, indicare quali
sono aromatici e quali no. Spiegare i motivi della scelta.
7. Scrivere le strutture canoniche di risonanza dei seguenti composti: a) benzene; b) naftalene;
c) antracene; d) fenantrene; e) anilina; f) nitrobenzene; g) benzencarbaldeide; h) acetofenone (=
feniletanone oppure fenil metil chetone); i) fenil metil etere: l) clorobenzene; m) toluene (=
metilbenzene); n) benzoato di fenile.
8. Scrivere le strutture di risonanza dei seguenti composti: a) piridina; b) pirrolo; c) anione
ciclopentadienato; d) catione cicloeptatrienilio; e) 1-naftolo; f) 2-naftolo; g) 1-nitronaftalene; h)
acido 2-naftalencarbossilico; i) p-cloronitrobenzene; j) m-cloronitrobenzene; k) acido pidrossibenzoico; l) o-amminobenzencarbaldeide; m) p-amminobenzenolo; n) m-dinitrobenzene;
o) p-clorobenzobitrile; p) o-dimetossibenzene; q) m-clorometossibenzene; r) p-bromometossibenzene.
9. Gli spettri di assorbimento riportati qui sotto sono di due molecole di origine naturale: il
carvone (che si estrae dal cumino) ed il piperonale (che si estrae dal pepe). a) Sulla base delle
formule riportate, dire quale è lo spettro del carvone e perché. b) La concentrazione del carvone
è 0.043 M, quella del piperonale è 0.067 Μ. Sapendo che il cammino ottico è 1 cm per
entrambi i composti, calcolare il valore di εmax per i due composti.
I
O
O
O
O
piperonale
carvone
H
II
Esercitazione n. 8 - Aspetti generali di reazioni e meccanismi.
TERMINI ED ARGOMENTI PER LO SVOLGIMENTO DEGLI ESERCIZI DI QUESTO FOGLIO: Reagenti
elettrofili, nucleofili, radicalici. Stato di transizione ed energia di attivazione. Coordinata di reazione. Costante di
veklocità. Barriera di energia. Reversibilità microscopica.
1. Dare una definizione dei seguenti termini: coordinata di reazione; stadio di una reazione;
stato di transizione, reagente radicalico; scissione eterolitica; scissione omolitica; carbocatione;
nucleofilo; elettrofilo; reversibilità microscopica; energia libera standard; energia libera di
attivazione; costante di velocità; costante di equilibrio; stadio lento; controllo cinetico;
controllo termodinamico.
2. Esaminate il seguente andamento dell’energia il funzione della coordinata di reazione ed
individuate quanti sono gli stati di reazione, quale è lo stadio più esoergonico (esotermico) e
quale è lo stadio lento
3. Considerando il diagramma dell'energia riportato nella pagina seguente:
a) Quale è lo stadio lento di A → D? b) Quale è il ΔG° di C → D? c) Quale è il ΔG# di A → C?
d) Quale è il ΔG# di D → C?
ΔG
ΔG
kJ/mole
kcal/mole
coordinata di reazione
4. Secondo il seguente diagramma di energia, a) Quale è il prodotto cinetico da A? b) Quale è il
prodotto termodinamico da A? c) Quale è il ΔG# per A → B? d) Quale è il ΔG# per A → C?
e) Quale è il per A → C? f) a 0°C, quale è il prodotto più probabile da A? g) Calcolate il
rapporto approssimato di C/B all'equilibrio, a temperatura ambiente.
ΔG
ΔG
kcal/mole
kJ/mole
5. Servendovi dei diagrammi di energia, indicate un composto stabile per ΔG° ed uno per ΔG#.
6. A temperatura ambiente una reazione reversibile mette in equilibrio A e B, in rapporto 85:15.
Quale è la differenza di energia libera tra A e B?
7. Una reazione mette in equilibrio C con D, con un ΔG° di -1 kcal/mole. Assumendo che la
reazione rimanga reversibile e che il non cambi, quale sarebbe il rapporto C:D se la reazione
fosse eseguita a -50°C? E a 25°C? E a 100°C?
8. La velocità relativa di due reazioni unimolecolari è 10 000 : 1 in condizioni identiche, a
25°C. Quale è la differenza delle loro barriere di energia?
9. Indicare tra le seguenti specie gli elettrofili ed i nucleofili:
BF3, H+, Ne, NH3, CN-, H2O, CH2=CH2, AlCl3, (CH3)3C+, H2
CH3O-, PH3, HBr, Cu2+, CH3Cl, CH3NH2, HHONH2 , H3C C CH , H2C O, I-, CH3CH2S , Hg2+,
10. Completare le seguenti reazioni, mettendo le frecce curve che indicano la direzione di
flusso degli elettroni:
H .. H
a)
N
H
H
b)
H2C
+
..
Br:
..
HC
H
H + H
O
H
+
H
N
H
+
H .. H
O
..
H
H
H2C
+
CH
..
:Br:
..
H
H2C
Br
CH
11. Ciascuna delle seguenti molecole è un elettrofilo. Individuare l’atomo elettrofilo in ciascun
caso e scrivete il prodotto di reazione con un generico nucleofilo Nu-.
O
H
+
O
H
CH3 S
H3C
Cl
O + O
CH3
12. Ciascuna delle seguenti molecole è un nucleofilo. Individuare l’atomo nucleofilo in ciascun
caso e scrivete il prodotto di reazione con un generico elettrofilo E+.
H3C
H3C C C :-
O
CH3
H H
Al
- O CH3
H2N NH2
S-
S
13. Individuare l’elettrofilo ed il nucleofilo nelle seguenti reazioni e provare a completarle di
conseguenza, dopo aver messo le frecce curve per indicare la direzione del flusso degli
elettroni:
H
- H
B
H
H + H
N
H
H
+ X+
H
+ Y-
b) individuare di che tipo sono le seguenti reazioni, l’elettrofilo ed il nucleofilo e provare a
completarle di conseguenza.
NaOH
a)
Br
Br
b)
c)
OH
+
HS
S
+
H Br
Br
14. Indicare come potrebbero essere avvenute le seguenti reazioni, servendovi delle frecce
curve, dopo aver identificato l’atomo nucleofilo e quello elettrofilo:
-
a)
H
b)
-
O
O
O OH
+
OH
H
O
O
Br
H O
+
H
-
Esercitazione n. 9 - Esercitazione sulla risonanza magnetica nucleare (NMR)
TERMINI ED ARGOMENTI PER LO SVOLGIMENTO DEGLI ESERCIZI DI QUESTO FOGLIO: Risonanza
magnetica nucleare di 13C e 1H. Chemical shift e TMS. Effetto induttivo sul chemical shift. Integrazione del
segnale. Suddivisione spin-spin del segnale e costanti di accoppiamento.
1.Dare una definizione dei seguenti termini: TMS; ppm; δ; doppietto; tripletto; area del
segnale; accoppiamento spin-spin; chemical shift; campo alto; multipletto; quartetto..
2. Indicare quante righe ha e in che rapporto sono un multipletto proveniente dalla suddivisione
provocata da: a) cinque protoni equivalenti; b) sei protoni equivalenti; c) quattro protoni
equivalenti.
3. Perché è difficile individuare le righe all’estremità dell’eptupletto con cui risuona un protone
adiacente a sei protoni equivalenti?
4. Uno studente ha registrato gli spettri 1H NMR dell’1-cloropropano, dell’1-bromopropano e
dell’1-iodopropano, ma si è dimenticato di scrivere sugli spettri i nomi dei composti. Aiutatelo
ad identificarli, sapendo che i chemical shifts di ciascuno dei tre segnali in ciascuno spettro
cadono a:
a) 3.35, 1.89 e 1.06 δ; b) 3.16, 1.88 e 1.03 δ; c) 3.47, 1.81 e 1.06 δ.
A quali protoni corrispondono i tre segnali? Che forma vi aspettate abbiano?
5. Scrivere una struttura in accordo con i dati NMR di ciascuna delle seguenti formule
molecolari:
a) C5H12, singoletto a 0.97 δ.
b) C8H18, singoletto a 0.97 δ.
c) C9H20, singoletto a 0.84 d e singoletto a 0.98 d (integrazione, rispettivamente, 90 mm e 10
mm).
d) C2H3Cl3, singoletto a 2.72 δ.
e) C3H7I, tripletto a 1.03 δ (integrazione 36 mm), multipletto a 1.88 δ (integrazione, 24 mm),
tripletto a 3.16 δ (integrazione, 24 mm).
f) C3H7I, doppietto a 1.16 δ (integrazione 48 mm), eptupletto a 3.94 δ (integrazione, 8 mm).
6. Un composto di formula molecolare C4H9I ha il seguente spettro 1H NMR: Di quale isomero
si tratta? (Spiegare).
7. Un composto di formula molecolare C3H7Br ha il seguente spettro 1H NMR: Di quale
isomero si tratta? (Spiegare).
8. Un composto di formula molecolare C3H6Cl2 ha il seguente spettro 1H NMR: Di quale
isomero si tratta? (Spiegare).
9. Un composto di formula molecolare C4H9I ha il seguente spettro 1H NMR: Di quale isomero
si tratta? (Spiegare).
Esercitazione n. 9 - Reazioni acido-base.
TERMINI ED ARGOMENTI PER LO SVOLGIMENTO DEGLI ESERCIZI DI QUESTO FOGLIO:
Definizioni di acido e base secondo Brønsted; Ka e pKa di acidi e di basi; Kb e pKb di basi. Basicità ed acidità
dei diversi centri basici ed acidi nei composti organici. Effetti elettronici dei sostituenti (induttivo e coniugativo).
Acidi e basi secondo Lewis.
1. Nelle seguenti reazioni acido-base individuare l'acido e la base:
1)
NH3
+
CH3CO2H
NH4+
+
CH3CO2-
2)
NH4+
+
H2O
NH3
+
H3O+
H3O+
+
CH3CO2-
3) H O + CH CO H
2
3
2
O
4) CH3 N C
+ HCH3
H
OH
5)
6) CH3 NH2
+
O
-
+
CH3 N C
CH3
O
+ HO-
H3O+
H2
+
NH
CH3
3
+
H2O
+
H2O
2. Se si considera la reazione acido-base tra acqua ed ammoniaca, l'ammoniaca funziona da
nucleofilo e l'acqua da elettrofilo:
..
H2O:
+
: NH
3
..
HO:
..
+
NH4+
a) con quali elettroni il centro nucleofilo dell'ammoniaca formerà il legame con il centro
elettrofilo dell'acqua? b) che cosa deve avvenire contemporaneamente alla formazione di
questo legame? Perché? c) Schematizzare il meccanismo con cui avviene la reazione acidobase.
3. Completare le seguenti reazioni acido-base: a) etanammina + acido acetico; b) metossido di
sodio + 3-ossobutanoato di etile; c) nitrometano + butillitio; d) etino + NaNH2 (sodioammide);
e) fenolo + idrossido di sodio; f) acido tricloroetanoico + benzenammina; g) acido metanoico +
acido cloridrico; h) acetato di sodio + acqua; i) acido 2-amminopropanoico; j) acido propanoico
+ acqua; k) dietilammina + acqua; l) acido benzoico + acqua.
4. Spiegare perché tutti i composti organici contenenti ossigeno si sciolgono in acido solforico
concentrato (suggerimento: l'acido solforico concentrato è un acido molto forte...).
5. Spiegare perché (CF3)3N è una base più debole di (CH3)3N.
6. Una molecola con pKb 8 è più o meno basica di una molecola con pKb 3?
7. La metanammina ha un pKa 10.62 ed un pKa 35. Come si spiega questa apparente
incongruenza?
8. Partendo da concentrazioni equimolari dei reagenti, in quale direzione sarà spostato il
seguente equilibrio (spiegare).
(CH3)3CO- + CH3OH
(CH3)3COH + CH3O-
9. Mettere i seguenti alcooli in ordine di acidità crescente: cicloesanolo, 3-clorocicloesanolo, 2clorocicloesanolo, 4-clorocicloesanolo.
10. Scrivere le strutture di risonanza per gli acidi m-metossibenzoico e p-metossibenzoico e
spiegare perché si trova il seguente ordine di acdità: acido m-metossibenzoico > acido benzoico
> acido p-metossibenzoico.
11. Perché il m-nitrofenolo è meno acido del p-nitrofenolo, ma più acido del fenolo?
12. Mettere i seguenti acidi in ordine di acidità decrescente (scrivere gli equilibri corrispondenti
e spiegare):
a) acido propanoico, acido 2-bromopropanoico, acido 2,2-dibromopropanoico;
b) acido butanoico, acido 3-fluorobutanoico, acido 3-bromobutanoico;
c) acido cicloesancarbossilico, acido 1-fluorocicloesancarbossilico, acido 4-fluorocicloesancarbossilico.
13. Mettere i seguenti acidi in ordine di acidità crescente (scrivere gli equilibri corrispondenti e
spiegare): fenolo, 3,4-dimetilfenolo, acido m-idrossibenzoico, p-(fluorometil)fenolo.
14. a) Scrivere l'equilibrio acido-base per l'acido benzoico, dando la definizione di pKa; b) il
pKa dell'acido benzoico è 4.20, quello dell'acido m-clorobenzoico è 3.83 ed il pKa dell'acido pclorobenzoico è 3.99. Spiegare questi dati sperimentali con la teoria degli effetti dei sostituenti.
15. Scrivere la formula dell'N-fenil-1,2-diamminoetano e dire quale è il centro basico più forte.
Spiegare e scrivere l'equilibrio acido-base.
16. I composti carbonilici possiedono proprietà basiche. Scrivere la reazione tra un chetone ed
un acido, spiegando perché il propanone è meno basico del feniletanone.
17. Disporre in ordine di acidità i seguenti composti. Scrivere gli equilibri acido-base
corrispondenti e spiegare i motivi della scelta:
a) propino, acido acetico, acido metansolfonico;
b) etano, etene, etino;
c) 1,3-cicloesandione, 1,4-cicloesandione, 2-nitro-1,3-cicloesandione;
d) m-metilfenolo, acido butanoico, etanonitrile;
e) difenilmetano, trifenilmetano, toluene (=metilbenzene);
f) p-nitrofenolo, 3-metil-4-nitrofenolo;
g) acido m-amminobenzoico, acido p-amminobenzoico, acido benzoico.
18. Disporre in ordine di basicità i seguenti composti. Scrivere gli equilibri acido-base
corrispondenti e spiegare i motivi della scelta:
a) fenolo, p-nitrofenolo, m-nitrofenolo;
b) anilina, acido m-amminobenzencarbossilico, acido p-amminobenzencarbossilico;
c) N-metilbenzenammina, metilamminocicloesano, metossibenzene;
d) ione propanoato, ione propossido, propanammina;
e) etanolo, ione etossido, etanammina;
f) etanammina, etilmetilammina, trietilammina;
g) ione etossido, ione terz-butossido, butillitio.
19. Nelle seguenti reazioni, quale reagente è l'acido di Lewis e quale la base di Lewis?
a)
(CH3)3CCl + AlCl3
(CH3)3C+ + AlCl4b)
c)
((CH3)3C+
+
CH2=CH2
BF3 + CH3CH2-O-CH3CH3
(CH3)3CCH2CH2+
-
F3 B
CH2CH3
O+
CH2CH3
20. Completare le seguenti reazioni acido-base di Lewis, indicando il meccanismo:
a) NaF + BF3; b) KCl + AlCl3
21. Indicare la posizione di attacco più probabile di un acido di Lewis su ciascuna delle
seguenti molecole: a) 1,4-diazacicloesano; b) anione fenato; c) metanolo.
22. In figura sono riportati gli spettri di assorbimento elettronico della anilina (=benzenammina) e della
p-nitroanilina. Indicare quale è lo spettro della 4-nitroanilina (spiegando il perché della scelta) e
giustificare la differenza tra gli spettri dei due composti.
CHIMICA ORGANICA I
Corso di laurea in CHIMICA (L.T.)
Esercitazione n. 10 - Reazioni degli alcani.
TERMINI ED ARGOMENTI PER LO SVOLGIMENTO DEGLI ESERCIZI DI QUESTO FOGLIO: Reazioni
degli alcani (alogenazione, pirolisi, ossidazione): stechiometria e meccanismo, selettività ed orientamento. Atomi
enantiotopici e diastereotopici. Reazioni dei cicloalcani.
Esercizi per iniziare
1. Classificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o
benzilico:
H
a) (CH3)3CCH3
b) (CH3)3CH
c)
H
H
e)
d)
H
2. Mettere i seguenti radicali in ordine crescente di stabilità:
.
.
CH3CH2C(CH3)2
.
.
CHCH3
CHCH=CH2
CH3CH=CHCH2CH2
.
CH3CHCH3
3. Elencare i seguenti radicali in ordine crescente di reattività:
.
a)
.
b)
.
c)
CH
CH3
.
d)
4. Mettere i seguenti radicali in ordine di reattività crescente (stabilità decrescente):
.
(CH3)2CHCH2CH2
.
.
. CH
(CH3)2CHCHCH3
2CH(CH3)CH2CH3
(CH3)2CCH2CH3
5. Dire, per ciascuno dei seguenti radicali, se è "molto reattivo" o "poco reattivo":
.
O.
. .
Cl I
CH3CH2
.
.
F
N
H
6. Scrivere le strutture di risonanza dei seguenti radicali:
.
.
CH2
CHCH3
.
a)
b)
.
e)
CH2
CH2
f)
CH CH2
CHCH=CH2
d)
c)
.
.
CH=CHCH2
g)
H3C
O
C
.
O.
g)
7. In ciascuno dei seguenti composti indicare la posizione (o le posizioni) che vi aspettate
vengano attaccate da un radicale a bassa energia:
H3C
CH3
a)
CH3
b)
HC
CH3
c)
d)
CH3
8. Indicare, per ciascuna delle seguenti reazioni, se si tratta di uno stadio di inizio, di
propagazione o di arresto (termine):
a) (CH3)3C. + Br2
(CH3)3CBr + Br.
b) Cl2
2 Cl.
CH3CH2CH3 + CH3CH=CH2 d) 2 CH CH .
c) 2 CH3CH2CH2.
3 2
.
.
CH3CHCH3 + HCl
e) Cl + CH3CH2CH3
CH3CH2CH2CH3
9. Indicare se ciascuna delle seguenti reazioni è uno stadio di inizio, di propagazione o di
arresto:
a) (CH3)3C. + CH2=CH2
c)
CO3H
(CH3)3CCH2CH2.
O.
+ .OH
C
O
b) Br. + CH2=CH2
.CH CH Br
2 2
Esercizi per ricordare le reazioni
10. Il metilcicloesano viene trattato con cloro, irradiando con luce ultravioletta. Scrivere
l'equazione chimica della reazione e tutti i prodotti di monoclorurazione.
11. Completare le seguenti reazioni scrivendo (se c'è) il prodotto organico (o i prodotti) che si
forma e dandone il nome: a) etano + iodio, a caldo; b) propano + fluoro; c) 2,2,4-trimetilpentano + cloro, alla luce; d) 2,2,4-trimetilpentano + bromo, alla luce; e) metilciclopentano +
bromo, ad elevata temperatura.
12. Completare le seguenti reazioni, specificando il nome dei composti organici ottenuti: a)
ciclopentano + cloro, ad elevata temperatura; b) ciclobutano + idrogeno, in presenza di Pt,
scaldando; c) metilciclopropano + idrogeno, in presenza di Pt, a temperatura ambiente; d)
ciclopropano + bromo, irradiando con luce ultravioletta; e) metilciclopropano + HI.
13. Scrivere tutti i possibili prodotti della reazione tra 3-metilpentano e cloro alla luce
ultravioletta ( solo i prodotti di monoclorurazione); giustificare l'orientamento che si osserva e
scrivere una delle reazioni di arresto della catena.
14. Completare le seguenti reazioni del butano, specificando i nomi dei composti organici che
si ottengono: a) con cloro, alla luce; b) con ossigeno (autoossidazione); c) con ossigeno
(combustione); d) pirolisi; e) con bromo ad elevata temperatura.
15. Completare le seguenti reazioni del 3-metilpentano, specificando in ogni caso i nomi dei
composti organici che si formano e scrivendo in ogni caso il meccanismo: a) con bromo, ad
elevata temperatura; b) con ossigeno (autoossidazione); c) pirolisi.
16. a) Quali saranno i prodotti di disproporzione di CH3CH2CH2CH2.? e di CH3C.HCH3? b)
quali saranno i prodotti di acoppiamento dei radicali in (a), separatamente e insieme?
17. Completare le seguenti reazioni, mostrando solo il prodotto organico principale e
specificandone il nome:
O
CH2CH2CH3
hν
a)
CH3
?
+ Br2
d)
OH
+
hν
O
hν
f)
H3C
CH3
+ 2 Br2
hν
Cl2
?
CCl4
?
N-Br
CH2
?
CCl4
O
+
O
e)
hν
N-Br
+
CH2
hν
c)
b)
?
+ Br2
CCl4
?
Esercizi per capire le reazioni
18. Nella clorurazione del metilpropano, che rapporto dei prodotti (cloruro di isobutile/cloruro
di terz-butile) vi aspettereste se tutti gli idrogeni fossero strappati con la stessa velocità? Che
cosa succede, invece, in realtà?
19. Per clorurazione radicalica di un alcano di formula molecolare C5H12, si ottiene un solo
prodotto di monoclorurazione. Dire di quale composto si tratta e scrivere la reazione.
20. Mettere i seguenti composti in ordine crescente di reattività nella bromurazione radicalica:
a) metilbutano; b) propano; c) etilbenzene.
21. La bromurazione catalizzata dalla luce del cicloesene, con una bassa concentrazione di
bromo, dà esclusivamente il 3-bromocicloesene. Spiegare l'orientamento osservato.
22. Prevedere, per ciascuno dei seguenti composti, il prodotto principale della bromurazione
radicalica, ricordando che la bromurazione è molto selettiva:
a) cicloesano; b) metilciclopentano; c) 2,2,3-trimetilbutano; d) 2,3-dimetilpentano; e)
biciclo[4.40]-decano; f) 3-metilottano; g) esano; h) etilbenzene; i) 1,2-dimetilcicloesene.
23. Per ciascuno dei seguenti composti, scrivere le strutture di tutti i prodotti di monoclorurazione e prevedere l'orientamento con cui si formano: a) butano; b) metilbutano; c) 2,2,4trimetilpentano; d) 2,2,3-trimetilpentano; d) pentano; e) 1,2-dimetilcicloesano.
24. Prevedere il prodotto (o i prodotti) principali della monobromurazione radicalica di
ciascuno dei seguenti composti, appartenenti alla classe dei composti naturali chiamati terpeni:
a)
1-isopropil-4-metilcicloesano
(nome
corrente:
mentano);
b)
1,7,7trimetilbiciclo[2.2.1]eptano
(bornano);
c)
3-isopropil-1,6-dimetilbiciclo[5.3.0]decano
(pseudoguaiano); d) 4-isopropil-1,7-dimetilbiciclo[4.4.0]decano (eudesmano).
25. La clorurazione del pentano dà una miscela di tre prodotti monoclorurati; a) scriverne la
struttura, indicando il nome; b) prevedere in che rapporto si firmano, ricordando che l'atomo di
cloro strappa un H secondario circa 4.5 volte più velocemente di un H primario.
26. Scrivere lo stato di transizione per il secondo stadio di propagazione della clorurazione e
della bromurazione del metano. Mettere in evidenza se assomiglia di più ai reagenti i ai
prodotti, indicando quale legame parziale è èiù forte.
27. Scrivere le equazioni chimiche per i passaggi della diclorurazione radicalica del
ciclopentano che portano all'1,2-diclorociclopentano.
28. I perossidi vengono spesso usati come iniziatori delle reazioni radicaliche, perché il legame
O-O si scinde piuttosto facilmente. Per esempio, l'energia di dissociazione del legame O-O nel
perossido di idrogeno (acqua ossigenata) è solo 51 kcal/mole. Scrivere il meccanismo della
reazione del ciclopentano con cloro, iniziata dal perossido di idrogeno.
29. a)La bromurazione del metilbutano dà un solo prodotto: quale? Spiegare. b) La
clorurazione del metilbutano dà una miscela di prodotti di monoclorurazione, nelle seguenti
proporzioni: 1- cloro-2-metilbutano (34%), 2-cloro-2-metilbutano (22%), 2-cloro-3metilbutano (28%), 1-cloro-3-metilbutano (16%). Mostrare come si forma ciascuno di questi
prodotti. c) Spiegare i diversi risultati ottenuti con la clorurazione e con la bromurazione.
30. Per clorurazione dell'(S)-1-cloro-2-metilbutano si può formare, tra gli altri prodotti, l'1,3dicloro-2-metilbutano: questo dicloroalcano sarà racemico o no?
31. Identificare tutte le coppie di atomi enantiotopici e tutte le coppie di atomi diastereotopici
nelle seguenti molecole: a) 2,2-dimetilbutano; b) 3-metilesano; c) 3-metilpentano; d)
cicloesanone; e) (R)-2-clorobutano; f) (S)-2-butanolo.
32. Scrivere tutti i prodotti di monobromurazione dell'(S)-2-bromopentano su ciascun carbonio.
Dare il nome ai prodotti e specificare se sono chirali o achirali e se si formano in quantità
uguale o no.
33. Scrivere tutti i prodotti di monoclorurazione dell'(S)-1-bromo-2,2-dimetilciclobutano.
Specificare se sono chirali o achirali e se si formano in quantità uguale o no.
34. Dire quanti stereoisomeri diversi si formano nella bromurazione radicalica dei seguenti
composti, indicando se si formano in quantità uguale o no: a) trans-1,2-dimetilciclopentano
racemico; b) (R,R)-1,2-dimetilciclopentano.
35. L'(S)-3,5-dicloropentano, reagendo alla luce con una mole di cloro, dà diversi isomeri di
formula molecolare C5H9Cl3. Considerando i prodotti di clorurazione sul C-3, C-4 e C-5, dire,
per ciascuno di essi, a) quanti stereoisomeri si sono formati; b) se se ne è formato più di uno, si
sono formati in quantità uguale o diversa? c) Indicare per ogni stereocentro se è R o S.
Esercizi per applicare le reazioni
36. La reazione dello spiro[2.2]pentano è uno dei modi migliori per preparare il
clorospiro[2.2]-pentano. a) Spiegare perché la clorurazione in questo caso è un metodo
preparativo utile. b) Scrivere il meccanismo della reazione.
37. a) Nel corso della bromurazione dell'etano, sono presenti sia atomi di bromo che radicali
etile, ma non in quantità uguali. Chi sarà presente in quantità maggiore? Spiegare.
b) Nella bromurazione del bromoetano si formano due prodotti, A e B, di formula molecolare
C2H4Br2, che hanno lo spettro 1H NMR riportato qui sotto. Identificare A e B e discutere gli
spettri relativi.
38. La biosintesi dell'adrenalina richiede che un gruppo OH sia introdotto in modo specifico sul
substrato dopamina, achirale, per dare la (-)-norepinefrina, il solo enantiomero con attività
fisiologica corretta. a) Assegnare la configurazione alla (-)- norepinefrina, secondo la notazione
R,S. b) In che relazione stanno i due H del metilene della dopamina su cui avviene la reazione?
c) In assenza di enzima, lo stato di transizione di una ossidazione radicalica che porti alla (-)norepinefrina avrà energia uguale o diversa da quello che porta alla (+)-norepinefrina? In che
relazione stanno i due stati di transizione? d) Come deve agire l'enzima sullo stato di
transizione, per favorire la formazione dell'enantiomero levogiro? e) L'enzima deve essere
otticamente attivo o no?
HO
NH2
HO
enzima, O2
HO
HO
H
CH2NH2
HO
Dopamina
(-)-Norepinefrina