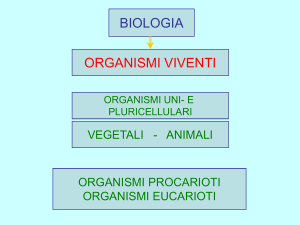
Introduzione alla biologia della
cellula
Lezione 2
Le biomolecole
Tutte le molecole contenute nelle
cellule sono costituite da
composti del carbonio
•
•
•
•
Zuccheri
Lipidi
Proteine
Acidi nucleici
Polimeri
Sono macromolecole formate da unità
(MONOMERI) legate da legami covalenti
OMOPOLIMERI
La molecola deriva
dall’associazione di
monomeri identici (es.
glicogeno)
ETEROPOLIMERI
Derivano
dall’associazione di due
o più specie molecolari
Zuccheri
•
•
•
•
•
Formula (CH2O)n
MONOSACCARIDI
DISACCARIDI
OLIGOSACCARIDI
POLISACCARIDI (catene lineari o
ramificate; omopolisaccaridi o
eteropolisaccaridi)
Zuccheri ciclici
• PENTOSI (n=5) ribosio, desossiribosio
• ESOSI (n=6) glucosio, galattosio, fruttosio
GALATTOSIO
FRUTTOSIO
CICLIZZAZIONE D-GLUCOSIO
Legame glicosidico (o
glucosidico)
• E’ un legame COVALENTE che si forma
tra l’ossidrile (-OH) di un monosaccaride e
il gruppo alcoolico (CHOH) di un altro
monosaccaride.
Lipidi
• Lipidi semplici (apolari): esteri di acidi
grassi con diversi alcooli (quindi
semplicemente acido grasso + alcool)
• Lipidi complessi (parzialmente polari):
esteri di acidi grassi con alcooli + R (gruppi
fosfato, glicidico e solfato)
• Steroidi (steroli): colesterolo strutturale (e
non circolante)
Lipidi semplici
• ACIDI GRASSI: catene carboniose di
diversa lunghezza
• Acidi grassi saturi
• Acidi grassi insaturi (doppio legame)
• ALCOOL
• Il legame si forma tra il gruppo carbossilico
(polare) e il gruppo –OH
Lipidi complessi
• R=gruppo glicidico
GLICOLIPIDI
• R=gruppo solfato
SOLFOLIPIDI
• R=gruppo fosfato
FOSFOLIPIDI:
sono i lipidi maggiormente presenti nelle
cellule; sono molecole polari; residui
idrofilici conferiscono alla molecola
carattere anfipatico.
Steroidi
• COLESTEROLO
• Entra nella costituzione della membrana
cellulare con funzioni diverse da quelle dei
fosfolipidi
• Ha una struttura RIGIDA
• Ha una estesa regione idrofoba e un gruppo
–OH idrofilo
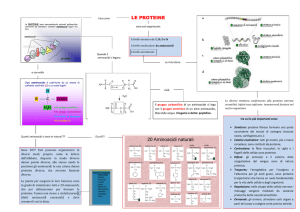
Proteine
• I monomeri che costituiscono le proteine
sono gli AMINOACIDI
• Gli AA interagiscono tra loro formando un
legame covalente molto stabile, il
LEGAME PEPTIDICO
• A seconda del numero di residui legati tra
loro distinguiamo dipeptidi, tripeptidi,
oligopeptidi e polipeptidi
Gruppo amminico (basico)
Gruppo carbossilico
(acido)
R Determina la differenza
fra gli aminoacidi
Il più semplice degli
aminoacidi è la
GLICINA (R=H)
L’acido aspartico ha due
gruppi acidi
La lisina ha due
gruppi basici
Legame peptidico
Struttura primaria
• I residui R possono essere anche tutti
diversi tra loro
• Per polipeptide si intende una CATENA
LINEARE di aminoacidi
• E’ una STRUTTURA PRIMARIA delle
proteine
Strutture secondarie
• La catena polipeptidica lineare può
ripiegarsi in tre modi diversi
• α-elica
• Piani β
• Random coil
• Ogni ripiegamento è dovuto alla presenza di
aminoacidi specifici (la sequenza primaria è
importante nel determinare la struttura
secondaria)
α-elica
• Struttura regolare: la catena è avvolta a
spirale
• E’ dovuta a una SPECIFCA SEQUENZA di
aminoacidi che permetta certi legami
• Il gruppo reattivo di un carbonio può reagire
con l’azoto di un altro aminoacido
si formano così LEGAMI A IDROGENO
(deboli)
La struttura deriva dal ripiegamento elicoidale dello scheletro peptidico delle proteine
che si presenta arrotolato attorno ad un asse longitudinale (immaginario) e stabilizzato
da legami idrogeno tra il gruppo —NH di un legame peptidico e quello C=O di quello
immediatamente sovrastante.
Piani β
• La struttura a piano-beta è formata da una
catena polipeptidica più volte ripiegata su se
stessa, in cui ogni segmento è orientato in
direzione opposta ai due contigui
• Dove la catena ha tratti paralleli si formano
legami fra i vari segmenti (gruppi –CO e
–NH)
• Il risultato è una struttura piana rigida
Random coil
• Struttura elicoidale casuale
Struttura terziaria
• E’ la conformazione definitiva di una
proteina
• E’ la “somma” dei ripiegamenti possibili
• Dipende quindi SEMPRE dalla particolare
sequenza primaria degli aminoacidi
• La proteina svolge correttamente la sua
funzione SOLO SE è ripiegata in una
struttura terziaria, perché è così che rivolge
verso l’esterno i gruppi reattivi
• Se la struttura terziaria è più o meno sferica
la proteina sarà globulare (es. actina: catena
lineare di monomeri globulari)
• Se la struttura terziaria ha forma allungata la
proteina sarà filamentosa (es. miosina)
• La corretta struttura terziaria (=forma finale
funzionante della proteina) dipende
DALLA STRUTTURA PRIMARIA ed è
indispensabile per il corretto funzionamento
della proteina
Struttura quaternaria
La proteina è formata dall’unione di più catene
polipeptidiche (uguali o diverse) ognuna
ripiegata nella sua struttura terziaria
Funzioni delle proteine
• Enzimatiche: proteine con ATTIVITA’
CATALITICA (accelerano una reazione
chimica)
• Strutturali (cheratina, collagene)
• Di trasporto (emoglobina)
• Motorie (miosina)
• Di deposito o accumulo (caseina)
• Recettoriali (rodopsina)
• Segnalatorie (ormoni proteici)