Introduzione alla Chimica
Organica
1
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Elementi Comuni nei Composti Organici
2
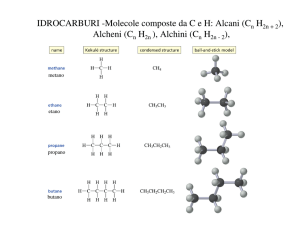
Classificazione degli idrocarburi
Gli idrocarburi sono fatti solo da idrogeno e carbonio.
3
Alcani
Gli Alcani hanno la formula generale CnH2n+2 dove n = 1,2,3,…
• solo legami covalenti singoli
• idrocarburi saturi perchè contengono il massimo numero
di atomi di idrogeno che possono essere legati al numero di
atomi di carbonio nella molecola
CH4
C 2H 6
C 3H 8
metano
etano
propano
4
Isomeri Strutturali sono molecole che hanno la stessa
5
formula molecolare ma differenti strutture
Quanti isomeri strutturali ha il pentano, C5H12?
H
H
H
H
H
H
C
C
C
C
C
H
H
H
H
H
H
n-pentano
H
H
H
CH3 H
H
C
C
C
C
H
H
H
H
2-metilbutano
H
H
CH3 H
C
C
H
CH3 H
C
H
2,2-dimetilpropano
6
Proprietà Fisiche di Alcani
7
Nomenclatura degli Alcani
1. Il nome proviene dalla catena più lunga di atomi di
carbonio nella molecola.
CH3
CH3
1
CH2
2
CH2
3
CH
4
4-metileptano
CH2
5
CH2
6
CH3 eptano
7
2. Un alcane meno un atomo di
idrogeno è un gruppo
alchilico.
metano
CH4
CH3
metile
8
Nomenclatura degli Alcani
3. Quando uno o più atomi di idrogeno sono sostituiti da altri
gruppi, il nome del composto deve indicare su quali atomi di
C avviene la sostituzione. Numerare nella direzione che dà
il numero più piccolo nella sostituzione.
CH3
CH3
1
CH
2
CH2
3
CH2
4
CH3
5
CH3
2-metilpentano
CH3
1
CH2
2
CH2
3
CH
CH3
4
4-metilpentano
5
9
Nomenclatura degli Alcani
4. Usare i prefissi di-, tri-, tetra-, quando c’è più di una catena
alchilica dello stesso tipo.
CH3
1
CH3
CH3
CH
CH
2
3
CH2
CH2
4
CH3
5
6
2,3-dimetilesano
CH3
CH3
1
CH
2
C
3
CH2
4
CH2
5
CH3
6
CH3
3,3-dimetilesano
10
Nomenclatura degli Alcani
5. Usare le regole precedenti per altri tipi di sostituenti.
CH3
1
Br
NO2
CH
CH
2
3
CH3
4
2-bromo-3-nitrobutano
Cl
CH2
1
F
CH2
2
CH
3
CH3
4
1-cloro-3-fluorobutano
11
What is the IUPAC name of the following compound?
CH3
CH3
1
CH
C 2H 5
CH2
2
3
CH
4
CH2
5
CH2
6
CH2
7
CH3
8
2-methyl-4-ethyloctane
What is the structure of 4-ethyl-2-methylhexane?
CH3
CH3
1
CH
2
C 2H 5
CH2
3
CH
4
CH2
5
CH3
6
12
Reazioni degli Alcani
Combustione
CH4 (g) + 2O2 (g)
CO2 (g) + 2H2O (l) ΔH0 = -890.4 kJ/mol
Alogenazione
luce
CH4 (g) + Cl2 (g)
CH3Cl (g) + HCl (g)
Cl2 + energy
Cl• + Cl•
H
H
Cl• + H
C
H
H
•C
H
H
H
C • + Cl
H
H + HCl
H
Cl
H
C
H
Cl + Cl•
13
Cicloalcani
Alcani i cui atomi di carbonio siano chiusi in anello sono chiamati
cicloalcani. Hanno formula generale CnH2n dove n = 3,4,…
14
Geometria dei Cicloalcani
più stabile
15
Alcheni
Gli Alcheni hanno formula generale CnH2n dove n = 2,3,…
• contengono almeno un doppio legame carbonio-carbonio
• sono anche chiamati olefine
CH
CH2
CH2
CH3
CH3
CH
1-butene
Cl
Cl
C
H
Cl
H
C
cis-dicloroetilene
CH3
2-butene
C
H
CH
H
C
Cl
trans-dicloroetilene
16
Isomerizzazione Cis-Trans nel Processo della Vista
Vision
Micrografia elettronica
dei bastoncini di retinale
17
Reazioni degli Alcheni
Cracking
C2H6 (g)
Pt
catalyst
CH2
CH2 (g) + H2 (g)
Reazioni di Addizione
CH2
CH2 (g) + HBr (g)
CH3
CH2
CH2 (g) + Br2 (g)
CH2Br
CH2Br (g)
CH2Br (g)
18
and/or
Regola di Markovnikov: nell’addizione di reagenti non
simmetrici (cioè polari) agli alcheni, la parte positiva del
reagente (di solito idrogeno) si lega all’ atomo di carbonio
che ha già il numero più alto di atomi di idrogeno.
19
Alchini
Gli Alchini hanno formula generale CnH2n-2 dove n = 2,3,4,…
• contengono almeno un triplo legame carbonio-carbonio
CH
C
CH2
1-butino
CH3
CH3
C
C
CH3
2-butino
Produzione di acetilene
CaC2 (s) + 2H2O (l)
C2H2 (g) + Ca(OH)2 (aq)
20
Reazioni degli Alchini
Idrogenazione
CH
CH (g) + H2 (g)
CH2
CH2 (g)
Reazioni di Addizione
CH
CH (g) + HBr (g)
CH2
CH
CH (g) + Br2 (g)
CHBr
CH
CH (g) + 2Br2 (g)
CHBr2
CHBr (g)
CHBr (g)
CHBr2 (g)
21
Idrocarburi Aromatici
H
H
H
C
C
C
C
H
C
C
H
H
H
H
H
C
C
C
C
C
C
H
H
H
micrografia elettronica
del benzene
22
Orbitali Molecolari Delocalizzati non confinati fra due
atomi adiacenti, ma estesi su tre o più atomi.
Esempio: Benzene, C6H6
orbitali π delocalizzati
23
Altre Rappresentazioni del Benzene
24
Nomenclatura di Composti Aromatici
etilbenzene
CH2CH3
aminobenzene
NH2
Cl
clorobenzene
6
2
5
3
4
nitrobenzene
Br
Br
1
NO2
Br
Br
1,2-dibromobenzene
1,3-dibromobenzene
25
Reazioni di Composti Aromatici
Reazioni di Sostituzione
H
Br
H
H
+ Br2
H
H
FeBr3
catalyst
H
H
+ HBr
H
H
H
H
H
CH2CH3
H
+ CH3CH2Cl
H
H
H
H
AlCl3
catalyst
H
H
+ HCl
H
H
H
26
Idrocarburi Policiclici Aromatici
27
Chimica dei Gruppi Funzionali
Gli Alcooli contengono il gruppo funzionale ossidrilico ed hanno
formula generale R−OH.
28
Produzione Biologica dell’etanolo
C6H12O6 (aq)
enzyme
2CH3CH2OH (aq) + 2CO2 (g)
Produzione di sintesi dell’etanolo
CH2 CH2 (g) + H2O (g)
H2SO4
CH3CH2OH (g)
Ossidazione metabolica dell’etanolo
CH3CH2OH
alcohol dehydrogenase
CH3CHO + H2
29
Chimica dei Gruppi Funzionali
Gli Eteri hanno formula generale R−O−R′.
Reazione di Condensazione
CH3OH + HOCH3
H2SO4
catalyst
CH3OCH3 + H2O
30
Chimica dei Gruppi Funzionali
O
Aldeidi e chetoni contengono il gruppo funzionalel carbonilico
( C = ).
O
• le aldeidi hanno formula generale
R C H
O
• i chetoni hanno formula generale
O
H C H
formaldeide
O
H C CH3
acetaldeide
R C R′
O
H3C C CH3
acetone
31
Chimica dei Gruppi Funzionali
Gli acidi carbossilici contengono il gruppo funzionale carbossile
( −COOH ).
32
Proprietà e Reazioni degli acidi carbossilici
• Generalmente acidi deboli
• Reagiscono con gli alcooli per formare gli esteri
• Neutralizzazione
• Produzione di cloruri acidi (intermedi in sintesi)
33
Chimica dei Gruppi Funzionali
Gli Esteri hanno formula generale R′COOR, dove R è un
idrocarburo.
Caratteristici odori ed aromi
Idrolisi
Idrolisi Alcalina (saponificazione)
34
Chimica dei Gruppi Funzionali
Le Ammine sono basi organiche con formula generale R3N.
CH3NH2 + H2O
RNH3+ + OH-
Neutralizzazione
CH3CH2NH2 + HCl
CH3CH2NH3+Cl-
35
Chiralità
Gli Enantiomeri sono isomeri dello stesso composto,
aventi una struttura speculare non sovrapponibile.
chirale
achirale
36