Esami:
mercoledì 4 Febbraio h:10
mercoledì 25 Febbraio h:10
La asimmetria del doppio strato è funzionalmente importante
Esempio: distribuzione dei lipidi nel doppio strato lipidico nei globuli rossi umani
fosfatidiletanolamina
fosfatidilserina
sfingomielina
fosfatidilcolina
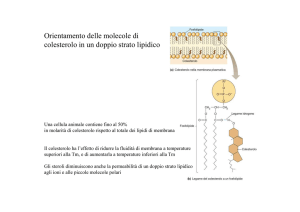
il colesterolo è supposto essere distribuito omogeneamente
glicolipidi
Fosfatidilserina, carica, nello strato interno
⇒ significativa differenza di carica tra le due metà del doppio strato
L’asimmetria viene sfruttata per distinguere le cellule vive da quelle morte
Apoptosi (morte programmata)
⇓
fosfatidilserina (normalmente confinata nel monostrato interno) rapidamente migra in quello
esterno
⇓
fosfatidilserina esposta sulla superficie
⇓
i macrofagi sono indotti alla fagocitosi
La traslocazione della fosfatidilserina nelle cellule apoptotiche avviene via 2 meccanismi
1.
2.
Il meccanismo che normalmente trasporta questi lipidi dall’esterno all’interno è bloccato
Un meccanismo che trasferisce in modo aspecifico i fosfolipidi nelle due direzioni è attivato
I glicolipidi
Sono presenti su tutte le membrane con il più alto livello di asimmetria
Sono presenti SOLO sul monostrato esterno (non-citosolico) preferibilmente nei lipid rafts.
Tendono ad auto-associarsi ⇒ legami H + forze di van der Waals tra le lunghe code saturate
Gli zuccheri sono esposti sulla superficie della cellula ed hanno un ruolo rilevante
nell’interazione della cellula con l’ambiente circostante
fosfatidiletanolamina
fosfatidilserina
sfingomielina
fosfatidilcolina
glicolipidi
glicolipidi ⇒ ≈ 5% dei lipidi del monostrato esterno delle membrane cellulari
sono presenti anche in alcune membrane intracellulari
Il più complesso dei
glicolipidi, il ganglioside,
contiene degli oligosaccaridi
con uno o più residui di
acido sialico con una carica
negativa
glicolipide neutro
Sono stati identificati più di 40 diversi gangliosidi
Più abbondanti nella membrana delle cellule nervose (5-10% della massa totale di lipidi)
Riassumendo 1
le membrane biologiche
consistono di un doppiostrato continuo di molecole
lipidiche in cui sono
immerse le proteine di
membrana. Il doppio-strato
si comporta come un fluido
Le molecole lipidiche sono
anfifiliche, le più numerose sono i
fosfolipidi. Quando sono poste in
acqua formano spontaneamente
compartimenti chiusi e doppi
strati
Riassumendo 2
Ci sono 3 classi principali di molecole
lipidiche: fosfolipidi, colesterolo e
glicolipidi
La composizione dei monostrati interno
ed esterno è diversa e riflette la diversa
funzione delle due faccie della membrana
Differenti proporzioni di lipidi sono presenti
in membrane di diverso tipo come nelle varie
membrane di una singola cellula eucariotica
Riassumendo 3
Acuni enzimi che legano le membrane richiedono la
presenza di specifici gruppi sulla testa dei lipidi
Acuni segnalatori estracellulari attivano le fosfolipasi che tagliano molecole
selezionate di fosfolipide nella membrana plasmatica e generano frammenti che
agiscono da segnali intracellulari
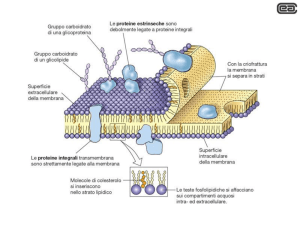
Le proteine di membrana
Sebbene i lipidi siano l’elemento base delle membrane le proteine svolgono la
maggior parte delle funzioni specifiche.
Le proteine forniscono alle membrane la loro specificità e, quindi, il tipo e il numero
è molto variabile
Nella membrana mielinica, che
ha principalmente lo scopo di
isolare gli assoni, meno del 25%
in massa sono proteine.
Nelle membrane coinvolte nella
produzione di ATP (come la
membrana interna dei
mitocondri) circa il 75% sono
proteine
Una tipica membrana plasmatica
è per circa il 50% della sua
massa formata da proteine.
I lipidi sono piccoli rispetto alle proteine ⇒ 50% in massa ≈ 50 lipidi / proteina
Proteine diverse sono associate in modo diverso con la membrana
Completamente esposte all’esterno
attaccate al doppio strato con legami
covalenti (specifico oligosaccaride)
Le regioni idrofobiche passano
attraverso
la
membrana
e
interagiscono con le code e le
regioni idrofiliche sono esposte
all’acqua da entrambi i lati
L’idrofobicità è maggiore se vi è
attaccato un acido grasso
In contatto solo con il
cytosol ed associate con il
monostrato interno o via
un elica anfipatica o con
una o più catene lipidiche
covalentemente
legate
(acidi grassi o gruppi
prenile*)
Non interagiscono
direttamente con il
doppio strato, ma
via legami non
covalenti con altre
proteine
di
membrana
Prenolo (contrazione: alcool + isoprenoide)
Si chiama estere il derivato della reazione di
un alcool con un acido:
R-COOH + R'-OH →R-C=O-OR'
L’unità C5H8 (in parentesi) è detta residuo isoprene. I
prenoli sono i precursori di una varietà di composti
tra cui gli steroidi, anche noti come isoprenoidi.
Prenili Esteri e loro derivati. (prenil difosfati, ecc.)
Il modo in cui una proteina si associa con la membrana riflette la sua funzione
parte del centro di reazione di un batterio fotosintetico
Una proteina transmembrana ha sempre
un’unica orientazione nel doppio strato
sintesi e inserzione asimmetriche
differenti funzioni dei suoi domini citosolico e non-citosolico
Nella maggior parte dei casi le proteine attraversano la membrana formando eliche
¾ legami peptidici polari
legami H interni alla catena peptidica
¾ acqua assente dal doppio-strato
proteine a molte eliche (vedi es 3)
# max di legami H ⇒ elica regolare
Indice di idropatia: predizione dei
tratti di α-elica transmembrana
Valori positivi: idrofobici
Valori negativi: idrofilici
A= glicoproteina
⇒ un singolo tratto α transmembranico
B= batteriorodopsina
⇒ 7 tratti α transmembranici
C = frazione di proteine di
membrana predette per E. coli,
S. cerevisiae, e uomo.
β barrels con un differente numero di β strands
β-barrel (# β-strands: 8 ÷ 22 ) più rigide delle α-eliche ⇒ migliore cristallizzazione ⇒ sono note varie strutture X
abbondanti in mitocondri, cloroplasti ed in molti batteri; la maggior parte delle proteine transmembrana negli eucarioti è
fatta di α−elica ⇒ più flessibili ⇒ cambiamenti nella disposizione più facili ⇒ apertura e chiusura dei canali
¾ porine ⇒ pori per far passare soluti ⇒ le catene laterali polari all’interno, non-polari in interazione con le code del
doppio-strato
¾ proteine di trasporto ⇒ Fe attraverso la membrana esterna di un batterio ⇒ 22 β-barrel + un dominio globulare
¾ Recettore di enzimi ⇒ β-barrel usato come ancora per le proteina
La gran parte delle proteine transmembrana nelle cellule animali
sono glicosilate
Le catene oligosaccaridi sono sempre nella parte non citosolica
Il citosol è in genere un ambiente riducente ⇒ questo
diminuisce le probabilità che ci siano ponti S-S nella regione
citosolica
I ponti S_S si formano nella parte non-citosolica dove
stabilizzano la struttura
Le proteine transmembrana possono essere
solubilizzate solo con detergenti (piccole
molecole anfipatiche che fomano micelle in
acqua)
la parte idrofobica del detergente lega la parte idrofobica
della proteina staccandola dai lipidi
Poichè l’altra parte del detergente è polare, la proteina tende
ad andare in soluzione e alcune molecole di lipide possono
rimanere attaccate
La parte polare del detergente può essere carica o no
SDS è un detergente forte (solubilizza anche la
proteina più idrofobica) ⇒ denaturazione
(spesso) ad opera del legame con il loro core
idrofobico ⇒ a volte si rinatura dopo rimozione
del detergente
Molte proteine possono essere solubilizzate con
un detergente più leggero come il Triton X-100
e rimanere funzionali
Pompa Na+-K+ funzionale:
purificata e
incorporata in vescicole di fosfolipidi.
Presente nella maggior parte delle cellule
animali, usa l’idrolisi dell’ATP per pompare
Na+ fuori e K+ dentro la cellula
La membrana cellulare dei globuli rossi è la più studiata di quelle eucariotiche
¾ reperibili in numero elevato
¾ relativamente pure
¾ la membrana plasmatica è la sola presente (non c’è nucleo, nè altri organelli)
(in altre cellule la membrana plasmatica è meno del 5%)
Micrografia a scansione elettronica di globuli rossi umani
Forma biconcava; assenza di nucleo e altri organelli
E’ facile preparare globuli rossi vuoti ("ghosts“):
cellule in un mezzo con una concentrazione di sale minore di quella all’interno della cellula
⇒lisi
⇒ l’emoglobina e le altre proteine citosoliche escono
Le membrane dei ghosts possone essere studiate aperte o risaldate
Durante la risaldatura si possono anche preparare vescicole inverse
Come si determina da che parte “sporgono” le proteine transmembrana?
Si attaccano covalentemente reagenti (radioattivi o fluorescenti) che non penetrano la membrana
⇒ solubilizzazione con SDS ⇒ autoradiografia o fluorescenza
proteina transmembrana:
etichetta sia all’esterno (nelle cellule intatte o nei ghosts saldati)
che all’interno (nelle vescicole inverse)
Esposizione di interno ed esterno ad enzimi proteolitici che non penetrano la membrana
proteina transmembrana: digerita da entrambi i lati
A. Colorazione con Coomassie blue
B. Posizione delle principali proteine nel gel
Glicoporina in rosso ⇒ la grande quantità di carboidrati
carichi negativamente la fa migrare lentamente come le
proteine più grandi della banda 3
Ci sono circa 15 bande principali per un peso molecolare
che va da 15000 a 250000 daltons.
Tre proteine: spettrina, glicoproteina e banda 3 sono più
del 60% (in peso) del totale delle proteine e ognuna di
loro è disposta in modo differente nella membrana
elettroforesi su gel di poliacrilamide con SDS delle proteine di membrana nei globuli rossi umani
La maggior parte delle proteine di membrana associate con i globuli rossi sono legate dalla parte del citosol
Spettrina (≈ 25% in massa proteine membrana ≈ 2.5 × 105 copie per cellula): filamento sottile (≈100 nm)
Mantiene la forma biconcava delle cellule
Eterodimero: 2 subunità simili, associate testa-testa per fomare un tetramero
Le code di 4 o 5 tetrameri collegate da link con filamenti di actina ed altre proteine del citoscheletro
Risultato finale: una rete flessibile che si estende su tutta la superficie citosolica della membrana che permette
alle cellule di passare attraverso la strettoia dei capillari
Individui (topi e uomini) anemici con anormalità nel gene della spettrina hanno cellule sferiche e fragili
Ciascun eterodimero è formato da 2
catene polipeptidiche controavvolte
attaccate non covalentemente tra
loro in punti multipli
Le teste fosforilate dove i dimeri si
associano per formare il tetramero
Le cateneα e β sono composte in
prevalenza di domini ripetuti di 106
amino acidi
I dimeri di spettrina sono connessi da
complessi formati da filamenti di
actina (13 monomeri), adducina, e una
molecola di tropomiosin
Il citoscheletro è collegato alla membrana con un legame indiretto
del tetrametro di spettrina ad alcune proteine della banda 3 via
molecole di anchirina, o con quelle della banda 4.1 via glicoproteine
Elettromicrografia del citoscheletro dal lato citosol
La densità della rete di spettrina è appositamente
diminuita per rendere visibili i dettagli: in una cellula
normale è molto più densa
La Batteriorodopsina è uno degli elementi del trasduttore di energia solare che fornisce energia ai batteri
E’ una proteina transmembrana ad attraversamento
multiplo (7 catene).
Ciascuna molecola contiene un cromoforo (retinale).
Il retinale è identico al cromoforo della rodopsina
(vitamina A)
Il retinale è legato covalentemente ad una lisina.
Cromoforo eccitato da un singolo fotone ⇒ cambiamento di forma ⇒ piccoli cambiamenti conformazionali nella proteina ⇒
trasferimento di un H+ da dentro a fuori della cellula.
Trasferimento di protoni ⇒ gradiente di H+ attraverso la membrana ⇒ produzione di ATP da parte di una seconda proteina di membrana
Esempio di Proteine di Membrana in complesso:
Il centro di reazione fotosintetico batterico
Struttura X: Il complesso consiste di quattro
subunità: L, M, H, e un citocromo.
Le subunità L e M formano il core del centro di
reazione, ciascuna contiene 5 eliche α che
attraversano il doppio strato.
La localizzazione dei vari coenzimi di trasporto
è mostrata in nero.
Le proteine , come i lipidi, non cambiano
strato (flip-flop) ma ruotano intorno ad un
asse perpendicolare al piano del doppio
strato (diffusione rotazionale) e molte sono
anche in grado di muoversi lateralmente
(diffusione laterale).
La prima diretta evidenza della mobilità
delle proteine di membrana è venuta da un
esperimento dove le cellule di topo sono
state artificialmente fuse con quelle umane
per ottenere cellule ibride (eterocarioni).
Sono stati usati due anticorpi etichettati
diversamente per distinguere le proteine
umane da quelle di topo.
All’inizio i due tipi di proteine sono
confinate nella loro metà in circa mezz’ora
diffondono lateralmente e si mescolano le
une con le altre
La velocità di diffusione (laterale) si misura con
1. FRAP (Fluorescence Recovery After Photobleaching)
La proteina è marcata con un gruppo fluorescente
(anticorpi con ligante fluorescente o DNA
ricombinante che esprime la proteina fusa con la
“green fluorescent protein, GFP).
Il gruppo fluorescente è “sbiancato” (bleached) con un
laser in una piccola area e si misura il tempo
impiegato dalle forme unbleached a ripristinare il
segnale nell’area (=tempo di diffusione)
2. FLIP ( fluorescence loss in photobleaching)
Un laser irradia continuamente una piccola area
ammazzando progressivamente il segnale totale
I valori di diffusione per proteine differenti sono molto
diversi a causa dell’interazione con altre proteine.
La misura della velocità di diffusione per proteine
“libere” indica che le membrane cellulari hanno una
viscosità che è circa quella dell’olio di oliva