Oncogeni: geni
antiapoptotici
Geni antiapoptotici:BCL2
P IgH
IgH
14
18
Bcl-2
P Bcl-2
• t(14;18) trasporta il promotore IgH al gene
Bcl-2 (18q21)
• Sintesi costitutiva di BCL2 e inibizione
dell’apoptosi
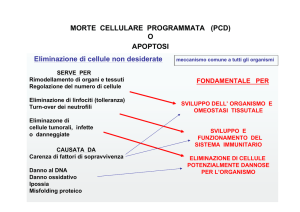
Apoptosi
•
Caratteristiche morfologiche associate a morte cellulare
che portano alla dissoluzione della cellula e alla fagocitosi.
•
Caratteristiche biochimiche associate a morte cellulare
– Frammentazione del DNA
– Alterazione della compartimentalizzazione di lipidi di
membrana
Caratteristiche morfologiche
dell’apoptosi
Apoptosi: aspetto microscopico delle
cellule
Downloaded from: Robbins & Cotran Pathologic Basis of Disease (on 14 March 2006 06:42 PM)
© 2005 Elsevier
Apoptosi
•
Caratteristiche morfologiche associate a morte cellulare che
portano alla dissoluzione della cellula e alla fagocitosi.
•
Caratteristiche biochimiche associate a morte cellulare
– Frammentazione del DNA a livello internucleosomale con
formazione di frammenti di 200bp e multipli
– Alterazione della compartimentalizzazione di lipidi di
membrana con esposizione della fosfatidilserina e altre
proteine riconosciute dai fagociti
Apoptosi: frammentazione del DNA
Downloaded from: Robbins & Cotran Pathologic Basis of Disease (on 14 March 2006 06:42 PM)
© 2005 Elsevier
Table 9.3 The Biology of Cancer (© Garland Science 2007)
Figure 9.22a The Biology of Cancer (© Garland Science 2007)
Figure 9.22b The Biology of Cancer (© Garland Science 2007)
nematodi
CED-9
gene anti-apoptotico che si
colloca a monte nella via di
trasduzione del segnale
apoptotico
vertebrati
Bcl-2
Gene clonato da un linfoma
follicolare umano a funzione
antiapoptotica.
Human Bcl-2 ------MAHAGRTGYDDNREIVMKYIHYKLSQRGYEWDAGDVGAAPPGAAPAPGIFSSQPG
Worm CED-9 ESIDGKINDWEEPRLDIEGFVVDYFTHRIRQNGMEWFG---------------------: . .. * . :*:.*: ::: *.* ** .
Human Bcl-2 HTPHPAASRDPVARTSPLQTPAAPGAAAGPALSPVPPVVHLTLRQAGDDFSRRYRRDFAE
Worm CED-9 ----------------------APGLPCG------VQPEHEMMRVMGTIFEKKHAENFET
*** ..*
* :* * *.::: .:*
Human Bcl-2 MSSQLHLTPFTARGRFATVVEELFRDG-----VNWGRIVAFFEFGGVMCVESVN-REMSP
Worm CED-9 FCEQLLAVPRISFSLYQDVVRTVGNAQTDQCPMSYGRLIGLISFGGFVAAKMMESVELQG
:..** .* : . : **. : .
:.:**::.::.***.:..: :: *:.
Human Bcl-2 LVDNIALWMTEYLNRHLHT-WIQDNGGWDAFVELYGPSMRPLFDFSWLS----LKTLLSL
Worm CED-9 QVRNLFVYTSLFIKTRIRNNWKEHNRSWDDFMTLG-KQMKEDYERAEAEKVGRRKQNRRW
* *: :: : ::: :::. * :.* .** *: *
.*: :: : .
*
Human Bcl-2 ALVGACITLGAY--LGHK---------Worm CED-9 SMIGAGVTAGAIGIVGVVVCGRMMFSLK
:::** :* **
:*
Regolazione molecolare dell’ apoptosi
Famiglia Apoptosoma
Bcl-2
Caspasi
Regolazione molecolare dell’ apoptosi
famiglia
Bcl-2
Modulatorsi dell’ Apoptosi: famiglia
delle proteine bcl-2
•
•
•
•
Bcl (B cell lymphoma)-2
clonato da una traslocazione
cromosomica
Protegge la cellula da
apoptosi indotta da
deprivazione di fattori di
crescita e altri stimoli
Omologo funzionale di ced9
Comprende membri pro- ed
anti-apoptotici
Regolazione molecolare dell’ apoptosi:
la famiglia delle proteine bcl-2
1) Possiedono i cosiddetti domini di omologia a Bcl-2 (BH1,
BH2, BH3)
2) La famiglia comprende membri anti- e pro- apoptotici
3) I domini BH interagiscono con domini omologhi, creando
oligomeri fra proteine pro ed anti-apoptotiche.
4) Possiedono domini transmembrana che permettono
l’inserimento nelle membrane (incluse le membrane
mitocondriali esterne)
5) Esercitano il loro effetto sulla permeabilita’ delle
membrane mitocondriali esterne
Regolazione molecolare dell’ apoptosi:
la famiglia delle proteine bcl-2
Regolazione molecolare dell’ apoptosi:
la famiglia delle proteine bcl-2
Cellula Apoptotica
Cellula Normale
Figure 9.27a The Biology of Cancer (© Garland Science 2007)
Figure 9.27c The Biology of Cancer (© Garland Science 2007)
Regolazione molecolare dell’ apoptosi:
l’apoptosoma
Apoptosoma
Regolazione molecolare dell’ apoptosi:
l’apoptosoma
Apaf-1
- omologo umano di Ced-4
- richiesto per attivare le proteasi caspasi in alcune
vie di trasduzione apoptotica
- possiede 3 domini caratteristici
1) dominio CARD - Caspase Recruitment Domain
2) motivo di omologia a Ced-4 - lega dATP/ATP
3) WD40 repeats - legano il citocromo C
Regolazione molecolare dell’ apoptosi:
l’apoptosoma
1) Citocromo c
2) Apaf-1 (Apoptotic protease activating factor 1)
Regolazione molecolare dell’ apoptosi:
l’apoptosoma
procaspase9
procaspase9
procaspase9
procaspase9
- La formazione dell’ apoptosoma permette il
reclutamento della caspasi per esposizione del
dominio CARD
Regolazione molecolare dell’ apoptosi:
le caspasi
Caspasi:
Cystein-dependent
Aspartate-specific
proteases
Regolazione molecolare dell’ apoptosi:
le caspasi
1) Sono cisteina-proteasi che tagliano piu’di 100 substrati ed
inducono morte cellulare
– lamine nucleari
– enzimi di riparo del DNA
inattivazione
– proteine del citoscheletro
– altre caspasi (Cascata delle Caspasi)
attivazione
– DNAasi attivata dalle Caspasi-(CAD)
2) Le Caspasi sono sintetizzate come zimogeni inattivi
Regolazione molecolare dell’ apoptosi:
le caspasi
3) L’apoptosi si basa sulla attivita’ delle caspasi
4) Due classi distinte
a) Caspasi iniziatrici (8, 9)
- attivate da eventi di segnalazione a monte che
causano la aggregazione delle procaspasi e
l’attivazione del taglio proteolitico
- tagliano e attivano le caspasi effettrici
b) Caspasi effettrici (3, 7)
- acttivate da Caspasi iniziatrici
- responsabili del taglio della maggior parte dei
substrati apoptotici
Regolazione molecolare dell’ apoptosi:
le caspasi
Regolazione molecolare dell’ apoptosi:
due vie di trasduzione
1) Via intrinseca
- l’apoptosi e’ iniziata per problemi
all’interno della cellula (danno al DNA,
stress ossidativo, danno mitocondriale)
2) Via estrinseca
- l’apoptosi e’ iniziata da segnali che
provengono dall’esterno della cellula
Regolazione molecolare dell’ apoptosi:
la via intrinseca
Apoptosoma
Bcl-2
Bax
danno al DNA
Regolazione molecolare dell’ apoptosi:
la via estrinseca
Legame di FASL al suo recettore
Induzione di trimerizzazione
Reclutamento di Fadd e di caspasi 8
(DISC: death-inducing signalling
Complex)
Attivazione di caspasi 8
Apoptosi mediata da recettori
Legame di “recettori di morte”:
- Recettore del TNF
TNF
- Fas
Fas ligando
- DR1-4
TRAIL
Cellule infiammatorie:
Rilascio di ligandi
Contatto cellula-cellula
Table 9.4 The Biology of Cancer (© Garland Science 2007)
Inibitori dell’apoptosi: le proteine IAP
•
Legano le procaspasi per prevenirne l’attivazione
– Inizialmente descritte come prodotti virali (p35 di baculovirus)
– Contengono delle sequenze ripetute che legano I metalli (~80aa)
BIR repeats
– Il numero e la sequenza dei of BIR’s detrmina la specificita’
dell’inibizione della of procaspasi
– Alcuni contengono RING fingers
•
Sette membri identificati finora
– NAIP, cIAP-1, cIAP-2, XIAP, survivin, livin e apollon (legano ed
inibiscono le caspasi 3, 7, 9)
•
Modulatori delle IAP
– Inibitori degli inibitori
– Smac/Diablo
L’apoptosi e’ determinata
dall’equilibrio fra inibitori e attivatori
A) Inibitori
•
•
Bcl2
IAP
B) Attivatori
•
•
•
Recettori di morte
Bax
Caspasi
Fase finale dell’apoptosi: fagocitosi delle
cellule apoptotiche
Eseguita da cellule professionali e semi-professionali
(fagociti, cellule epiteliali)
Indotta da cambi di membrana della cellula apoptotica
Con esposizione di fosfatidilserina e molecole di
Riconoscimento per i fagociti
Esempi di
apoptosi
- Apotosi da deprivazione di fattori di crescita o ormoni:
innescata dalla via intrinseca per accumulo di membri
pro-apoptotici della famiglia bcl-2
-Apoptosi da danno al DNA: innescata dall’accumulo
di p53 che attiva la trascrizione di induttori dell’apoptosi
(bax, bak, apaf1)
-Apoptosi da attivazione di recettori della famiglia del TNF:
innescata dal rilascio di TNF da parte di cellule immunitarie
-Apoptosi da linfociti T citotossici: determinata dal rilascio
di perforina, una proteina che induce pori transmembrana,
entrata nella cellula di granzima B che attiva direttamente
le caspasi
Table 9.5 The Biology of Cancer (© Garland Science 2007)
Figure 9.34 The Biology of Cancer (© Garland Science 2007)