MORTE CELLULARE PROGRAMMATA (PCD)
O
APOPTOSI
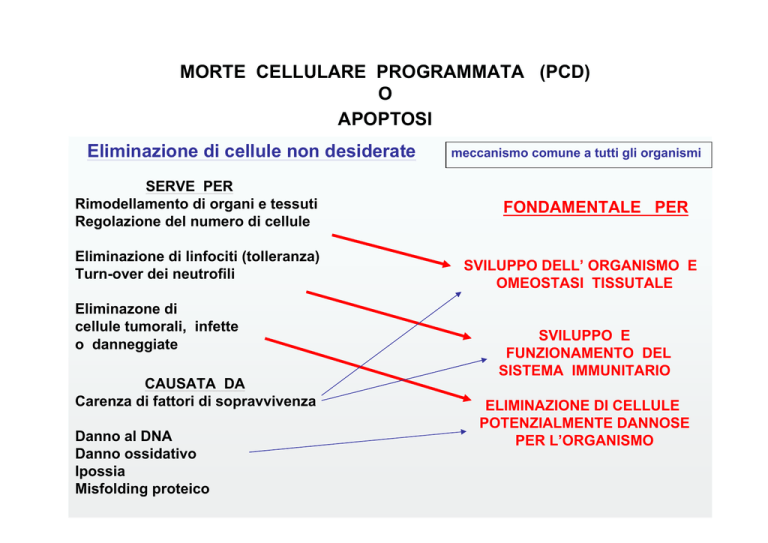
Eliminazione di cellule non desiderate
SERVE PER
Rimodellamento di organi e tessuti
Regolazione del numero di cellule
Eliminazione di linfociti (tolleranza)
Turn-over dei neutrofili
Eliminazone di
cellule tumorali, infette
o danneggiate
CAUSATA DA
Carenza di fattori di sopravvivenza
Danno al DNA
Danno ossidativo
Ipossia
Misfolding proteico
meccanismo comune a tutti gli organismi
FONDAMENTALE PER
SVILUPPO DELL’ ORGANISMO E
OMEOSTASI TISSUTALE
SVILUPPO E
FUNZIONAMENTO DEL
SISTEMA IMMUNITARIO
ELIMINAZIONE DI CELLULE
POTENZIALMENTE DANNOSE
PER L’ORGANISMO
FATTORI DI CRESCITA
CRESCITA CELLULARE (aumento del volume)
MITOGENI
G1- e G1/S-Cdk
PROLIFERAZIONE (aumento del numero)
APOPTOSI
(morte cellulare programmata)
CARENZA DI
FATTORI DI SOPRAVVIVENZA
VARI FATTORI HANNO ATTIVITA’ MULTIPLE
NELLA APOPTOSI
Flipping
di fosfatidil-serina
Segnale
“MANGIAMI”
Cellule di linfoma trattate con il chemioterapico Camptothecin
ESPOSIZIONE DI
FOSFATIDIL-SERINA
sulla faccia esterna
della membrana
CORPI APOPTOTICI
Marcatura con
ANNESSINA V
Legata a
con fluorofori
ATTIVAZIONE DELLE CASPASI
(Cut on Asp)
ATTIVAZIONE “ A CASCATA”
Iniziatrici
Effettrici
Caspasi
sempre presenti
nella cellula
Inibitori di DNAsi
Componenti del citoscheletro
Molecole di adesione
Lamìna nucleare
Frammentazione DNA
Formazione dei corpi apoptotici
Dissolvimento del nucleo
dallo stimolo apoptogeno
FRAMMENTAZIONE
DEL DNA
ENDONUCLEASI
“DNA ladder”
“DOSAGGIO”
DEI
NICK
del DNA
Metodo
TUNEL
MEMBRANA NUCLEARE
APOPTOSI (PCD)
DUE MODALITA’ DI
INNESCO
Via estrinseca
Via intrinseca
STIMOLO
ESTERNO
Recettori
“di morte”
STIMOLO
INTERNO
Mitocondri
Procaspasi
iniziatrici
8 e/o 10
Procaspasi
Iniziatrice
9
Caspasi
effettrici
Formazione di corpi apoptotici
MECCANISMI
“A MONTE”
DIVERSI
UGUALI
CONSEGUENZE
VIA ESTRINSECA
Recettori per
Ligando FAS
Oppure
Proteina di membrana
recettori per fattori solubili
TNF (Tumor Necrosis Factor)
Complesso di
segnalazione
PROTEOLISI
FRAMMENTAZIONE
DEL DNA
VIA INTRINSECA
in cellule di vertebrati
Nei mitocondri:
catena respiratoria
Gruppo EME
Citocromo c
Nel citoplasma:
Induzione
APOPTOSI
Formazione
dell’eptamero
Reclutamento e
attivazione
procaspasi 9
CASCATA
PROTEOLITICA
REGOLAZIONE DELLA VIA INTRINSECA
Proteine della famiglia Bcl2
Salvaguardano l’integrità
del mitocondrio
inibendo le proteine BH123
Se non più inibite si aggregano
sulla membrana mitocondriale:
formazione di canali
di rilascio per il citocromo c
Inibiscono Bcl2
attivando BH123
NON ATTIVE O
NON PRESENTI
IN CELLULE
NORMALI
ATTIVAZIONE
STIMOLI APOPTOTICI DI VARIA ORIGINE
VIA INTRINSECA INATTIVA
ATTIVA
STIMOLI
APOPTOTICI
DI VARIA ORIGINE
ATTIVAZIONE DI
PROTEINE
BH3-only
ATTIVAZIONE
dell’ APOPTOSI
BH3-only
“a monte”
family
APOPTOSI
PROTEINE IAP
(inibitori dell’ apoptosi)
INIBIZIONE DELL’ APOPTOSI “A VALLE”
Inibiscono le caspasi
Meccanismo di sicurezza (superamento di una soglia)
Scoperte in alcuni virus
apoptotic
protease
activating factor
Fas-associated death
domain
iniziatrici
effettrici
Danni da radiazioni
bloccano l’entrata in fase S
in attesa di riparazione.
NO
SI
Rimozione
di p21
e
proliferazione
P53
GUARDIANO
DEL
GENOMA
CKI
Inibitore di Cdk
p53
induce
apoptosi
Induzione
di fattori
BH3-only
ATM and ATR
exhibit selective target specificities in response to
different forms of DNA damage.
The “ataxia telangiectasia” mutated (ATM)
protein kinase
is activated in response to double strand DNA breaks.
ATR (ATM and Rad3-related) protein kinase
is activated following
ultra-violet (UV) light-induced DNA damage
such as pyrimidine dimers .
INIBIZIONE dell’ APOPTOSI
“a monte”
AZIONE DI FATTORI DI SOPRAVVIVENZA





![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)